B7-H4和Foxp3+Treg在宫颈病变组织中的表达及临床意义
2019-09-23舒丽莎
刘 畅,李 坤,舒丽莎△,张 凡
(河北北方学院附属第一医院:1.妇产科;2.病理科,河北张家口 075000)
宫颈癌是女性生殖道恶性肿瘤之一,全球宫颈癌每年死亡病例达26.57万[1],中国占全世界死亡病例总数的20.1%[2]。其中,局部晚期宫颈癌是导致肿瘤患者死亡的主要原因。肿瘤的发生、发展与免疫逃逸密切相关。B7同源体4(B7 homolog4,B7-H4)是B7家族的负性共刺激分子,其表达上调能抑制机体免疫应答。在胰腺癌[3]、结直肠癌[4]的研究中发现过表达B7-H4能抑制T细胞活化、增殖,在肿瘤进展中起重要作用。调节性T细胞(regulatory T cell,Treg)是以发挥免疫抑制功能为主的T细胞亚群,广泛分布于多种恶性肿瘤的间质中,Treg的聚集与肿瘤的不良预后密切相关[5-7]。本文通过检测B7-H4、叉状头/翅膀状螺旋转录因子3阳性(forkhead/winged helix transcription factor3,Foxp3+)Treg在宫颈病变组织中的表达,并探讨二者的临床意义,旨在为宫颈癌的免疫治疗提供新靶点及思路。
1 资料与方法
1.1一般资料 收集本院妇产科2016年10月至2018年5月行宫颈活检或宫颈手术的石蜡包埋标本。按第四版世界卫生组织(WHO)女性生殖器官肿瘤分类标准[8],以组织病理学诊断为金标准。对照组患者年龄40~55岁,平均(46.2±3.00)岁。宫颈病变患者年龄40~59岁,平均(48.6±5.90)岁,组间年龄比较差异无统计学意义(P>0.05)。所有患者既往未接受过药物及放化疗治疗,排除自身免疫性疾病及其他恶性肿瘤。其中,宫颈癌组织标本50份(宫颈癌组)、宫颈高级别上皮内瘤变(high grade squamous intraepithelial,HISL)组织标本30份(HISL组)、宫颈低级别上皮内瘤变(low grade squamous intraepithelial,LSIL)组织标本30份(LSIL组)。对照组为因子宫良性病变行全子宫切除的病灶旁正常宫颈组织20份。在50份宫颈癌标本中,病理类型均为宫颈磷状细胞癌。其中,国际妇产科联盟(FIGO)分期Ⅰ期19例,Ⅱ期31例;高分化22例,中低分化28例;肿瘤大于或等于4 cm的18例,小于4 cm的32例;有淋巴结转移19例,无淋巴结转移31例。本研究征得患者知情同意,并经医院医学伦理委员会批准。
1.2方法
1.2.1主要试剂与仪器 小鼠抗人Foxp3单克隆抗体(Ab20034),兔抗人B7-H4抗体(ab5069)抗体均购自英国Abcam公司,抗体稀释浓度分别为1∶100、1∶150,免疫组织化学SP试剂盒购自北京博奥森公司,二氨基联苯胺(DAB)显色剂购自丹麦Dako公司。CX21光学显微镜购自日本Olympus公司。
1.2.2检测方法 将石蜡包埋组织4 μm连续切片,切片固定于经多聚赖氨酸处理的载玻片上。经二甲苯、梯度乙醇常规脱蜡、脱水,高压抗原修复[B7-H4使用pH值6.0柠檬酸缓冲液,Foxp3使用pH值9.0乙二胺四乙酸(EDTA)缓冲液]。按照博奥森SP免疫组织化学试剂盒操作说明进行操作,3%过氧化氢(H2O2)室温孵育 15 min 灭活内源性过氧化物酶的活性,磷酸盐缓冲液(PBS)清洗。山羊血清室温封闭 20 min。切片分别滴加一抗,4 ℃ 冰箱过夜孵育 14 h。滴加相应二抗室温孵育30 min,辣根酶标链霉卵白素室温孵育20 min, DAB室温显色,苏木素复染,分化反蓝、脱水、透明、中性树胶封固。以PBS缓冲液替代一抗作为阴性对照组。
1.2.3结果判定标准 B7-H4阳性表达在肿瘤细胞的细胞质及细胞膜中,显微镜下选取5个高倍视野,以细胞的细胞质有黄至棕褐色为B7-H4阳性细胞。按染色强度分级:无染色(0分)、浅黄色(1分)、棕褐色(2分)、褐色(3分)。按阳性细胞所占比例计分:无阳性细胞为0分,<10%为1分,10%~50%为2分,>50%为3分。两项指标乘积,<4分为低表达,≥4分为高表达。Foxp3+主要表达在淋巴细胞的细胞核中。每个切片显微镜下选取5个高倍视野(×200),以细胞核黄色或棕褐色为Foxp3+Treg,计算5个高倍视野Foxp3+Treg平均值。
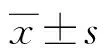
2 结 果
2.1B7-H4和Foxp3+Treg在不同宫颈组织中阳性表达水平比较 B7-H4在宫颈癌组、HISL组、LSIL组、对照组宫颈组织的阳性表达率分别为78.00%(39/50)、46.67%(14/30)、26.67%(8/30)、10.00%(2/20)。与对照组比较,宫颈癌组、HISL组中B7-H4阳性率明显升高,组间比较差异有统计学意义(χ2=27.22、7.41,P<0.01)。B7-H4阳性率在LSIL组与对照组之间比较差异无统计学意义(χ2=2.08,P>0.05)。宫颈癌组B7-H4表达阳性率明显高于HISL、LISL组,差异有统计学意义(P<0.01)。Foxp3+Treg在正常宫颈组织几乎不表达,阳性表达主要定位于肿瘤间质的淋巴细胞的细胞核。与对照组比较,宫颈癌组、HISL及LISL组中Foxp3+Treg阳性数明显升高,各组间比较差异有统计学意义(t=-20.30、-15.93、-2.25,P<0.05)。宫颈癌组Foxp3+Treg阳性数明显高于HISL及LSIL组,随着宫颈病变的加重,Foxp3+Treg阳性数明显增多,差异有统计学意义(t=-8.81、-23.02,P<0.01)。B7-H4和Foxp3+Treg在不同宫颈组织中阳性表达水平比较,见表1。
2.2B7-H4和Foxp3+Treg的表达与宫颈癌临床病理特征间的关系 在宫颈癌组织中, FIGO分期Ⅱ期B7-H4的表达水平明显高于FIGO分期Ⅰ期,差异有统计学意义(χ2= 6.202,P<0.05)。B7-H4的表达与肿瘤大小、分化程度及淋巴结转移无明显相关性(χ2=3.760、0.005、1.746,P>0.05)。Foxp3+Treg细胞数与肿瘤大小及淋巴转移密切相关,肿瘤直径大于或等于4 cm者肿瘤浸润的Foxp3+Treg数量高于肿瘤直径小于4 cm者(t=2.084,P<0.05),淋巴结转移阳性者肿瘤浸润的Foxp3+Treg数量高于淋巴结转移阴性者(t=2.277,P<0.05)。Foxp3+Treg数与组织分化程度及FIGO分期无明显相关性(t=0.348、1.754,P>0.05),见表2。
2.3宫颈癌组织中B7-H4、Foxp3+Treg表达的相关性 Spearman秩相关分析显示,在宫颈癌组织中B7-H4与Foxp3+Treg表达呈正相关(r=0.34,P<0.01)。
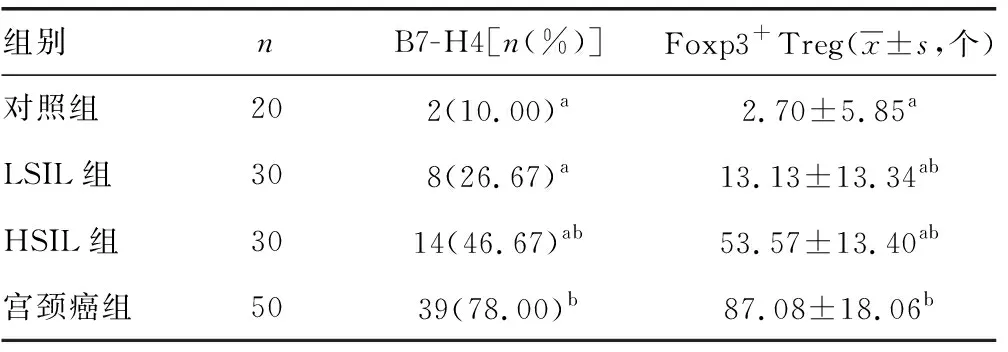
表1 不同宫颈组织中B7-H4及Foxp3+Treg
a:P<0.01,与宫颈癌组比较;b:P<0.05,与对照组比较
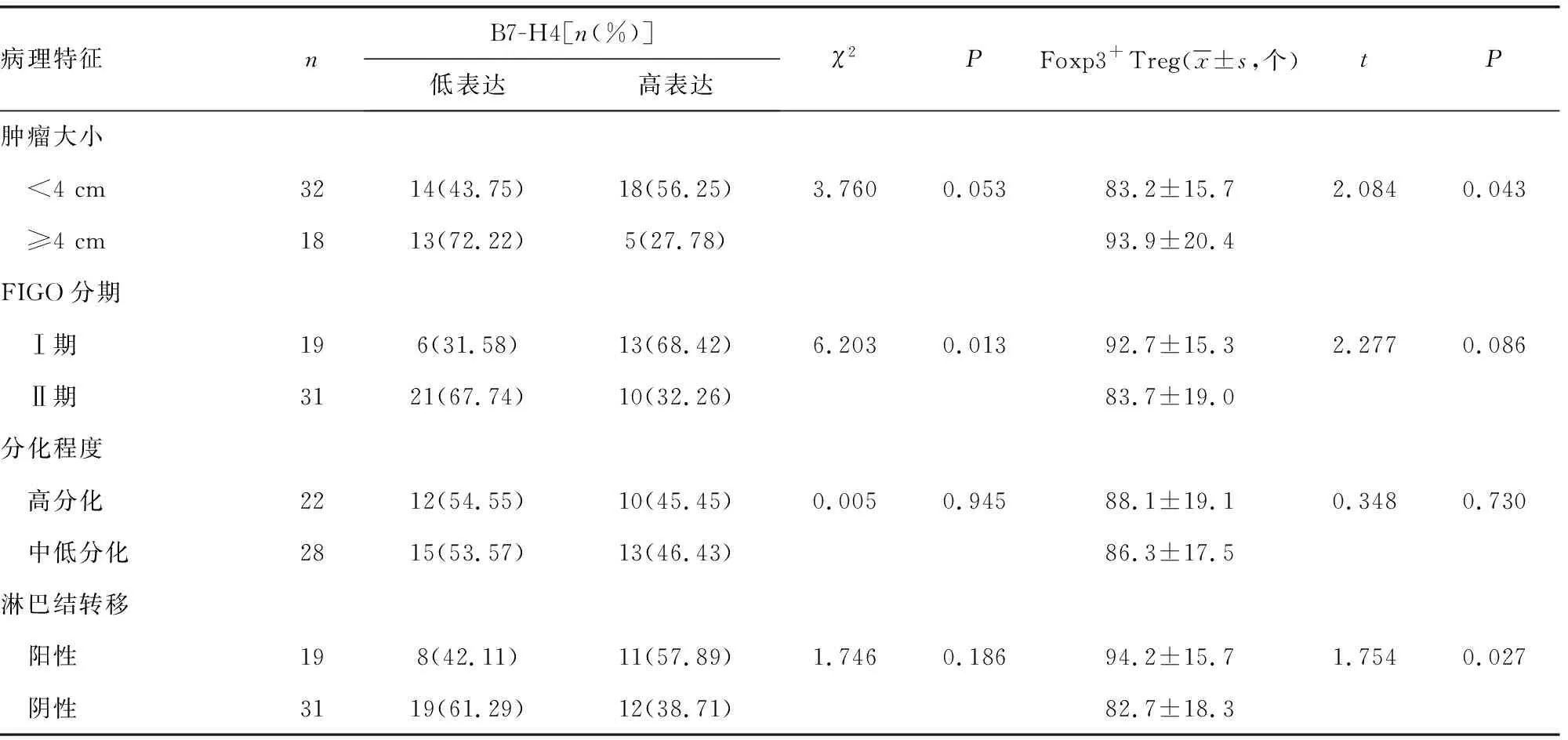
表2 宫颈癌组织中B7-H4及Foxp3+Treg表达与临床病理特征的关系(n=50)
3 讨 论
宫颈癌是发生在子宫颈鳞-柱交界处的恶性肿瘤。随着生活方式的改变,使宫颈癌的发病呈年轻化。虽然手术及放射、化学药物等治疗,使宫颈癌患者的病死率明显降低。但对于晚期及复发的宫颈癌仍是临床治疗中的难点。近年,许多免疫疗法在某些晚期恶性肿瘤治疗中取得重大突破,由此为宫颈癌免疫治疗开拓了新的治疗方法。
HANAHAN等[9]指出免疫逃逸是肿瘤发展过程中新的表型,是肿瘤发生、转移的重要原因。从人乳头瘤病毒(HPV)感染发展到宫颈癌,患者宫颈局部微环境中的免疫功能受到抑制,能够让肿瘤细胞避开免疫的生理破坏,尤其是T细胞、B细胞和自然杀伤细胞的破坏作用,从而促进宫颈癌发生、发展及转移。B7-H4是B7家族的新成员,被认为是免疫应答的负调节因子。B7-H4存在于抗原提呈细胞表面,与T细胞表面受体结合的配体相互作用,通过抑制T细胞增殖及细胞因子产生发挥抗肿瘤免疫作用[10]。LIU等[11]发现宫颈癌组织中B7-H4表达明显上调,并且高表达的B7-H4与患者不良预后相关,推测B7-H4能作为评估宫颈癌患者临床预后的潜在生物标记物。CHEN等[12]发现喉癌组织中高表达B7-H4可能与肿瘤复发密切相关,通过阻断B7-H4信号通路可能成为肿瘤治疗靶点。B7-H4能活化相关信号通路促进细胞的侵袭、转移。HAN等[13]研究发现过表达B7-H4的宫颈癌细胞可通过调控磷酸化-酪氨酸蛋白激酶2/信号转导和转录激活因子3(JAK2/STAT3)信号通路,促进白细胞介素-10(IL-10)和转化生长因子-β1(TGF-β1)的产生,诱导癌细胞恶性进展。随着免疫检查点程序性死亡配体1(PD-L1)的阻断剂在晚期癌症治疗中取得明显疗效,B7家族逐渐引起关注。深入了解B7-H4在宫颈癌中的表达及功能可能为肿瘤免疫治疗提供新的靶点。本研究发现B7-H4在正常宫颈上皮几乎不表达,在宫颈癌组织中的表达明显上调。主要阳性定位在癌细胞的细胞膜及细胞质中,阳性率为78.00%(39/50),明显高于其他3组。随着宫颈病变的发展,B7-H4的表达水平逐渐增高,当发展至宫颈癌时,B7-H4表达明显增强并广泛分布于癌变细胞中,表明 B7- H4在宫颈癌中能抵抗机体抗肿瘤免疫。因此,推断B7-H4对判断病变持续或进展有一定参考价值。FIGO分期对于评估患者预后有重要价值。本研究发现B7-H4的高表达与肿瘤的FIGO分期密切相关,说明随着肿瘤的进展,B7-H4的局部免疫抑制作用增强,有利于癌细胞增殖及转移。
肿瘤微环境的Treg是一类发挥负性调节作用的免疫细胞,能通过分泌抑制性细胞因子、干扰细胞代谢、介导靶细胞凋亡等途径抑制效应性细胞的功能,帮助肿瘤细胞逃避免疫攻击,促进肿瘤的发生、发展[14]。以往研究表明,Foxp3+Treg能在胰腺癌[5]、结直肠癌[6]、乳腺癌[7]患者外周血及肿瘤间质高表达,并与肿瘤预后不良相关。HUANG等[15]研究发现宫颈癌患者Foxp3+Treg阳性表达率为91.67%,阳性表达于T细胞的细胞核。此外,Foxp3+Treg的表达与肿瘤的大小及FIGO分期相关。本研究发现正常宫颈上皮及LISL组织中Foxp3+Treg微量表达,HSIL及宫颈癌组织中的Foxp3+Treg数明显增多。Foxp3+Treg主要浸润在肿瘤的间质部,聚集的Foxp3+Treg能直接抑制T细胞增殖及功能,促进肿瘤免疫逃逸。Treg在LISL局部微环境中抑制作用不明显,机体内利用强大的免疫系统使病变清除。当发展至HSIL及宫颈癌时,增多的Treg发挥明显免疫抑制作用,使病变不断进展。此外,本研究还发现Foxp3+Treg表达与肿瘤大小及淋巴转移密切相关,推测这可能与CC趋化因子22(CCL22)/CC趋化因子受体4(CCR4)介导的信号通路有关。肿瘤细胞能分泌CCL22,能通过CCR4受体招募Treg到肿瘤微环境,使Treg聚集在肿瘤周围,抑制效应细胞对肿瘤细胞的杀伤作用[16]。本研究与韩丽萍等[17]研究结果相近,该研究显示Foxp3+Treg表达随着宫颈病变的加重而增多,并与宫颈癌的淋巴结转移密切相关,提示Foxp3+Treg的高表达对宫颈癌患者的预后有一定影响。
此外,本研究还发现宫颈癌组织B7-H4与Foxp3+Treg表达呈正相关(r=0.34,P<0.01),推测二者在宫颈癌的发展过程中具有协同作用。一方面,B7-H4可能通过增加Foxp3+Treg的数量介导免疫逃逸。同时,浸润的Foxp3+Treg使局部免疫抑制有利于B7-H4的表达。
综上所述,宫颈癌组织中B7-H4、Foxp3+Treg表达上调,共同形成免疫抑制的微环境,参与肿瘤生长和转移。深入探讨二者在免疫逃逸中的作用及机制,是今后宫颈癌免疫治疗的研究方向。
