亚硒酸钠对汤姆青霉菌核分化和抗氧化性的影响
2019-09-23李改平韩建荣杜引弟
李改平,韩建荣,杜引弟
(1.山西卫生健康职业学院,山西晋中030619;2.山西大学生命科学与技术学院,山西太原030006;3.山西省中医学校,山西晋中030619)
抗氧化协同效应是指2 种或2 种以上的抗氧化物联合使用,获得高于单独使用其中任何一种抗氧化物抗氧化性的效果。其包括:抗氧化物与抗氧化物之间的协同效应、抗氧化物与维生素之间的协同效应、抗氧化物与有机酸及其衍生物之间的协同效应和抗氧化物与微量元素之间的协同效应[1]。在机体内,硒是一种必需的微量元素,本身具有一定抗氧化性,会与VE等抗氧化物产生抗氧化协同效应[2]。PT95 和Q1 菌株菌核内可积累类胡萝卜素和抗坏血酸等抗氧化物质,并具有一定的抗氧化性。
本试验将在MEA 培养基中添加不同浓度的亚硒酸钠(Na2SeO3),观察硒对PT95 和Q1 菌株菌核分化的影响,并通过测定菌核中的类胡萝卜素含量、抗坏血酸含量、总酚含量及其提取物的还原力、DPPH 自由基清除能力、亚铁离子螯合能力和清除超氧阴离子的能力来评价硒对PT95 和Q1 菌株菌核抗氧化性的影响;同时,采用正交试验设计对PT95 和Q1 菌株菌核的富硒培养条件进行了优化。
1 材料和方法
1.1 试验材料
1.1.1 菌株 供试菌株为Penicillium thomii PT95菌株和Penicillium thomii Q1 菌株,由山西大学生命科学学院提供,查氏(CA)斜面保存。
1.1.2 培养基 麦芽汁培养基(MEA):麦芽膏20 g,蛋白胨1.0 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL;马铃薯葡萄糖琼脂培养基(PDA):20%马铃薯煮汁1 000 mL,葡萄糖20 g,琼脂20 g。
1.2 试验方法
在PDA 和MEA 培养基中添加Na2SeO3,使得培养基中Na2SeO3的浓度分别达到3,6,10 μg/mL,这些培养基作为不同的富硒生长条件,同时以没有添加Na2SeO3的培养基作为对照。每个9 cm 培养皿倒入25 mL 培养基,凝固后用接种针挑取3 粒单菌核,用三点接种法接入培养皿中,置于黑暗条件下,25 ℃培养25 d。在培养过程中,每天观察菌株的渗出液渗出时间、菌核出现时间以及菌核成熟时间,并做好记录。
1.3 测定项目及方法
1.3.1 菌核生物量的测定 用蒸馏水将成熟的PT95 菌核和Q1 菌核从培养基表面冲洗下来,反复冲洗5~10 次,置于50 ℃烘箱中烘干至恒质量。
1.3.2 类胡萝卜素的提取及含量测定 按韩建荣等[3]和付荣荣等[4]的方法提取菌核中的类胡萝卜素,按王业勤等[5]的方法计算类胡萝卜素含量。
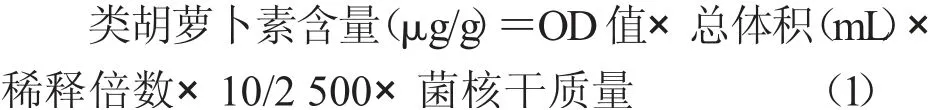
1.3.3 硒含量测定[6]
1.3.3.1 标准曲线绘制 分别取1.0~5.0 mL 的硒标准液(5 μg/mL)置于分液漏斗中,加入3 mL 邻苯二胺溶液(0.1%),并用蒸馏水补至50 mL 左右,混合均匀后用甲酸(80%)和浓氨水将pH 值调至2.0,将该混合物在室温下放于黑暗中静置60 min,用10 mL 甲苯振荡萃取该混合物3 min 后再静置8 min,弃去水层,将剩余的溶液转移至50 mL 容量瓶,并用甲苯定容,在335 nm 处比色。
1.3.3.2 菌核中硒含量测定 准确称取2 g 菌核,加入30 mL 混合酸(V(HNO3):V(H2SO4)=4∶1)后盖上表面皿,并于黑暗中冷消化24 h。将冷消化后的溶液加热消化至澄清,冷却后转移至50 mL 容量瓶中,并用水定容。
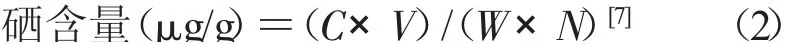
式中,C 为来自标准曲线的相当于硒的标准浓度(μg/mL);V 为从甲苯萃取得到的样品体积(mL);W 为样品质量(g);N 为用于测定的样品体积占总定容后样品的体积分数。
1.3.4 抗氧化性测定
1.3.4.1 提取菌核抗氧化物质 称取干菌核1 g,加入20 mL 乙醇(80%),在50 ℃150 r/min 的摇床上提取24 h,采用滤纸过滤保留滤液。滤渣仍用20 mL乙醇(80%)重复提取,2 次滤液合并,使用80%的乙醇稀释定容至100 mL 作为母液,滤渣烘干称质量。
1.3.4.2 总酚含量的测定 采用Folin-Cioncalteu比色法[8-9]测定样品总酚含量。在0.4 mL 菌核提取物稀释液或没食子酸稀释液中加入2.8 mL 蒸馏水和0.2 mL Folin-Cioncalteu 试剂,混合均匀后静置6~8 min,再加入0.6 mL 饱和Na2SeO3溶液,室温下黑暗静置120 min,在760 nm 处测定其OD 值。标准曲线则使用0.02,0.04,0.06,0.08,0.10 mg/mL 的没食子酸稀释液进行绘制。
1.3.4.3 DPPH 自由基清除能力的测定 DPPH 自由基清除能力的测定采用文献[10]进行。将200 μL样品液加入浓度为0.08 mmol/L 的DPPH(3.8 mL)中,充分摇匀后在室温下避光静置24 h,之后在517 nm处测定吸光度值。用提取溶剂代替样品液作为对照。EC50值是根据吸光度和样品液浓度来计算。
1.3.4.4 测定还原能力 用铁氰化钾还原法测定[11],EC50值是依据吸光度和样品液浓度计算。
1.3.4.5 亚铁离子螯合能力测定 其采用文献[12]的方法测定。将1.6 mL 样品溶液溶于1.6 mL 蒸馏水中,然后与0.4 mL 浓度为0.5 mmol/L 的FeCl2溶液混合摇匀,然后再加入0.4 mL 浓度为1 mmol/L的菲洛嗪。剧烈摇动1 min,室温下放置20 min,在562 nm 处测定吸光度值。以80%乙醇代替样品作为空白,0.5 mmol/L EDTA 作为阳性对照。EC50值是根据吸光度和样品液浓度来计算。
1.4 统计学分析
试验设3 次重复,结果以“平均值±标准差”表示,多个均数间的两两比较采用Duncan 多重比较法[13]。
2 结果与分析
2.1 亚硒酸钠对PT95 和Q1 菌株菌核分化的影响
在PDA 和MEA 培养基中添加不同浓度的Na2SeO3,结果发现,PDA 培养基表面几乎没有菌核形成,而MEA 培养基添加硒后比较有利于2 株菌核的分化。从表1 可以看出,在MEA 培养基中添加Na2SeO3,随着Na2SeO3浓度的提高,2 株菌株渗出液出现的时间都延后了1~2 d,菌核出现的时间延后了3~5 d,菌核成熟的时间延后了4~6 d,且Q1 菌株菌核的分化比PT95 菌株菌核的分化普遍要快。

表1 Na2SeO3 对PT95 和Q1 菌株菌核分化的影响 d
2.2 亚硒酸钠对PT95 和Q1 菌株菌核生物量的影响
从表2 可以看出,在添加Na2SeO3的培养基上,2 株菌株的菌核生物量与硒浓度呈显著负相关(rPT95=-0.901,rQ1=-0.939);当培养基中Na2SeO3的浓度为10 μg/mL 时,2 株菌株的菌核生物量最小,分别为0.20,0.09 mg/ 平板,是对照的0.80 倍和0.39 倍。

表2 Na2SeO3 对PT95 和Q1 菌株菌核生物量的影响 mg/平板
2.3 亚硒酸钠对PT95 和Q1 菌株菌核类胡萝卜素含量的影响
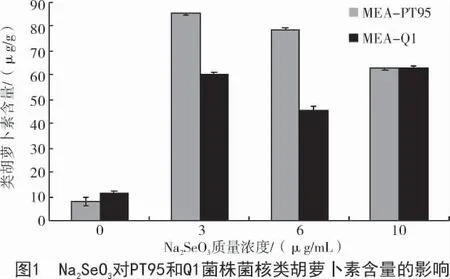
由图1 可知,在添加Na2SeO3的MEA 培养基上,PT95 菌株菌核中的类胡萝卜素含量与外源Na2SeO3浓度呈一定的正相关(r=0.526),当培养基中Na2SeO3的质量浓度为3 μg/mL 时,类胡萝卜素含量达到了最大(85.00 μg/g),是对照的10.76 倍;Q1 菌株菌核中的类胡萝卜素含量与外源Na2SeO3浓度呈一定的正相关(r=0.752),当培养基中Na2SeO3的质量浓度为10 μg/mL 时,类胡萝卜素含量达到了最大(62.90 μg/g),是对照的5.57 倍。
2.4 亚硒酸钠对PT95 和Q1 菌株菌核总酚含量的影响
从图2 可以看出,汤姆青霉PT95 菌株菌核提取物中总酚含量与外源Na2SeO3浓度之间有一定的负相关性(r=-0.367);Q1 菌株菌核提取物中总酚含量与外源Na2SeO3浓度之间有显著的负相关性(r=-0.908),对照的总酚含量最高,分别达到了15.59,15.15 mg/g,不同培养条件下菌核总酚含量的大小为MEA+Na2SeO310 μg/mL>MEA+Na2SeO33 μg/mL>MEA+Na2SeO36 μg/mL。

2.5 亚硒酸钠对PT95 和Q1 菌株菌核抗氧化性的影响
表3 显示,MEA 培养基上,PT95 和Q1 菌株菌核提取物还原能力的EC50值与外源Na2SeO3浓度之间有一定的负相关性(rPT95=-0.757,rQ1=-0.793),添加不同浓度的外源Na2SeO3后,2 个菌株菌核提取物还原能力的EC50值显著低于对照。
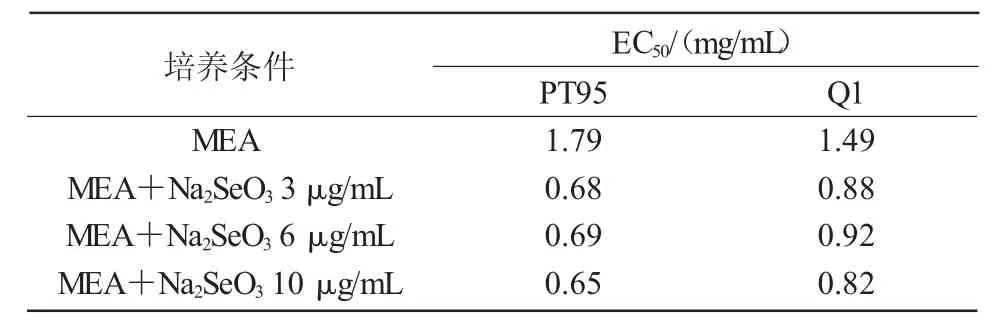
表3 Na2SeO3 对PT95 和Q1 菌株菌核还原力的影响
综上所述,当MEA 培养基中含有一定浓度的外源Na2SeO3(10 μg/mL)时,有利于2 株菌株菌核提取物还原力的提高。
从表4 可以看出,MEA 培养基上,汤姆青霉PT95 菌株菌核提取物DPPH 自由基清除能力的EC50值与外源Na2SeO3浓度之间有弱的正相关性(r=0.239);对照的DPPH 自由基清除能力最大(0.38 mg/mL),不同培养条件下,DPPH 自由基清除能力的大小为MEA+Na2SeO310 μg/mL>MEA+Na2SeO33 μg/mL>MEA+Na2SeO36 μg/mL。Q1 菌株菌核提取物DPPH 自由基清除能力的EC50值与外源Na2SeO3浓度之间有弱的负相关性(r=-0.230);不同培养条件下,DPPH 自由基清除能力的大小为MEA+NaNa2SeO310 μg/mL>MEA+Na2SeO33 μg/mL>MEA+Na2SeO36 μg/mL。
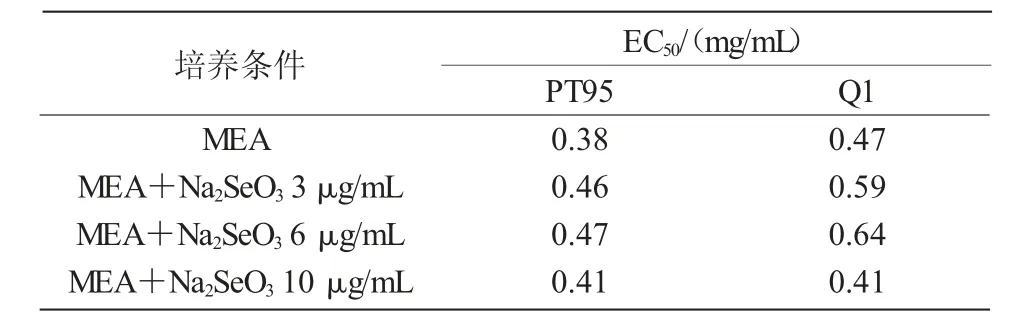
表4 Na2SeO3 对PT95 菌株和Q1 菌株DPPH自由基清除能力的影响
表4 结果表明,添加外源Na2SeO3不利于PT95菌株DPPH 自由基清除能力的提高,添加较高浓度的Na2SeO3(10 μg/mL)有利于Q1 菌株DPPH 自由基清除能力的提高,但提高的幅度不大。
从表5 可以看出,在MEA 培养基上,PT95 菌株菌核提取物亚铁离子螯合能力的EC50值与外源Na2SeO3浓度之间有显著的正相关性(r=0.936);对照的亚铁离子螯合能力最大(0.53 mg/mL),不同培养条件下,亚铁离子螯合能力的大小为MEA+Na2SeO36 μg/mL>MEA+Na2SeO33 μg/mL>MEA+Na2SeO310 μg/mL。Q1 菌株菌核提取物亚铁离子螯合能力的EC50值与外源Na2SeO3浓度之间有显著的正相关性(r=0.954),对照的亚铁离子螯合能力最大(0.41 mg/mL);不同培养条件下,亚铁离子螯合能力的大小为MEA+Na2SeO33 μg/mL>MEA+Na2SeO36 μg/mL>MEA+Na2SeO310 μg/mL。

表5 Na2SeO3 对PT95 和Q1 菌株亚铁离子螯合能力的影响
结果表明,添加外源Na2SeO3不利于2 株菌株亚铁离子螯合能力的提高。
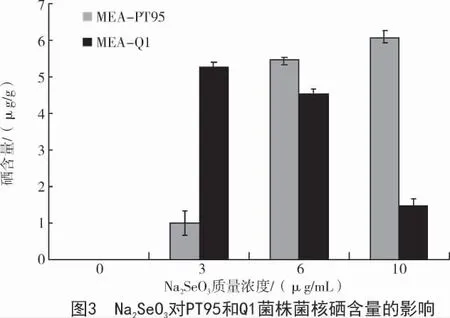
2.6 亚硒酸钠对PT95 和Q1 菌株菌核硒含量的影响
从图3 可以看出,在MEA 培养基上,PT95 菌株菌核的硒含量与外源Na2SeO3浓度之间有显著的正相关性(r=0.940),并在Na2SeO3的质量浓度为10 μg/mL 时达到最大(6.09 μg/g);Q1 菌株菌核的硒含量与外源Na2SeO3浓度之间有弱的正相关性(r=0.128),并在Na2SeO3浓度为3 μg/mL 时达到最大(5.23 μg/g)。
3 讨论
亚硒酸钠是最常用的富硒剂[14],多用于对动物[15]和植物[16]的研究,将其用于真菌则多作用于酵母[17]和大型的食用真菌[18],但是亚硒酸钠有毒,使用受到一定的限制。亚硒酸钠对于产菌核(主要是微菌核)真菌的富硒培养研究还未见报道。
本试验结果表明,在MEA 培养基中添加不同浓度的硒,类胡萝卜素、酚类化合物和硒均可以在PT95菌株和Q1 菌株的菌核内积累,且可以使2 株菌株菌核的类胡萝卜素和硒含量得到不同程度的提高,但却不能使总酚的含量提高。此外,当培养基中Na2SeO3的浓度为10 μg/mL 时,有利于2 株菌核提取物还原力的提高;除Na2SeO3的浓度为10 μg/mL时有利于Q1 菌株菌核提取物DPPH 自由基清除能力的提高外,其余条件下生长的2 株菌株菌核提取物的DPPH 自由基清除能力均不能提高。添加不同浓度的硒均不利于2 株菌核提取物亚铁离子螯合能力的提高。因此认为,添加硒可能会改变抗氧化系统中各种抗氧化物质之间的比例,从而使各指标之间出现差异。
