微生物法检测婴幼儿奶粉中游离生物素方法研究
2019-09-22陈靖欣梁梅娟苏佩冰殷欢
陈靖欣 梁梅娟 苏佩冰 殷欢
摘要 为了解决微生物法检测婴幼儿配方奶粉中生物素含量常遇到的问题,重点关注了试验过程中的标准曲线、培养基和接种液制备的操作细节。结果表明,采用该方法检测奶粉中的生物素时,标准曲线相关系数(R2)可达0.999 8,有较大的提高;平行测试的RSD为0.75%~2.14%,加标试验回收率在96.08%~98.25%之间,平均回收率为97.54%。通过本方法,优化了菌种活化、菌悬液制备及标准溶液配制过程,提高了检测效率和准确性。
关键词 游离生物素;微生物法;菌悬液;标准曲线
中图分类号 TS207.3 文献标识码 A
文章编号 1007-5739(2019)15-0224-02
Research on Microbiology Detection Method for Free Biotin in Infant Milk Powder
CHEN Jing-xin LIANG Mei-juan SU Pei-bing YIN Huan
(Food and Drug Inspection Institute of Zhongshan City,Zhongshan Guangdong 528400)
Abstract In order to solve the problems of microbiological detection for biotin content in infant milk powder,these steps were focused,including the details of standard curve,the preparation of medium and inoculant.Results showed that using this method,the correlation coefficient of the standard curve was 0.999 8,RSD of parallel tests was between 0.75% and 2.14%,and the recovery rate of standard addition experiment was between 96.08% and 98.25%,the average recovery was 97.54%.Through this method,the process of strain activation,suspension preparation and standard solution preparation was optimized,and the detection efficiency and accuracy were improved.
Key words free biotin;microbiological method;bacterium suspension;standard curve
生物素是一種维持人体自然生长、发育和正常人体机能健康的必要营养素。目前,测定婴幼儿奶粉中生物素的主要方法有高效液相色谱法[1]、微生物法[2-7]、微孔板试剂盒法[8-10]。其中,微生物法实际操作时总会遇到不少问题,例如测试管培养后吸光值不成梯度或测试菌不生长,测试样浓度不落在标准曲线范围内,接种液的配制操作复杂且不知如何防止微生物交叉污染等,再加上菌种活化周期长、样品处理复杂显著加大了生物素的检验难度。针对此类问题,本文对菌种活化、菌悬液制备及标准溶液配制方面进行了研究,以期为提升测定效果提供参考。
1 材料与方法
1.1 试验材料
试验材料包括生物素标准品(德国Dr.Ehrenstorfer)、菌种ATCC 8014植物乳杆菌、乳酸杆菌肉汤培养基(BD)、乳酸杆菌琼脂培养基(BD)和生物素测定用培养基(BD)。
供试仪器有双光速紫外可见分光光度计(安捷伦Cary 60 UV-Vis)、低温生化培养箱(BINDE KB400)、生物安全柜(美国BAKER)、鼓风干燥箱(BINDE FD115)、高压灭菌锅(Hirayama)。
本试验所用玻璃器皿均为此项目专用,不能与其他项目混用。玻璃仪器使用前,至少用酸浸泡12 h,后用纯水冲洗,晾干后置于250 ℃干燥箱干热2 h以上。培养用的试管建议用透气硅塞,不建议使用螺旋密封盖。
1.2 试验方法
1.2.1 标准溶液的制备。准确称取生物素标准品101.41 mg定容至1 000 mL,配制成浓度为101.41 μg/mL的标准储备液,可存于2~4 ℃条件下12个月。吸取1 mL标准储备液定容至100 mL,配制成浓度为1.014 1 μg/mL的标准中间液,可存于2~4 ℃条件下6个月。吸取标准储备液将其稀释成0.208 2 ng/mL高浓度标准溶液和0.104 1 ng/mL低浓度标准溶液,临用前现配。上述溶液的配制均用50%乙醇溶液作介质,容器选用棕色容量瓶。
1.2.2 菌种活化和种子液的制备。①菌种活化对菌种活性的影响。试验发现,将植物乳杆菌直接转接到乳酸杆菌肉汤培养液中活化,比转接到乳酸杆菌琼脂培养基中活化再转种到乳酸杆菌肉汤中的活力要好。因此,将冻存菌株直接接种到乳酸杆菌肉汤中(36±1)℃培养过夜。再转接一代来增强活力,获得足够浓的乳酸杆菌肉汤培养液即可开始配制接种液。②接种液浓度对结果的影响。接种液浓度太低会造成测试管耗尽生物素的时间变长,而接种液浓度太高又会造成测试管生长量过大。透光率在60%~80%之间时,透光率越低,标准系列管拟合值越好。因此,本文将透光率控制在60%~65%之间。③接种液的制备方法及注意事项。接种液若有杂菌污染,会使所有测试管菌都生长,最终没有梯度。为了避免污染,提高制备接种液的效率,应准备多支已灭菌的1.5 mL小型离心管,每支分装1 mL菌液,在2 000 r/min条件下离心2~3 min,倾出上清液,加1 mL已灭菌NaCl溶液,混匀,再离心2~3 min,重复清洗3~4次,再加入1 mL NaCl混匀。将清洗后的菌液按一定体积添加到10 mL NaCl溶液中,分别为0.1、0.2、0.3 mL……混匀,用分光光度计以氯化钠溶液作空白,于550 nm波长下测定菌悬液的透光率。需要注意的是,每次测菌悬液透光率前都需旋涡混匀,保证菌悬液的均匀性、透光率的准确性。当获得适当透光率时,就按此比例重新配制接种液备用,避免因测定透光率而受到污染或备用接种液不够的问题。接种液需在接种前1 h内制备完成。
1.2.3 样品处理。样品处理参照GB 5009.259—2016中6.2.2,根据样品中生物素的含量确定稀释倍数,确保样品提取液稀释后浓度落在标准曲线范围内。
1.2.4 标准曲线的制备。取试管S1~S10分别加入低浓度标准溶液0(未接种空白)、0(接种空白)、1.0、2.0、3.0、4.0、5.0 mL和高浓度标准溶液3.0、4.0、5.0 mL,补水至5.0 mL,相当于标准系列管中生物素含量为0、0、0.101、0.203、0.304、0.406、0.507、0.608、0.811、1.010 ng。加5.0 mL生物素测定用培养液,每梯度做3个平行样。
1.2.5 待测液的制备。取4支试管,分别加入1.0、2.0、3.0、4.0 mL试样提取液,补水至5.0 mL,加入5.0 mL生物素测定用培养液,混匀,每个梯度做3个平行。先预估样品中维生素含量,可根据样品中维生素含量适当调整样品溶液和水的比例,建議使最低浓度测试管的浓度尽量落在标准曲线S3~S4的浓度之间。
1.2.6 生物素测定用培养基的配制及接种。①生物素测定用培养基的配制。试验发现,生物素测定用培养基配制过程中如果过度加热会造成培养基失效,最终导致所有测试管的测试菌均不生长。因此,生物素测定用培养基在灭菌前加热溶解的时间不能太久,加热时需不断搅拌,加热至粉末刚溶解完即停止加热。然后在121 ℃下灭菌5 min,灭菌完毕必须马上从高压锅中取出,并放进冰水浴中及时冷却,正常的培养基颜色应为浅黄色。如果加热后或灭菌后培养基颜色变深,均不能使用,需重新配制。②接种与培养。用移液枪向上述每个测管加入50 μL接种液,其中未接种空白S1和样品空白除外。将上述所有管一同放入培养箱内,在(36±1)℃温度条件下培养20~24 h,可适当延续培养时间,直至生物素消耗尽为止。培养后,S1、S2、S10和样品空白管均要求不生长,试验方有效。
1.2.7 待测液浓度结果计算。依据每个测试管的吸光值,从标准曲线上找到相应的生物素浓度,再计算每根测试管的生物素含量,取4个试管生物素含量的平均值作为最终结果。
2 结果与分析
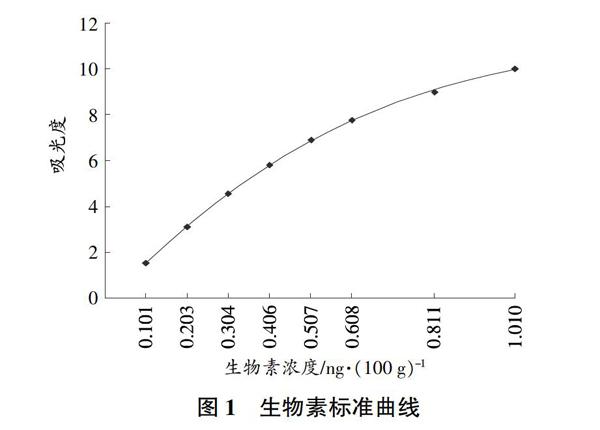
2.1 生物素标准曲线
本法测定生物素的线性范围为0.101~1.010 ng/100 g,其标准曲线(图1)相关系数R2=0.999 8。平行测试的RSD为0.1%~4.5%。
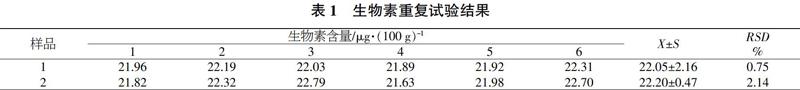
2.2 方法的重复性
选取2种婴幼儿奶粉作试验材料,分别称取了6个平行样进行平行试验,结果见表1。可以看出,6次平行试验的相对标准偏差(RSD)在0.75%~2.14%之间,说明本方法的重复性良好。
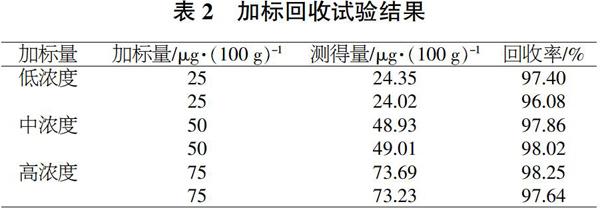
2.3 回收率试验
称取6份已知生物素含量的1号样品作为基质,分别添加低、中、高3个浓度生物素标准品各2组进行加标回收试验,结果见表2。可以看出,该方法回收率在96.08%~98.25%之间,回收效果良好。
3 结论与讨论
从试验验证结果得出,通过优化菌种活化步骤,提高了菌种的活性。该方法重复性和回收效果良好,同时,因重点关注标准溶液配制和培养基配制过程中的注意事项,防止了测试管生长不好、培养基失效、菌悬液配制时交叉污染和标准曲线线性不理想等问题,对微生物法测定生物素效果也有很大的提高。
4 参考文献
[1] 尹烁,杨懿,李永新,等.高效液相色谱法同时测定乳制品中的泛酸和生物素[J].现代预防医学,2018,45(4):708-711.
[2] 食品安全国家标准 婴幼儿食品和乳品中游离生物素的测定:GB 5413.19-2010[S/OL].[2019-02-20].http://www.doc88.com/p-98836745 79016.html.
[3] 食品安全国家标准 食品中生物素的测定:GB 5009.259-2016[S/OL].[2019-02-20].http://www.doc88.com/p-6791343561818.html.
[4] 秦磊磊,陈绪华,刘健,等.微生物法测定婴幼儿奶粉中游离生物素条件优化[J].现代农业科技,2013(15):296-297.
[5] 聂炎炎,刘冬虹,吴环,等.婴幼儿配方奶粉中生物素含量的快速微生物检测方法研究[J].检验检疫学刊,2014,24(6):36-38.
[6] 刘亚兵,王俊平,刘正,等.婴幼儿配方奶粉中生物素的测定与研究[J].农业科技与信息,2018(23):49-51.
[7] 徐琼,王志伟,陈欣钦,等.微生物法测定婴幼儿配方乳粉中的生物素、叶酸和V■[J].乳业科学与技术,2014,37(6):15-17.
[8] 程敏,刘锦光.传统微生物法与试剂盒法测定乳粉中生物素比较[J].食品安全质量检测学报,2019,10(4):988-991.
[9] 王晶,张攀,李玲,等.微孔板式微生物法检测婴幼儿配方乳粉中生物素含量方法研究[J].食品科技,2018,43(11):346-348.
[10] 周敏,许再元,苏水娇,等.微孔板试剂盒法测定婴幼儿配方奶粉中的生物素含量[J].浙江农业科学,2017,58(12):2246-2248.
