KAI1基因在肝癌中的表达及与HBV关系的研究
2019-09-21余国政柯立池张丽君周静胡如进夏林杨璐
余国政 柯立池 张丽君 周静 胡如进 夏林 杨璐
[1.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)普外科;2.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)肿瘤科,湖北 黄石 435000;3.咸宁市中心医院(湖北科技学院附属医院)手术室,湖北 咸宁 437000]
原发性肝细胞癌(hepatocellular carcinoma,HCC)是全球常见恶性肿瘤之一,全球每年的肝癌新发病例数为74.8万,死亡例数为69.6万[1-2],在所有癌症导致的死亡中肝癌居第3位[3-4],且发病率和死亡率在世界范围内不断上升[5-6]。慢性乙型肝炎病毒(HBV)感染是引发肝纤维化和肝细胞癌的首要原因[7]。中国是世界肝癌第一大国,肝癌的发生与HBV 感染关系密切。KAI1基因是新发现的一种肿瘤转移抑制基因,其表达缺失与人类许多上皮细胞恶化、侵袭、转移有关[8-9],而在肝癌组织中的表达水平与HBV的关系尚未见报道,HBV是否通过影响KAI1的表达来调控肝癌发生与进展尚缺乏研究资料。本实验通过检测肝癌组织中KAI1的表达差异,及体外实验检测HBV与KAI1的相关性来初步探讨HBV 感染与KAI1表达在肝癌发生、发展中的关系。
1 材料与方法
1.1材料 收集黄石市中心医院普外科及肿瘤科2015年1月1日至2017年12月31日肝癌患者术后新鲜组织标本癌及对应癌旁组织27对。所有标本均经过病理学确诊为肝癌,临床资料完整,且27例肝癌患者均为HBV阳性感染者。
1.2细胞、质粒与主要试剂 HepG2细胞为本实验室保存,重组质粒pCMV-HBV 1.3倍体、启动子pGL3-KAI1及相应对照pCMV-pblue、pGL3-flag-2b为本实验室构建。其中启动子pGL3-KAI1长度为转录启始位点上游1870bp,经证实为KAI1全长启动子。DMEM培养基及胎牛血清购自Gibco公司,相关试剂盒购自Qiagen公司,Lipo2000、定荧光素酶活性所需的试剂及抗体和酶均购自Sigam公司,引物由擎科合成。
1.3方法
1.3.1癌及癌旁组织中KAI1的mRNA和蛋白水平检测 将27对组织分别匀桨,分成两部分,一部分用RIPA裂解液提取总蛋白,Bradford法检测其浓度,取100 μg总蛋白进行电泳,10% SDS-PAGE中电泳完毕后将凝胶中的蛋白转移至硝酸纤维素膜上,5%的牛奶室温封闭1 h,加入一抗(兔抗人多克隆抗体,1∶ 2 000),4 ℃过夜;洗膜,再加入二抗(羊抗兔IgG-HRP,1∶5000)孵育1 h,洗膜后进行ECL显色。利用相关图像分析软件扫描分析条带的灰度值。另一部分用Trizol法提取总RNA并逆转录成cDNA,然后进行real-time PCR。引物:Kai1上游引物5c-AGGATGCCTGGGACTACGTG-3c,下游引物5c-GCTCAGCGTTGTCTGTCCAGT-3c;GAPDH上游引物5c-TCGTGCGTGACATTAGGAG-3c,下游引物5c-GTCAGGCAGCTCGTAGCTCT-3c。扩增条件:94 ℃变性30 s,55 ℃ 退火30 s,72 ℃ 延伸1 min,40 个循环。实验重复三次。
1.3.2荧光素酶报告基因实验 培养细胞,将对数生长期的HepG2细胞消化计数,均匀铺到24孔板中,37 ℃,5% CO2孵箱培养,使转染时细胞密度达到70%左右,根据Lipo2000说明书要求共同瞬时转染pCMV-HBV 1.3倍体+启动子pGL3-KAI1及对照pCMV-pblue+pGL3-flag-2b,各设三个复孔。送入培养箱中培养48 h后收样,裂解。测定luciferase活性。实验重复三次。
1.3.3测定KAI1启动子甲基化实验 将对数生长期的HepG2细胞消化计数,均匀铺到6孔板中,37 ℃,5% CO2孵箱培养,使转染时细胞达到70%左右,根据Lipo2000说明书要求瞬时转染pCMV-HBV 1.3及对照pCMV-pblue,送入培养箱中培养48 h后收样,提取基因组。送博淼生物科技(北京)有限公司检测KAI1启动甲基化情况。另将KAI1启动子报告质粒与HBV 1.3倍体共转,6 h后,分别在培养基中加入终浓度为1 μM 、2 μM、4 μM的甲基化抑制剂5-aza_CdR。37 ℃,5% CO2孵箱培养48 h,分别用荧光素酶活性检测、real-time PCR 和Western blot检测。实验重复三次。
1.3.4体外实验检测HBV与KAI1的关系 将对数生长期的HepG2细胞消化计数,均匀铺到6孔板中,37 ℃,5% CO2孵箱培养,使转染时细胞达到70%左右,根据Lipo2000说明书要求瞬时转染pCMV-HBV 1.3倍体及对照pCMV-pblue,送入培养箱中培养48 h后收样。分成两部分,一部分用于检测蛋白水平,另一部分用于检测mRNA水平,方法及试剂同1.3.1。实验重复三次。
1.4统计学方法 运用统计软件SPSS17.0对数据进行统计学分析。采用卡方检验,检验水准按α=0.05,Ρ<0.05为差异具有统计学意义。
2 结 果
27对癌及癌旁组织除三对未检测出KAI1表达外,其余24对中癌组织的mRNA水平和蛋白水平均明显低于癌旁组织的表达(P<0.05)。见图1。

图1 KAI1在肝癌和癌旁组织中的表达
荧光素酶报告基因实验中测得luciferase活性值,pCMV-HBV 1.3倍体明显低于对照组(P<0.01)。见图2。

图2 HBV对KAI1启动子的影响
将HepG2+HBV及对照HepG2+Pblue的基因组送检测发现HepG2+HBV基因组的KAI1启动子区发生了甲基化,且加入甲基化抑制剂5-aza_CdR后,KAI1启动子的mRNA和蛋白质水平随着甲基化抑制剂浓度的增加而升高。见图3。

图3 实验组HepG2+HBV和对照组HepG2+Pblue中KAI1启动子的整体甲基化水平
体外实验结果显示,转染了HBV的实验组中的KAI1的mRNA表达及蛋白表达明显低于对照组(P<0.05)。提示HBV可以影响KAI1的表达水平,可能是通过HBV对KAI1启动子甲基化实现的。见图4。
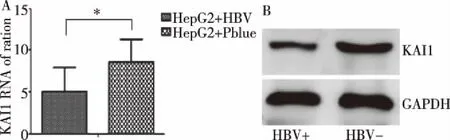
图4 体外实验KAI1的mRNA表达
3 讨 论
KAI1 基因是1995 年Dong 等[10]发现的一种新的肿瘤转移抑制基因,首先发现于前列腺癌细胞中,后经研究证实,在多种肿瘤中均伴有KAI1的表达下降或缺失。目前认为KAI1对绝大多数肿瘤的转移起抑制作用,与肿瘤的侵袭力、预后明显相关[11-13]。KAI1表达下调或缺失可能是导致肝癌的重要因素之一,但其具体机制尚待研究。
DNA 甲基化是真核生物遗传物质化学修饰的一种方式,甲基化是由DNA 甲基化转移酶(DNMT)催化完成的,在正常细胞中某些基因的重复序列处于高甲基化水平,这样可以防止被转录因子的重新活化从而维持基因组的稳定[14-16]。如果体细胞的正常甲基化发生改变(基因组整体低甲基化),将导致细胞生长失控;特异位点甲基化程度改变(抑癌基因启动子区CpG 岛的过甲基化)则可导致肿瘤的发生。本课题中KAI1 及HBV的影响明显发生了甲基化,这种变化是肿瘤细胞的一种表观遗传特征,几乎涉及所有类型的肿瘤[17-19]。恶性肿瘤中有很多关键基因启动子区(如参与DNA 修复、调节细胞周期、耐药性形成及肿瘤浸润、转移和血管生成的基因)存在高甲基化状态,这可能是肿瘤的特征之一。研究发现,在肝癌的发生发展过程中,某些病毒可引起抑癌基因启动子区的高甲基化干扰抑癌基因的表达及转录,导致细胞异常增殖,引起细胞的癌变[20]。由于DNA甲基化与人类发育和肿瘤疾病的密切关系,特别是CpG岛甲基化所致抑癌基因转录失活问题,DNA甲基化已经成为表观遗传学和表观基因组学的重要研究内容。
肝癌是常见的原发肿瘤,具有易复发、转移,死亡率高,预后差等特点[21].,且研究发现80%的肝癌与HBV感染有关[22-23]。所以了解和发现肝癌早期诊断的特异性生物学标志物以及寻找肝癌治疗的新靶点具有重要意义。本实验通过检测KAI1在肝癌原发灶中的表达,分析其临床特征,推测KAI1的异常表达可能参与了肝癌的发生、发展, 而HBV可能通过甲基化KAI1启动子区抑制KAI1基因的表达进一步促进了肝癌发生发展。
