丹红注射液与布地奈德联合无创正压通气治疗慢性阻塞性肺疾病急性加重并肺源性心脏病患者的临床疗效及其对血清炎性因子水平和心肺功能的影响
2019-09-21王家珍梁艳均李多
王家珍,梁艳均,李多
慢性阻塞性肺疾病(COPD)是一种以持续性气流受限为特征的可预防及治疗的呼吸系统疾病,20~40岁人群患病率约为8.6%,>40岁人群患病率约为13.7%[1],可严重威胁我国居民的身体健康。慢性炎症在COPD发生发展中占核心地位[2],如中性粒细胞、巨噬细胞、淋巴细胞等多种炎性细胞参与炎症的发生[3],缺氧、血管重构等病理生理过程可引发微循环障碍、肺动脉高压及肺源性心脏病[4],因此降低肺动脉压、控制炎症在COPD治疗中十分关键。吸入用布地奈德是一种非卤代化糖皮质激素,可有效减轻气道炎症[5]。丹红注射液可通过扩张动静脉及毛细血管而改善微循环及心肌缺血缺氧症状,降低心肌耗氧量,此外其还具有一定的抗炎作用[6-7]。无创正压通气操作便捷、患者依从性好,可有效减少气管插管及呼吸机相关并发症,因此常用于治疗COPD。国内研究多为单一选用丹红注射液、无创正压通气、布地奈德或两两联合治疗慢性阻塞性肺疾病急性加重(AECOPD)并肺源性心脏病,但关于三者联合治疗的研究报道较少。本研究旨在观察丹红注射液与布地奈德联合无创正压通气治疗AECOPD并肺源性心脏病患者的临床疗效,并探讨其对血清炎性因子水平及心肺功能的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年5月—2019年5月四川省绵阳市三台县人民医院收治的AECOPD并肺源性心脏病患者120例,随机分为对照组和观察组,每组60例。对照组患者中男36例,女24例;年龄46~87岁,平均年龄(52.1±7.5)岁;平均病程(3.6±2.5)年。观察组患者中男39例,女21例;年龄45~89岁,平均年龄(52.3±7.6)岁;平均病程(3.7±2.6)年。两组患者性别(χ2=2.13)、年龄(t=1.34)、病程(t=1.42)比较,差异无统计学意义(P>0.05),具有可比性。本研究经四川省绵阳市三台县人民医院医学伦理委员会审核批准,所有患者对本研究知情并签署知情同意书。
1.2 诊断与排除标准 诊断标准:符合《2018年 GOLD慢性阻塞性肺疾病诊断、治疗及预防全球策略》中的AECOPD诊断标准[8],且符合《慢性肺源性心脏病基层诊疗指南(实践版•2018)》[9]中的肺源性心脏病诊断标准。排除标准:(1)合并真菌感染、肺结核、肺癌等其他肺部原发性疾病者;(2)伴凝血功能障碍者;(3)存在过敏史或对本研究所用药物过敏者;(4)妊娠期及哺乳期妇女;(5)近期接受抗凝或溶栓治疗者;(6)无法配合无创正压通气或存在机械通气禁忌证者;(7)无法遵医嘱者。
1.3 治疗方法 两组患者入院后均给予常规药物治疗,包括抗感染、去痰、扩张支气管等,并选用V60无创呼吸机(美国伟康公司生产)进行无创正压通气,吸入氧浓度(FiO2)为30%~40%,呼吸频率为12~20次/min,呼气压力为4~8 cm H2O(1 cm H2O=0.098 kPa),吸气压为12~20 cm H2O,可根据患者耐受程度、动脉血气分析结果等合理调节辅助压力。在上述治疗基础上,对照组患者予以吸入用布地奈德混悬液(阿斯利康制药有限公司生产,国药准字H20140475)2 mg+0.9%氯化钠溶液2 ml,超声雾化,1次/8 h。观察组患者在对照组基础上予以丹红注射液(菏泽步长制药有限公司生产,国药准字Z20026866)20 ml+0.9%氯化钠溶液100 ml,静脉滴注,1次/d。两组患者疗程均为14 d。
1.4 观察指标
1.4.1 临床疗效 比较两组患者临床疗效。临床疗效判定标准[10]:以治疗后患者双下肢水肿、呼吸困难症状明显缓解,动脉血气分析指标恢复正常为显效;治疗后患者双下肢水肿、呼吸困难症状有所缓解,动脉血气分析指标改善为有效;治疗后患者双下肢水肿、呼吸困难症状加重,动脉血气分析指标无改善为无效。
1.4.2 血清炎性因子水平 两组患者治疗前后抽取空腹肘静脉血5 ml,3 000 r/min离心10 min(离心半径5 cm),留取血清,置于-20 ℃环境保存。采用酶联免疫吸附试验(ELISA)检测血清S100A12、降钙素原(PCT)、超敏C反应蛋白(hs-CRP)水平,其中S100A12试剂盒购自美国Abnove公司。采用双抗体夹心法ABC-ELISA检测血清白介素1β(IL-1β)、白介素8(IL-8)、肿瘤坏死因子α(TNF-α)水平,试剂盒由北京中杉金桥生物科技有限公司生产。具体操作严格按照试剂盒说明书进行。
1.4.3 动脉血气分析指标及肺功能指标 两组患者治疗前后采集桡动脉血2 ml,应用普朗医疗PL2000血气电解质分析仪进行血气分析,包括动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2)、pH值、动脉血氧饱和度(SaO2);应用常规肺功能仪(德国耶格公司生产)测定两组患者治疗前后肺功能指标,包括第1秒用力呼气容积占预计值百分比(FEV1%pred)及第1秒用力呼气容积占用力肺活量比值(FEV1/FVC),重复测量3次以上取最佳值。
1.4.4 心功能指标 使用彩色多普勒超声心动图检测两组患者治疗前后心功能指标,包括左心室射血分数(LVEF)、心排血量(CO)、肺动脉收缩压(PASP)、右心室流出道(ROVT)内径,所有指标检测严格按照2016年中华医学会超声医学分会超声心动图学组制定的《中国成年人超声心动图检查测量指南》进行操作。
1.4.5 不良反应 观察两组患者治疗期间不良反应发生情况。
1.5 统计学方法 应用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料(包括年龄、病程、S100A12、PCT、hs-CRP、IL-1β、IL-8、TNF-α、PaCO2、PaO2、pH值、SaO2、FEV1%pred、FEV1/FVC、LVEF、CO、PASP、ROVT内径)以(±s)表示,组间比较采用两独立样本t检验;计数资料(包括性别和不良反应发生率)分析采用χ2检验;等级资料(临床疗效)分析采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 观察组患者临床疗效优于对照组,差异有统计学意义(u=3.25,P<0.05,见表1)。

表1 两组患者临床疗效比较(例)Table 1 Comparison of clinical effect between the two groups
2.2 炎性因子 两组患者治疗前血清S100A12、PCT、hs-CRP、IL-1β、IL-8、TNF-α水平比较,差异无统计学意义(P>0.05);与对照组相比,观察组患者治疗后血清S100A12、PCT、hs-CRP、IL-1β、IL-8、TNF-α水平降低,差异有统计学意义(P<0.05,见表2)。
表2 两组患者治疗前后血清炎性因子水平比较(±s)Table 2 Comparison of serum levels of inflammatory factors between the two groups before and after treatment

表2 两组患者治疗前后血清炎性因子水平比较(±s)Table 2 Comparison of serum levels of inflammatory factors between the two groups before and after treatment
注:PCT=降钙素原,hs-CRP=超敏C反应蛋白,IL-1β=白介素1β,IL-8=白介素8,TNF-α=肿瘤坏死因子α
S100A12(μg/L) PCT(μg/L) hs-CRP(g/L) IL-1β(μg/L) IL-8(μg/L) TNF-α(ng/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 42.6±12.7 27.8±9.8 5.8±2.3 0.13±0.06 58.3±15.6 7.2±2.6 0.34±0.12 0.30±0.15 0.41±0.23 0.32±0.19 46.4±3.3 32.5±2.8观察组 60 39.9±10.5 23.2±11.4 6.3±2.8 0.05±0.01 60.1±18.3 5.6±3.1 0.32±0.14 0.25±0.11 0.46±0.20 0.24±0.22 45.4±1.9 26.9±2.4 t值 1.27 2.37 -1.07 10.19 -0.58 3.06 0.84 2.08 -1.27 2.13 1.02 11.76 P值 0.21 0.02 0.29 <0.01 0.56 <0.05 0.40 0.04 0.21 0.04 0.31 <0.01组别 例数
2.3 动脉血气分析指标及肺功能指标 两组患者治疗前PaCO2、PaO2、pH值、SaO2及FEV1%pred、FEV1/FVC比较,差异无统计学意义(P>0.05);与对照组相比,观察组患者治疗后PaCO2降低,PaO2、pH值、SaO2及FEV1%pred、FEV1/FVC升高,差异有统计学意义(P<0.05,见表3)。
2.4 心功能指标 两组患者治疗前LVEF、CO、PASP、ROVT内径比较,差异无统计学意义(P>0.05);与对照组相比,观察组患者治疗后LVEF、CO升高,PASP降低,ROVT内径缩小,差异有统计学意义(P<0.05,见表4)。
2.5 不良反应 两组患者治疗期间各出现皮下出血1例,不良反应发生率均为1.6%,差异无统计学意义(χ2=0.000,P=1.000)。
3 讨论
目前,COPD的发病机制尚不完全明确[11],考虑是遗传因素与环境因素共同作用的结果。相关研究表明,气道及全身炎性反应在COPD发生发展中占核心地位[12]。在COPD发生发展过程中,肺组织中增多的巨噬细胞、单核细胞、CD4+T淋巴细胞等炎性细胞释放多种炎性因子(包括IL-8、TNF-α、IL-1β等),导致中性粒细胞反应性升高,坏死的中性粒细胞可持续释放物质损伤肺组织,而受损的肺组织不能完全修复,进而导致COPD发生[13]。COPD患者的肺组织因长期受到炎性因子刺激、破坏,导致气道、肺实质、肺血管反复修复,进而发生气道重构、瘢痕形成,继而出现气道狭窄、固定性气道阻塞,因此患者表现为长期反复咳嗽、咳痰、呼吸困难及低氧血症、高碳酸血症。长期慢性缺氧可导致肺血管广泛收缩,致使肺动脉压升高,伴血管内膜增生,导致肺血管重构。肺动脉高压是AECOPD患者常见并发症,可并发慢性肺源性心脏病及右心衰竭,AECOPD并慢性肺源性心脏病患者主要表现为呼吸困难加重、乏力、双下肢水肿等。
表3 两组患者治疗前后动脉血气分析指标及肺功能指标比较(±s)Table 3 Comparison of arterial blood-gas analysis results and index of pulmonary function between the two groups before and after treatment
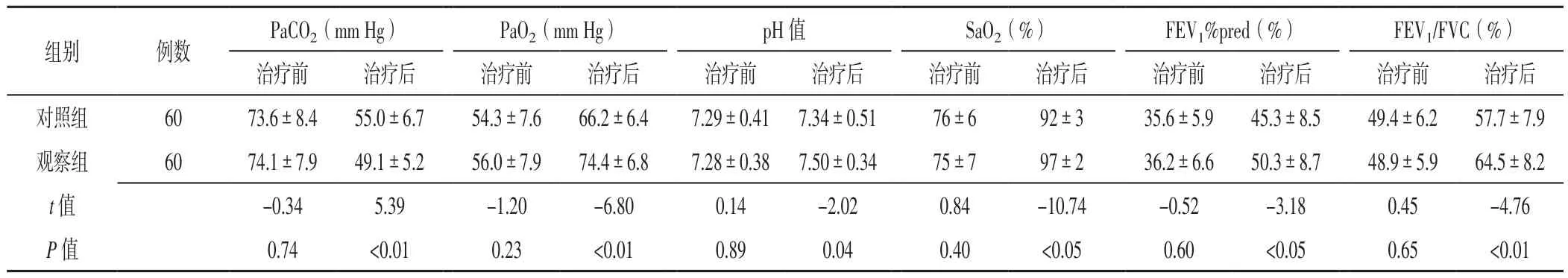
表3 两组患者治疗前后动脉血气分析指标及肺功能指标比较(±s)Table 3 Comparison of arterial blood-gas analysis results and index of pulmonary function between the two groups before and after treatment
注:1 mm Hg=0.133 kPa;PaCO2=动脉血二氧化碳分压,PaO2=动脉血氧分压,SaO2=动脉血氧饱和度,FEV1%pred=第1秒用力呼气容积占预计值百分比,FEV1/FVC=第1秒用力呼气容积与用力肺活量比值
PaCO2(mm Hg) PaO2(mm Hg) pH值 SaO2(%) FEV1%pred(%) FEV1/FVC(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 73.6±8.4 55.0±6.7 54.3±7.6 66.2±6.4 7.29±0.41 7.34±0.51 76±6 92±3 35.6±5.9 45.3±8.5 49.4±6.2 57.7±7.9观察组 60 74.1±7.9 49.1±5.2 56.0±7.9 74.4±6.8 7.28±0.38 7.50±0.34 75±7 97±2 36.2±6.6 50.3±8.7 48.9±5.9 64.5±8.2 t值 -0.34 5.39 -1.20 -6.80 0.14 -2.02 0.84 -10.74 -0.52 -3.18 0.45 -4.76 P 值 0.74 <0.01 0.23 <0.01 0.89 0.04 0.40 <0.05 0.60 <0.05 0.65 <0.01组别 例数
表4 两组患者治疗前后心功能指标比较(±s)Table 4 Comparison of index of cardiac function between the two groups before and after treatment

表4 两组患者治疗前后心功能指标比较(±s)Table 4 Comparison of index of cardiac function between the two groups before and after treatment
注:LVEF=左心室射血分数,CO=心排血量,PASP=肺动脉收缩压,ROVT=右心室流出道
组别 例数 LVEF(%) CO(L/min) PASP(mm Hg) ROVT内径(mm)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 39.2±3.3 43.5±4.2 4.2±0.7 4.7±0.8 53±5 43±4 28.3±2.4 26.2±1.9观察组 60 38.9±4.1 48.6±3.6 4.3±0.8 5.2±0.6 52±4 38±3 28.6±2.1 25.1±2.0 t值 0.44 -7.14 -0.73 -3.87 1.21 7.75 -0.73 3.09 P 值 0.66 <0.01 0.47 <0.01 0.23 <0.01 0.47 <0.01
丹红注射液的有效成分包括丹参酮、丹参酚、红花黄色素等,丹参具有增强巨噬细胞清除内毒素的作用,减轻炎性反应,抑制肺血管重构并减轻氧化应激导致的内皮细胞损伤,进而降低肺动脉压[14]。无创正压通气可有效改善患者肺通气功能[15]。布地奈德能增加溶酶体膜、平滑肌细胞及内皮细胞的稳定性,有效减少过敏性递质释放,减轻炎性反应[16]。
S100A12作为炎性反应性蛋白,是S100蛋白家族中的成员之一,可激活炎性细胞的趋化作用[17],与心血管疾病的非特异炎性反应有关[18]。WITTKOWSKI等[19]研究结果显示,AECOPD组患者血清S100A12水平明显高于健康对照组。余宏鑫等[20]研究表明,S100A12水平与AECOPD病情严重程度呈正相关。TZOUVELEKIS等[21]研究表明,S100A12水平与肺动脉高压患者一氧化碳(CO)呈正相关,且可用于预测患者预后。hs-CRP及PCT能较好地反映炎性疾病的严重程度,因此在临床诊疗中应用广泛。
本研究联合丹红注射液、布地奈德及无创正压通气治疗AECOPD伴肺源性心脏病患者,结果显示,观察组患者临床疗效优于对照组;治疗前两组患者血清炎性因子水平及动脉血气分析、肺功能、心功能指标间无统计学差异,观察组患者治疗后血清S100A12、PCT、hs-CRP、IL-1β、IL-8、TNF-α 水平及PaCO2、PASP低于对照组,PaO2、pH值、SaO2及FEV1%pred、FEV1/FVC、LVEF、CO高于对照组,ROVT内径小于对照组,表明丹红注射液、布地奈德联合无创正压通气治疗AECOPD并肺源性心脏病患者的疗效确切,可有效减轻炎性反应及心肺功能损伤,改善患者动脉血气分析指标。分析三联治疗的优势包括:(1)有效改善肺通气功能,减轻呼吸衰竭;(2)可明显降低肺动脉压,增强肺通气及换气功能。另外,两组患者治疗期间不良反应发生率间无统计学差异,提示丹红注射液、布地奈德联合无创正压通气治疗并未增加AECOPD并肺源性心脏病患者的不良反应,安全性较高。
综上所述,丹红注射液与布地奈德联合无创正压通气治疗AECOPD并肺源性心脏病患者的临床疗效确切,可有效降低血清炎性因子水平,改善患者心肺功能,且安全性较高,具有一定临床推广应用价值;但本研究为单中心研究且样本量较小,结果结论仍有待开展多中心、大样本量研究进一步证实。
作者贡献:王家珍、梁艳均负责研究的实施、数据收集、整理、分析、撰写并修订论文;李多负责研究的构思与设计、监督管理及结果分析与解释。
本文无利益冲突。
