血清细胞角蛋白19片段、人附睾蛋白4、组织多肽特异性抗原水平及中性粒细胞与淋巴细胞比值与非小细胞肺癌患者的关系研究
2019-09-21杜旭升李东繁王冠杰范亚莉李娜苗柴丽丽王波李广顺李建英
杜旭升,李东繁,王冠杰,范亚莉,3,李娜苗,3,柴丽丽,王波,李广顺,李建英
目前,我国肺癌发病率及病死率均位居所有恶性肿瘤首位,在我国每年新增的65.3万例肺癌患者中非小细胞肺癌(non-small cell lung cancer,NSCLC)占85%,且该类患者预后最差。肺癌的基本治疗原则为根据TNM分期选择相应治疗方案,但由于NSCLC异质性较大,故其治疗效果存在明显个体差异。目前临床上仅依据TNM分期制定NSCLC治疗方案已很难满足临床治疗需求,因此迫切需要寻找更多的与NSCLC密切相关的肿瘤标志物作为治疗靶点[1]。细胞角蛋白19片段(cytokeratin 19 fragment,Cyfra21-1)在多种类型肿瘤上皮细胞中呈高表达,并随着肿瘤细胞凋亡或自噬而逐渐释放到血液循环[2]。人附睾蛋白4(human epididymis protein 4,HE4)在机体正常组织中表达较弱,但在卵巢癌及肺鳞癌等肿瘤中呈高表达[3]。组织多肽特异性抗原(tissue polypeptide specific antigen,TPS)与肿瘤细胞的增殖和分裂密切相关,在肿瘤细胞DNA合成过程中发挥着重要作用,且既往研究发现乳腺癌和肺腺癌患者均能检测到TPS呈高表达[4]。中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte,NLR)可反映机体炎症程度,而肿瘤患者局部炎症明显增强[5]。本研究旨在分析血清Cyfra21-1、HE4、TPS水平及NLR与NSCLC患者的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年2月—2017年12月西安交通大学医学院附属西安市中心医院收治的NSCLC患者92例作为试验组,均经病理学检查证实为NSCLC,其中男50例,女42例;平均年龄(58.0±8.6)岁。另选取同期体检健康者100例作为对照组,其中男55例,女45例;平均年龄(58.4±8.4)岁。两组受试者性别(χ2=0.143,P=0.689)、年龄(t=0.096,P=0.834)比较,差异无统计学意义,具有可比性。本研究经西安交通大学医学院附属西安市中心医院医学伦理委员会审核批准,所有患者对本研究知情并签署知情同意书。
1.2 排除标准 (1)伴有肝、肾功能异常者;(2)随访资料不完整者;(3)行新的辅助治疗和化疗者。
1.3 观察指标 比较两组受试者及不同TNM分期NSCLC患者血清Cyfra21-1、HE4、TPS水平及NLR。采集两组受试者静脉血4 ml并置于抗凝管中,其中2 ml于室温静置30 min后3 000×g离心20 min,收集上清液并置于-80 ℃环境下保存待测。采用酶联免疫吸附试验(ELISA)检测血清Cyfra21-1、HE4、TPS水平,实验操作流程严格按照试剂盒说明书进行。其中血清Cyfra21-1>5 μg/L、HE4>70 pmol/L、TPS>80 U/L 判 定为阳性。剩余2 ml血液采用全血细胞计数分析仪计数中性粒细胞和淋巴细胞数量,并计算NLR,NLR=中性粒细胞计数/淋巴细胞计数,以NLR>2判定为阳性。
1.4 随访 患者出院后采用电话及定期复查等方式进行随访,随访截至2019-04-30。所有患者随访16~60个月,中位随访时间为37个月。随访终点为患者死亡或随访截止日期。
1.5 统计学方法 采用SPSS 20.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用q检验,两组间比较采用两独立样本t检验;计数资料分析采用χ2检验;绘制ROC曲线以评价血清Cyfra21-1、HE4、TPS水平及NLR对NSCLC的诊断价值,计算曲线下面积(AUC),以AUC<0.70为诊断价值较低,0.70~0.90为诊断价值中等,>0.90为诊断价值较高;绘制Kaplan-Meier生存曲线以评价不同血清Cyfra21-1、HE4、TPS水平及NLR的NSCLC患者生存状况,1、3、5年生存率比较采用log-rankχ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者血清Cyfra21-1、HE4、TPS水平及NLR比较 试验组患者血清Cyfra21-1、HE4、TPS水平及NLR高于对照组,差异有统计学意义(P<0.05,见表1)。
表1 两组受试者血清Cyfra21-1、HE4、TPS水平及NLR比较(±s)Table 1 Comparison of serum levels of Cyfra21-1,HE4 and TPS,and NLR between the two groups

表1 两组受试者血清Cyfra21-1、HE4、TPS水平及NLR比较(±s)Table 1 Comparison of serum levels of Cyfra21-1,HE4 and TPS,and NLR between the two groups
注:Cyfra21-1=细胞角蛋白19片段,HE4=人附睾蛋白4,TPS=组织多肽特异性抗原,NLR=中性粒细胞与淋巴细胞比值
(μg/L)HE4(pmol/L)TPS(U/L)NLR对照组 100 2.31±0.54 58.59±8.91 39.59±4.17 1.09±0.21试验组 92 18.94±3.27 287.64±41.85 196.94±56.38 5.84±0.89 t值 10.857 9.587 10.745 8.476 P值 0.001 0.002 0.001 0.004组别 例数 Cyfra21-1
2.2 不同TNM分期NSCLC患者血清Cyfra21-1、HE4、TPS水平及NLR比较 不同TNM分期NSCLC患者血清Cyfra21-1、HE4、TPS水平及NLR比较,差异有统计学意义(P<0.05);TNM分期Ⅲ、Ⅳ期患者血清Cyfra21-1、HE4、TPS水平及NLR高于Ⅰ~Ⅱ期患者,TNM分期Ⅳ期患者血清Cyfra21-1、HE4、TPS水平及NLR高于Ⅲ期患者,差异有统计学意义(P<0.05,见表2)。
2.3 ROC曲线 ROC曲线显示,血清Cyfra21-1、HE4、TPS水平及NLR诊断NSCLC的AUC分别为0.609〔95%CI(0.708,0.983)〕、0.673〔95%CI(0.549,0.796)〕、0.760〔95%CI(0.649,0.870)〕、0.809〔95%CI(0.795,0.952)〕,四者联合诊断NSCLC的AUC为0.876〔95%CI(0.801,0.951)〕,见表3、图1。
表2 不同TNM分期NSCLC患者血清Cyfra21-1、HE4、TPS水平及NLR比较(±s)Table 2 Comparison of serum levels of Cyfra21-1,HE4 and TPS,and NLR in NSCLC patients with different TNM stages

表2 不同TNM分期NSCLC患者血清Cyfra21-1、HE4、TPS水平及NLR比较(±s)Table 2 Comparison of serum levels of Cyfra21-1,HE4 and TPS,and NLR in NSCLC patients with different TNM stages
注:与TNM分期Ⅰ~Ⅱ期比较,aP<0.05;与TNM分期Ⅲ期比较,bP<0.05
TNM分期 例数 Cyfra21-1(μg/L) HE4(pmol/L) TPS(U/L) NLRⅠ~Ⅱ期 35 6.49±1.07 143.12±23.56 78.94±19.74 1.03±0.26Ⅲ期 41 16.33±4.13a 276.83±53.78a 188.63±32.71a 4.37±0.75aⅣ期 16 26.71±5.04ab 357.19±58.29ab 264.85±51.29ab 6.59±1.07ab F值 10.138 18.217 20.912 8.375 P值 0.001 <0.01 <0.01 0.003

表3 血清Cyfra21-1、HE4、TPS水平,NLR及四者联合对NSCLC的诊断价值Table 3 Diagnostic value of serum levels of Cyfra21-1,HE4 and TPS,NLR and combination of the above four on NSCLC
2.4 Kaplan-Meier生存曲线 Kaplan-Meier生存曲线显示,Cyfra21-1、HE4、TPS、NLR阳性NSCLC患者1、3、5年生存率分别低于Cyfra21-1、HE4、TPS、NLR阴性患者,差异有统计学意义(P<0.05,见表4、图2)。
3 讨论
目前,NSCLC的具体发病机制尚未完全明确,其发生发展是一个多基因参与且复杂的病变过程[6]。肺癌常起病隐匿,大多数患者确诊时已处于晚期,预后较差。因此,提高肺癌患者早期检出率对改善患者预后具有重要意义。血清学指标诊断肺癌具有诊断时间短及对患者创伤小等优势,但其诊断准确率及灵敏度较低,在临床应用受限[7-8]。
既往研究表明,正常机体组织中Cyfra21-1、HE4和TPS均呈低表达,但三者在肿瘤细胞中呈高表达[9],且随着病情发展肿瘤细胞凋亡和自噬增多,进入血液循环的细胞组分亦增多,因此血清Cyfra21-1、HE4、TPS水平升高[10-11]。本研究结果显示,试验组患者血清Cyfra21-1、HE4、TPS水平及NLR高于对照组;TNM分期Ⅲ、Ⅳ期患者血清Cyfra21-1、HE4、TPS水平及NLR高于Ⅰ~Ⅱ期患者,TNM分期Ⅳ期患者血清Cyfra21-1、HE4、TPS水平及NLR高于Ⅲ期患者,提示血清Cyfra21-1、HE4、TPS水平及NLR随NSCLC患者TNM分期增加而升高,究其原因主要如下:TNM分期越高则NSCLC恶化程度越高,肿瘤细胞更易发生转移,且因肿瘤细胞常在血液循环系统完成转移过程,因此TNM分期越高则患者血液循环中肿瘤细胞越多,进而使血液中Cyfra21-1、HE4、TPS水平升高[12];肿瘤病灶区炎性反应异常增强,而NLR与炎性反应密切相关,炎性反应又与肿瘤转移密切相关,因此TNM分期越高则患者NLR越高[13-14]。MIZUGUCHI等[15]研究结果显示,肺腺癌患者肿瘤组织中Cyfra21-1、HE4和TPS均呈高表达,本研究结果与之相一致。但ZHONG等[16]研究结果显示,乳腺癌和卵巢癌患者肿瘤组织中Cyfra21-1和HE4呈低表达,提示Cyfra21-1和HE4可能存在肿瘤异质性。

表4 不同血清Cyfra21-1、HE4、TPS水平及NLR的NSCLC患者1、3、5年生存率比较(%)Table 4 Comparison of 1-,3-,5-year survival rates in NSCLC patients with different serum levels of Cyfra21-1,HE4 and TPS,and NLR

图 1 血 清 Cyfra21-1、HE4、TPS水 平,NLR及四者联合诊断NSCLC的ROC曲线Figure 1 ROC curve for serum levels of Cyfra21-1,HE4 and TPS,NLR and combination of the above four in diagnosing NSCLC
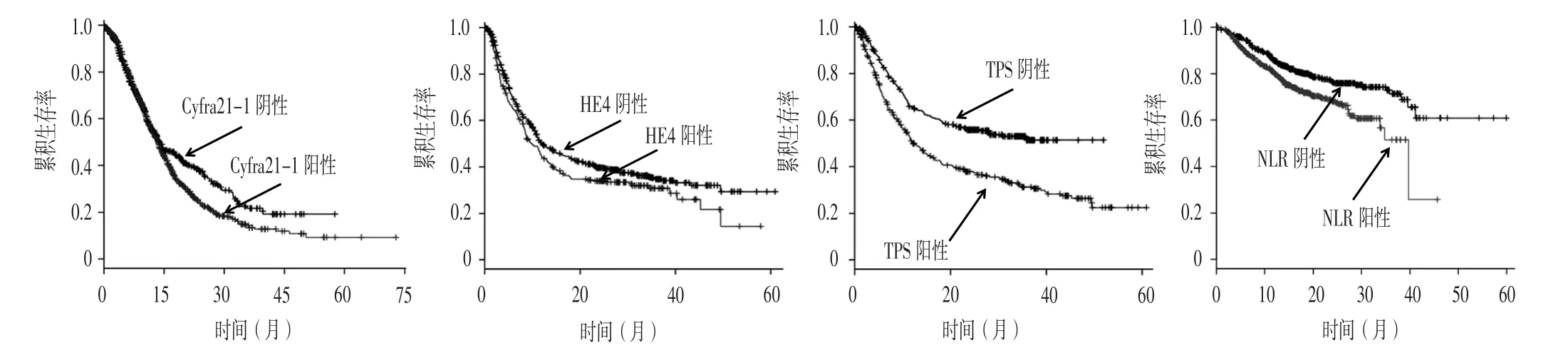
图2 不同血清Cyfra21-1、HE4、TPS水平及NLR的NSCLC患者的Kaplan-Meier生存曲线Figure 2 Kaplan-Meier survival curve for NSCLC patients with different serum levels of Cyfra21-1,HE4 and TPS,and NLR
NSCLC是一种多基因参与的疾病,且其发生发展过程中涉及一系列蛋白分子或基因变化,因此单个蛋白并不能完全解释NSCLC发病过程[17]。本研究结果显示,血清Cyfra21-1、HE4、TPS水平及NLR诊断NSCLC的AUC分别为0.609、0.673、0.760、0.809,四者联合诊断NSCLC的AUC为0.876,提示血清TPS水平、NLR及四者联合对NSCLC具有一定诊断价值。本研究结果还显示,Cyfra21-1、HE4、TPS、NLR阳性NSCLC患者1、3、5年生存率分别低于Cyfra21-1、HE4、TPS、NLR阴性患者,分析其原因可能如下:丝裂原活化蛋白激酶(MAPK)信号通路是与NSCLC发病密切相关的信号转导通路之一,而Cyfra21-1、HE4、TPS、NLR能激活细胞内MAPK信号通路,进而促使NSCLC发展[18-20]。因此,血清HE4水平>70 pmol/L、血清Cyfra21-1水平>5 μg/L、血清TPS水平>80 U/L及NLR>2的NSCLC患者应引起临床重视,并制定有效干预措施以尽可能改善患者预后。
综上所述,血清Cyfra21-1、HE4、TPS水平及NLR随NSCLC患者TNM分期增加而升高,血清TPS水平、NLR及四者联合对NSCLC具有一定诊断价值,且血清Cyfra21-1水平>5 μg/L、血清HE4水平>70 pmol/L、血清TPS水平>80 U/L及NLR>2的NSCLC患者预后较差,临床医生应对血清Cyfra21-1、HE4、TPS水平及NLR升高的NSCLC患者加以重视及干预,但目前血清Cyfra21-1、HE4、TPS水平及NLR与NSCLC关系的具体机制尚不明确,仍需进一步深入研究。
作者贡献:杜旭升进行文章的构思与设计,负责撰写论文;李东繁进行研究的实施与可行性分析;王冠杰、范亚莉、李娜苗进行数据收集、整理、分析;柴丽丽、王波进行结果分析与解释;李广顺负责文章的质量控制及审校;杜旭升、李建英对文章整体负责,监督管理。
本文无利益冲突。
