辣椒枯萎病土壤拮抗真菌的筛选与鉴定
2019-09-19莫维弟卯婷婷
莫维弟,卯婷婷
(1.贵州大学 农学院, 贵州 贵阳 550025; 2.贵州省农业科学院 植物保护研究所, 贵州 贵阳 550006)
辣椒产业是贵州省最重要的特色农业产业之一,据统计,至2018年,贵州辣椒种植面积为36.7万hm2,居全国首位[1]。随着辣椒种植面积的不断扩大和连年种植,土传病害发生日益严重,如由尖孢镰刀菌(Fusariumoxysporum)引起的辣椒枯萎病近几年发生频繁,严重影响贵州辣椒的生产,对辣椒种植户造成了巨大的经济损失。尖孢镰刀菌(F.oxysporum)属半知菌类丛梗孢目瘤座孢科镰刀菌属(Fusarium),是引起辣椒枯萎病的病原真菌,其既可侵染辣椒又可在土壤内生存。生产上对辣椒枯萎病的防治多以化学防治为主,但由于化学农药使用不合理极易引起作物药害,导致病原物产生抗药性,人畜中毒及杀伤有益微生物等不良作用。同时,农药的高残留造成环境污染,危害人类健康并破坏生态平衡。近年来,人们对食品安全的要求越来越高,化学防治已经不能满足食品安全性的需求。为此,寻求安全有效的防治措施已成为一个亟待解决的问题。
生物防治具有对环境无污染、对人畜无毒、对植物无副作用,不易产生抗药性等优点,可克服化学农药带来的弊病,尤其适用于土传病害的防治。其既符合人们对绿色食品的需求,又可为农业的可持续发展提供保障,现已成为防治辣椒枯萎病的研究热点。梁建根等[2]研究表明,生防菌株B-3的发酵液及其滤液对辣椒枯萎病菌均表现出较好的抑制作用,对盆栽与大田辣椒枯萎病的防效分别为73.6%和64.8%,显著优于100 mg/L多菌灵。马利平等[3]平板对峙试验结果表明,B96-II发酵液(1010~1011cfu/mL)对辣椒枯萎病菌有明显的抑制作用,浓度稀释100倍以上 (108~109cfu/mL)可完全抑制该病菌的生长。此外,据报道,链霉菌、绿脓杆菌、粘质沙雷菌和荚壳布克氏菌对尖孢镰刀菌都具有明显的抑制作用[4]。鉴于此,以辣椒枯萎病菌为靶标菌,从土壤中筛选对辣椒枯萎病具有拮抗作用的真菌,并对抑制效果好的菌株进行分子生物学鉴定和形态学鉴定,以期为辣椒枯萎病的生物防治研究提供有效的菌种资源。
1 材料与方法
1.1 供试材料
1.1.1 供试病原菌 分别为辣椒枯萎病、辣椒疫病、辣椒炭疽病、辣椒根腐病、茶轮斑病和猕猴桃软腐病的病原菌,共6株菌株(表1),均由贵州省农业科学院植物保护研究所生物防治研究室提供。

表1 供试病原菌信息
1.1.2 土样采集 2017年6月以5点取样法在贵州省荔波县茂兰镇不同生境和不同种植作物地块中采集根际土壤,每个点取1份,共5份,每份100 g。土样信息详见表2。

表2 荔波县茂兰镇土样采集地信息
1.1.3 试剂 葡萄糖,成都金山化学试剂有限公司;琼脂,上海博微生物科技有限公司;真菌DNA提取试剂盒,生工生物工程(上海)股份有限公司;50倍TAE、琼脂糖,上海硕欣生物科技有限公司;GelRed,北京索莱宝科技有限公司;真菌通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’),生工生物工程(上海)股份有限公司;2×Es Taq Master Mix,北京天根生物技术有限公司。
1.1.4 培养基
1) PDA培养基。马铃薯200 g洗净、去皮,加1 000 mL蒸馏水煮沸30 min,取滤液,加入琼脂18 g+葡萄糖20 g+蒸馏水定容至1 000 mL,自然pH。
2) PD液体培养基。用量和做法同PDA,但不加入琼脂,自然pH。
1.2 方法
1.2.1 菌株分离纯化 参考文献[4]的方法采用稀释分离法分离土壤中的真菌。称取土样10 g,加入装有90 mL无菌水的250 mL三角瓶中,放入无菌玻璃球 ,于25℃ 160 r/min摇床中震荡培养30 min。在超净工作台内,用移液枪吸取1 mL的土壤悬浮液放入装有9 mL无菌水的灭菌试管中,充分摇匀后得到浓度为10-1的土壤悬浮液。采用梯度稀释法依次获得浓度为10-2和10-3的土壤悬浮液。用移液枪分别吸取100 μL浓度为10-2和10-3的土壤悬浮液放入PDA平板中,用无菌三角玻璃棒均匀涂开,静置60 s后放到25℃的恒温培养箱中黑暗倒置培养,24 h 后开始观察,一旦平板中有单个菌落形成,立即纯化保存菌株,并对每个菌株进行编号。3次重复。
1.2.2 辣椒枯萎病生防菌的筛选
1) 对峙法初筛。参照文献[5]的方法采用对峙培养法筛选对辣椒枯萎病(尖孢镰刀菌)具有拮抗作用的菌株。将活化的尖孢镰刀菌和从土壤中分离得到的待测真菌,用直径为5 mm的打孔器沿菌落边缘分别打取菌饼,然后将2菌饼分别接种于同一PDA平板上,间距为5 cm。以只接种尖孢镰刀菌的PDA平板作为对照,3次重复。25℃恒温暗培养7 d后,测量病原菌菌落半径,计算每个待测菌株的生长抑制率。
生长抑制率=(对照菌落直径-处理菌落直径)/ 对照菌落直径×100%
2) 抑菌圈法复筛。挑取对峙初筛中抑菌效果较好的菌株进行复筛。将活化培养5 d的尖孢镰刀菌用无菌水洗脱制成1×10-6cfu/mL的孢子悬液,吸取5 mL加入到50 mL 50℃左右的PDA培养基中混匀,然后倒平板备用。取直径5 mm的初筛拮抗菌菌饼接种于平板中央,放于25℃箱中倒置暗培养5 d,观察并记录抑菌圈直径。
1.2.3 拮抗菌株对病原菌的拮抗性测定 将辣椒疫病(Phytophthoracapsici)、辣椒炭疽病(Colletotrichumcapsici)、辣椒根腐病(Fusariumsolani)、茶轮斑病(Pestalotiopsistheae)及猕猴桃软腐病(Phomopsissp)等5种靶标病原菌进行PDA平板活化。采用平板对峙法将活化的病原菌株与1.2.2复筛得到的拮抗菌株进行对峙培养,以只接种5种标靶病原菌的PDA平板作为对照,计算拮抗菌株对各种病原菌的生长抑制率,确定其是否具有拮抗广谱特性。
1.2.4 拮抗菌株的鉴定
1) 形态学鉴定。将复筛得到的拮抗菌株接种到PDA平板中央,25℃恒温箱培养7 d后,观察菌落形态、生长状况和颜色;用接种针在菌落边缘挑取少量菌丝放于纯水中制片后放于光学显微镜下观察其产孢结构及分生孢子等的形态特征,并采集图片。
2) 分子生物学鉴定。参照文献[6-7]的方法用真菌DNA提取试剂盒提取待测菌株的基因组DNA,然后用真菌ITS通用引物ITS1和ITS4进行PCR扩增,PCR反应体系为25 μL:DNA模板(1 μL)、2×Es Taq Master Mix(12.5 μL)、通用引物ITS1(1 μL)、ITS4(1 μL)、dd H2O (9.5 μL);PCR扩增条件:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。扩增产物用1.5%琼脂糖凝胶电泳检测,然后送生工生物工程(上海)股份有限公司测序。
1.3 数据统计
采用 SPSS 19.0 进行数据统计分析。
2 结果与分析
2.1 拮抗菌株的分离与筛选
2.1.1 初筛 从采集5个土样中共分离到真菌菌株61株,经对峙初筛获得对尖孢镰刀菌抑制率≥50%的拮抗菌11株(表3),其中,菌株LB010402的初筛抑制效果最佳(图1),其对尖孢镰刀菌的生长抑制率为60.47%,显著高于其余菌株;菌株LB010302其次,其生长抑制率为56.25%,显著高于除菌株LB010402和LB010307外的其余菌株;菌株LB010401和LB010308的生长抑制率相对较低,分别为50.00%和52.03%,二者差异显著,且均显著低于其余菌株;菌株LB010309、LB010310及LB010301等6株菌株与菌株LB010307间差异不显著。
表3拮抗菌株对尖孢镰刀菌的抑制作用
Table 3 Inhibition effect of antagonistic fungus strains againstF.oxysporum

菌株Strain尖孢镰刀菌生长直径/mmMycelia growth diameter of F. oxysporum尖孢镰刀菌抑制率/%Inhibition rate against F. oxysporumLB01030943.00±0.8253.76±1.76 cLB01031043.00±1.4153.76±3.04 cLB01030143.33±1.5553.41±3.32 cLB05030141.67±0.9454.04±2.08 cLB04030242.33±0.4753.31±1.04 cLB01030239.67±2.0556.25±4.53 bLB01030445.33±0.8554.05±1.72 cLB01040149.33±1.5550.00±3.13 eLB01030744.67±0.6254.73±1.26 bcLB01030847.33±0.2452.03±0.48 dLB01040239.00±0.4160.47±0.83 aCK98.67±0.850.00
注:同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Note: Different lowercase letters after the data in the same column indicate significance of difference atP<0.05 level. The same below.
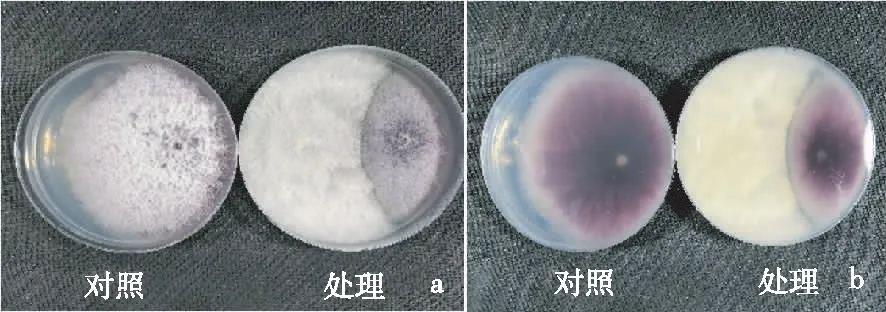
注: a,菌株LB010402与尖孢镰刀菌对峙培养正面; b,菌株LB010402与尖孢镰刀菌对峙培养背面。
Note: a, the obverse of strain LB010402 andF.oxysporumconfrontation culture. b, the reverse of strain LB010402 andF.oxysporumconfrontation culture.
图1菌株 LB010402与尖孢镰刀菌对峙培养的菌落形态
Fig.1 Colony morphology of LB010402 andF.oxysporumconfrontation culture
2.1.2 复筛 在对尖孢镰刀菌具有拮抗作用(生长抑制率≥50%)的11个菌株中,LB010402菌株的抑菌效果最明显,在第5天时其抑菌圈直径达31.5 mm(图2),且抑菌圈边缘菌丝变薄。推断菌株LB010402有可能使尖孢镰刀菌菌丝消解或断裂。因此,选取菌株LB010402进行进一步试验。

图2菌株LB010402在尖孢镰刀菌PDA培养基上形成的抑菌圈
Fig.2 Inhibition zone formed by LB010402 onF.oxysporumPDA culture medium
2.2 菌株LB010402对5种病原菌的拮抗性
从表4看出,菌株LB010402对辣椒疫病、辣椒炭疽病、辣椒根腐病、茶轮斑病及猕猴桃软腐病等的靶标病原菌均具有较好的拮抗作用,其生长抑制率均≥50%。其中,对辣椒疫霉病菌和猕猴桃软腐病菌的抑菌效果较好,抑菌率达64.17%和61.66%,对茶轮斑病菌、辣椒炭疽病菌和辣椒根腐病菌的抑菌率分别为58.65%、51.42%和50.83%。说明该拮抗菌株具有一定的广谱性。
表4菌株LB010402对5种病原菌的抑制作用
Table 4 Inhibition effects of Strain LB010402 against five target pathogens

受试靶标菌Target pathogen菌株生长直径/mmGrowth diameter of target pathogens处理对照(CK)对靶标菌的生长抑制率/%Inhibition rate against target pathogensPhytophthora capsici38.33±1.93107.00±1.0064.17±3.61 dPhomopsis sp.40.00±1.78104.33±0.4761.66±3.41 cFusarium solani44.00±0.82 88.67±0.2450.38±1.84 aPestalotiopsis theae36.67±0.62 91.33±0.6259.85±1.37 bColletotrichum capsici40.00±2.86 82.33±0.4751.42±6.94 a
2.3 拮抗菌株LB010402的鉴定
2.3.1 形态学特征 从图3可见,菌株LB010402在PDA培养基上生长5 d后形成浅黄褐色菌落,菌丝呈羊毛状;生长10 d后菌丝聚结逐渐形成黑色子囊果,黑色子囊果呈圆形或卵圆形,黑褐色,直径为150~265 μm,上着生许多附属丝;子囊果破裂后释放出大量子囊孢子,呈椭圆形或柠檬形,孢子大多两端呈突起状,褐色至黑褐色,大小为(8.6~11)μm×(6~7.5)μm。该菌的培养及显微形态特征与许秀兰等[8-10]报道的球毛壳菌(Chaetomiumglobosum)特征基本相符。

注:a,PDA平板上菌株LB010402的菌落正面(左)和反面(右)形态;b,子囊果;c,子囊孢子。
Note: a, the colony obverse (left) and reverse (right) morphology of strain LB010402 on PDA; b, ascocarp; c,ascopore.
图3菌株LB010402的形态特征
Fig.3 Morphological characteristics of Strain LB010402
2.3.2 分子生物学鉴定 PCR扩增菌株LB010402的ITS全场序列,获得一段长度约600 bp的DNA片段。经与GenBank中的基因序列进行比对发现,其与球毛壳菌(Chaetomiumglobosum)(Genbank登录号KM268639.1)的同源性最高,达99.81%。从图4可见,根据ITS序列构建的毛壳菌属(Chaetomium)分子系统发育树,菌株LB010402与球毛壳菌(C.globosum)聚在一个子分支上,支持率达96%。综合其形态学特征与分子生物学鉴定结果,确定菌株LB010402为球毛壳菌(C.globosum)。

图4 根据ITS序列建立的系统发育树
3 结论与讨论
该研究从贵州省荔波县不同生境土样中筛选到1株真菌LB010402,经形态学和分子生物学鉴定,其为球毛壳菌(Chaetomiumglobosum)。目前关于球毛壳菌的研究主要集中在其次级代谢产物[11-15]方面,此外,也有关于其生物防治分子机理方面的研究和作为优良生物防治基因克隆理想生物材料[16]方面的研究。
球毛壳菌菌株LB010402对辣椒枯萎病有较好的拮抗作用,其抑制率为60.47%;同时,其对辣椒疫霉病菌、猕猴桃软腐病菌和茶轮斑病菌也有较好的抑制作用,其抑制率分别为64.17%、61.66%和59.85%,说明该菌株具有较好的广谱性。但由于田间土壤环境复杂,具有不定性因素,因此,在室内筛选到的拮抗真菌在大田的防治效果需要进一步通过大田试验进行研究。
生物防治是病害防治中一种重要且行之有效的防治手段[17],相较于化学防治而言,既经济有效又绿色环保。生物防治不仅可以解决农药带来的“3R”问题,还能满足人们对食品安全的需要。辣椒是我国大部分地区饮食中不可缺少的原料,采用生物制剂进行辣椒枯萎病防治,不仅符合人们对绿色食品的需求,而且为农业的可持续发展提供了保障。该研究筛选的拮抗真菌可为辣椒枯萎病的生物防治提供有效的菌种资源。
