苹果树腐烂病菌拮抗细菌筛选及鉴定
2019-09-18杨树刘海霞范万泽李兴昱薛应钰
杨树,刘海霞,范万泽,李兴昱,薛应钰
(甘肃农业大学植物保护学院,植物病害生物防治实验室,甘肃 兰州 730070)
苹果树腐烂病是由Cytosporaspp.引起的一种真菌性病害,在中国的苹果生产地区十分常见,患病果树的枝干会枯死,甚至导致整棵树死亡,从而毁灭果园[1-2].自1916年辽宁省首次发现苹果树腐烂病以来,出现了多次大流行.2008 年,据国家苹果产业技术体系调查,中国苹果树腐烂病总发病率为52.7%,部分地区发病率高达 85% 以上,造成了严重的经济损失[3-4].随着中国苹果树栽培制度及种植结构的调整,苹果树腐烂病已经成为限制中国苹果产业发展的主要因素[5].目前苹果树腐烂病的防治主要以化学药剂为主,但长期大量使用化学药剂会引起一系列问题,如环境污染、食品安全和病原菌抗性等,因此,寻求一条新的防治途径迫在眉睫[6-7].
生物防治具有高效、安全、低毒等特点.目前国内外已有关于利用生防菌对苹果树腐烂病进行防治的报道.高克祥等[8]研究表明,从杨树树干分离的哈茨木霉的菌丝以及从苹果树腐烂病病疤中分离的深绿木霉菌丝均可以穿过苹果树腐烂病病菌菌丝生长,从而抑制苹果树腐烂病生长;Xin等[9]研究表明螺旋毛壳(Chaetomiumspirale) 对苹果树腐烂病菌有较强的重寄生或拮抗作用;邓振山等[10]报道银杏茎叶中分离出的球壳孢属(Sphaeropsissp.)、匐柄霉属(Stemphyliumsp.)、刺盘孢属(Colletotrichumsp.)等内生真菌可引起苹果树腐烂病菌菌丝畸形以及菌丝断裂;郜佐鹏等[11]报道从黄瓜根叶分离得到多种内生放线菌,其发酵滤液均能有效抑制苹果树腐烂病菌孢子萌发及菌丝生长;展丽然等[12]鉴定为链霉菌属(Streptomyces) 的金色类群 (Aureus)的 Z-6 菌株对腐烂病亦有防效,但是,关于使用拮抗细菌防治苹果树腐烂病的报道很少.因此,本试验从苹果树根际土壤及发病枝条中分离出对苹果树腐烂病菌具有良好抑制效果的拮抗细菌,确定其分类地位,以期为苹果树腐烂病的生物防治提供优良的菌种资源.
1 材料与方法
1.1 材料
1.1.1 供试菌株 苹果树腐烂病菌(Cytosporaspp.) 由甘肃农业大学植物保护学院植物病理学实验室提供.
1.1.2 供试培养基 用NA培养基(蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,琼脂15.0 g,pH 7.2~7.4)分离纯化拮抗细菌[13],用PDA培养基(马铃薯200.0 g,葡萄糖20.0 g,琼脂15.0~20.0 g,水1 000 mL,pH 7.2~7.4)培养苹果树腐烂病菌,完成对峙试验[14].
1.1.3 供试土壤及苹果枝条 2015 年 7~9 月,于兰州、平凉、庆阳各市‘富士’苹果园采集.
1.2 拮抗细菌的分离纯化
将各地采集回来的土壤过筛后,分别称量10 g加入90 mL无菌水,于28 ℃、180 r/min条件下振荡2 h,静置;刮取并称量感染苹果树腐烂病的树皮1 g研磨至匀浆,加入9 mL无菌水振荡30 min,静置.使用接种环来蘸取上清液划线直至获得单菌落,置于28 ℃培养箱培养3 d后,挑取单菌落进行纯化,观察记录单个菌落大小、颜色、表面平滑度和边缘形状等,编号,于4 ℃下保存备用[15].
1.3 拮抗细菌的筛选
1.3.1 苹果树腐烂病拮抗细菌的初筛 采用平板对峙法[16].在PDA平板的背面用“十”字交叉法做标记,将苹果树腐烂病菌菌饼(d=5 mm)接于培养基中央,菌落面向下,在“十”字两端等距离(离中心30 mm)接各拮抗细菌菌饼,每个处理重复3次,以仅接苹果树腐烂病菌的平板为对照,置于28 ℃培养箱培养,待对照菌丝铺满整个平板时,用“十”字交叉法测量菌落直径,并根据公式计算抑菌率.

(1)
1.3.2 苹果树腐烂病拮抗细菌的复筛 将初筛得到的菌株接种在80 mL的NB液体培养基中,于180 r/min、28 ℃下振荡培养48 h.取发酵液,于4 ℃、12 000 r/min离心20 min,取上清液经0.22 μm微孔过滤器过滤,收集发酵滤液(原液),于4 ℃保存备用.
将制备好的发酵滤液加入PDA培养基混合均匀,制备5倍、10倍和20倍稀释液,将苹果树腐烂病菌菌饼(d=5mm)接于培养基中央,菌落面向下,以加等量无菌水的PDA培养基为对照,每处理重复3次.置于25 ℃下暗培养,待对照菌丝铺满整个培养皿后,用“十”字交叉法测量菌落直径,并根据公式(1)计算抑菌率.
1.4 拮抗细菌的鉴定
1.4.1 形态及培养特征观察 参考邓刚等[17]方法对筛选出的拮抗菌株的菌落培养特征与形态特征等进行鉴定.
1.4.2 生理生化特性测定 通过参考《常用细菌系统鉴定手册》[15]和《伯杰氏细菌鉴定手册》[18]中的方法测定拮抗菌株的生理和生化等表型特征.
1.4.3 16S r-DNA分子鉴定 以细菌基因组DNA为模板,Primer7F:CAGAGTTTGATCCTGGCT和Primer1054R:AGGAGGTGATCCAGCCGCA为引物,进行扩增.PCR反应体系为25 μL:模板DNA 1 μL,Primer 7F和Primer 1054R各0.5 μL,dNTP 0.5 μL,10×Taqreaction Buffer 2.5 μL,Taq(5 U/μL)0.2 μL,ddH2O 19.8 μL.反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火35 s,72 ℃延伸1 min,35个循环;72 ℃延伸8 min.使用1%琼脂糖凝胶电泳检测PCR产物,将凝胶送至上海生工生物工程有限公司进行测序,测序结果在GenBank中进行同源性比对,并使用软件MEGA6.0构建系统发育树.
1.5 数据统计与分析
采用Excel2007软件进行统计分析和作图,采用SPSS19.0软件和Duncan氏新复极差法进行多重比较.
2 结果与分析
2.1 拮抗细菌初筛
从苹果树根际土壤中分离出8个菌株,从发病枝条中分离出5个菌株,共13个菌株.对这13个菌株进行初筛,结果表明,其中5株细菌对苹果树腐烂病菌具有一定的拮抗作用,其中菌株QYTR-2和LZZT-1对苹果树腐烂病菌具有较好的拮抗作用(图1),其抑菌率分别达82.00%和72.00%,显著高于其他3株细菌(表1).
2.2 拮抗细菌的复筛
通过生长速率法对菌株QYTR-2与LZZT-1进行复筛,结果表明,二者均对苹果树腐烂病菌具有一定拮抗作用,其中菌株QYTR-2的5倍稀释液对腐烂病菌的抑菌率最高,达92.23%,显著高于菌株LZZT-1(表2).
2.3 拮抗细菌的鉴定
2.3.1 形态特征及理化特性测定 菌株QYTR-2在PDA培养基上生长良好.28 ℃下3 d可出现明显菌落.QYTR-2菌株的菌落几乎呈圆形、乳白色、不透明、表面粗糙(图3),菌体杆状,大小1.0×(2.0~4.0)μm.生理生化指标见表3.理化特性试验结果表明,QYTR-2对接触酶、VP试验、D-葡萄糖产气反应、肉汤反应、甲基红反应、D-甘露醇、木糖试验、淀粉酶反应、酪氨酸水解、硝酸还原酶、酪素分解和柠檬酸盐利用结果均为阳性,苯丙氨酸脱氨酶反应为阴性.结合菌体培养特征和生理生化反应特性,QYTR-2符合寡养单胞菌属Stenotrophomonas特征.
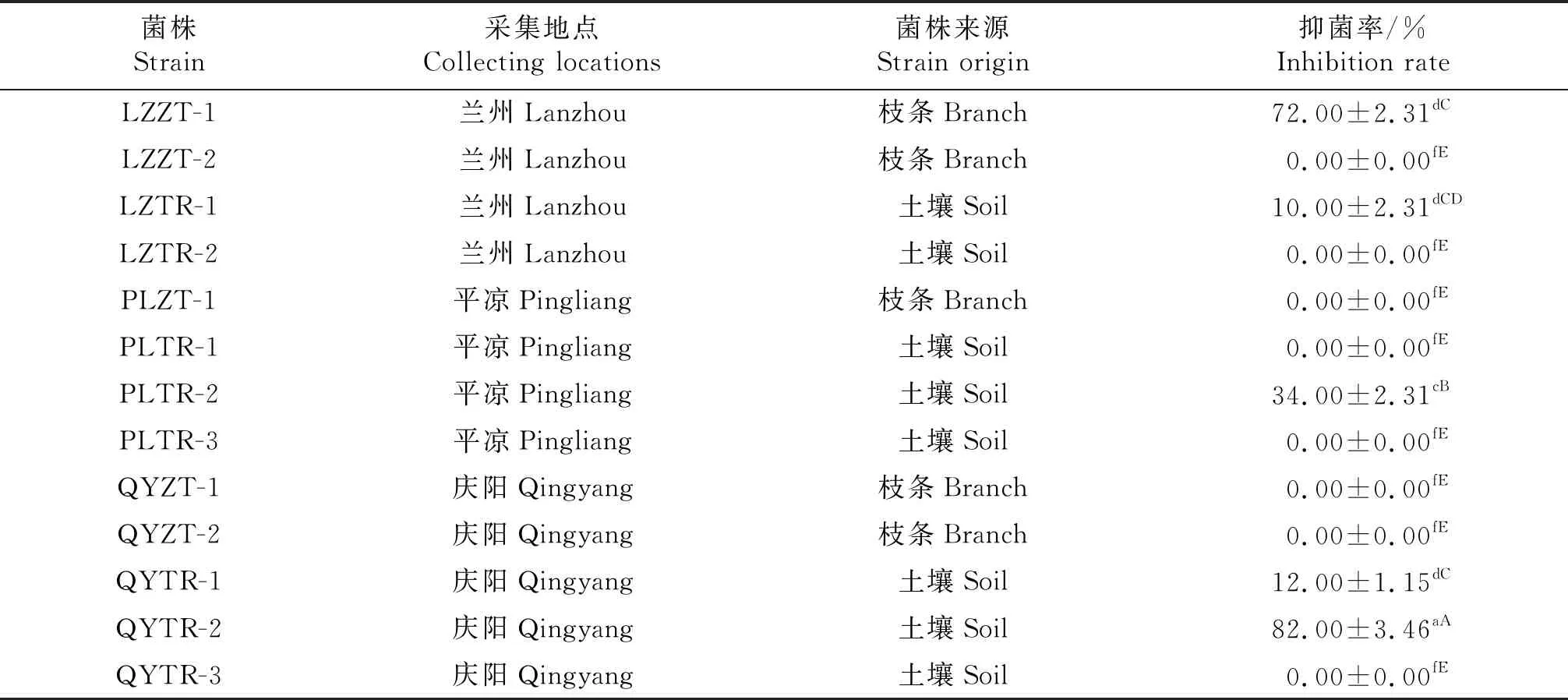
表1 从苹果园土壤和苹果枝条分离的细菌菌株对苹果树腐烂病菌的抑制作用
同列数据后不同大、小写字母分别表示在0.01和0.05水平上差异显著.
Data in the same column followed by different capital and small letters were significantly difference at 0.01 and 0.05 level,respectively.
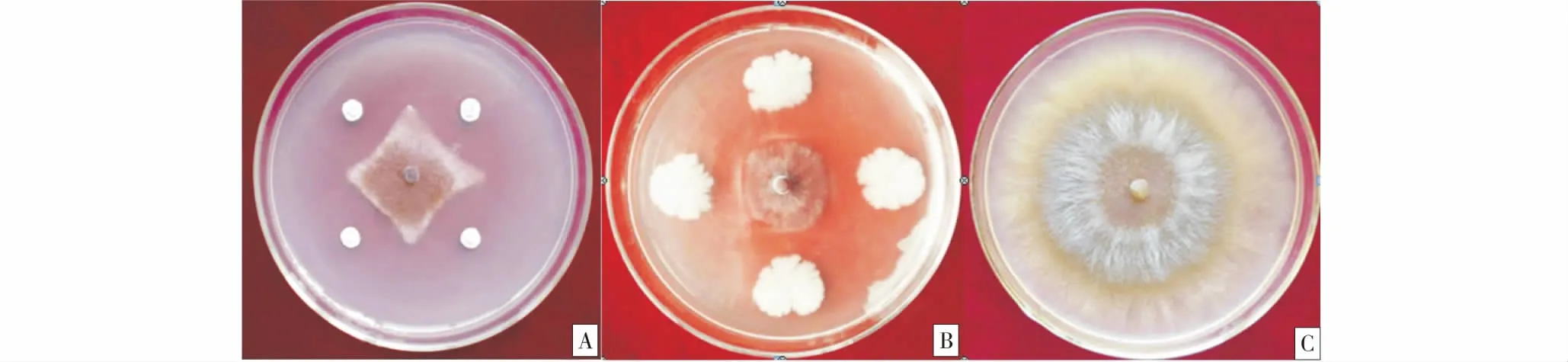
A:LZZT-1;B:QYTR-2;C:CK.图1 拮抗细菌与苹果树腐烂病菌对峙效果Figure 1 The confrontation effects between antagonistic bacteria and Cytospora spp.

表2 拮抗细菌不同稀释倍数发酵滤液对苹果树腐烂病菌的抑制作用
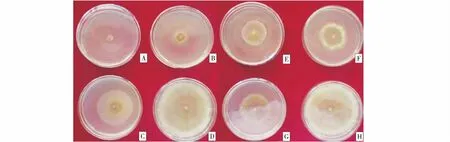
A:QYTR-2 5倍液;B:QYTR-2 10倍液;C:QYTR-2 20倍液;E:LZZT-1 5倍液;F:LZZT-1 10倍液;G:LZZT-1 20倍液;D、H:CK.A:QYTR-2 5×;B:QYTR-2 10×;C:QYTR-2 20×;E:LZZT-1 5×;F:LZZT-1 10×;G:LZZT-1 20×;D、H:CK.图2 不同稀释倍数发酵液对苹果树腐烂病菌的抑制效果Figure 2 Inhibition Effects of fermentation broths with different dilution times on Cytospora spp.
2.3.2 16S r DNA序列分析 通过PCR扩增菌株QYTR-2的16S rDNA序列,片段大小1 481 bp.在NCBI数据库中搜索与其具有较高相似性的参比菌株,进行序列相似性分析.使用软件MEGA6.0将菌株QYTR-2与来自Gen-Bank的9株细菌一起构建基于16S rDNA序列的系统发育树(图4),结果显示QYTR-2和模式菌株嗜麦芽寡养单胞菌StenotrophomonasmaltophiliaMTCC434T(JAL V01000036)以及该属的另一株菌StenotrophomonaspavaniiICB 89 T(FJ748683)位于同一进化分支上,其序列的同源性较高,相似值高于99%.结合形态特征和生理生化特性分析结果,将QYTR-2初步鉴定为嗜麦芽寡养单胞菌Stenotrophomonasmaltophilia.
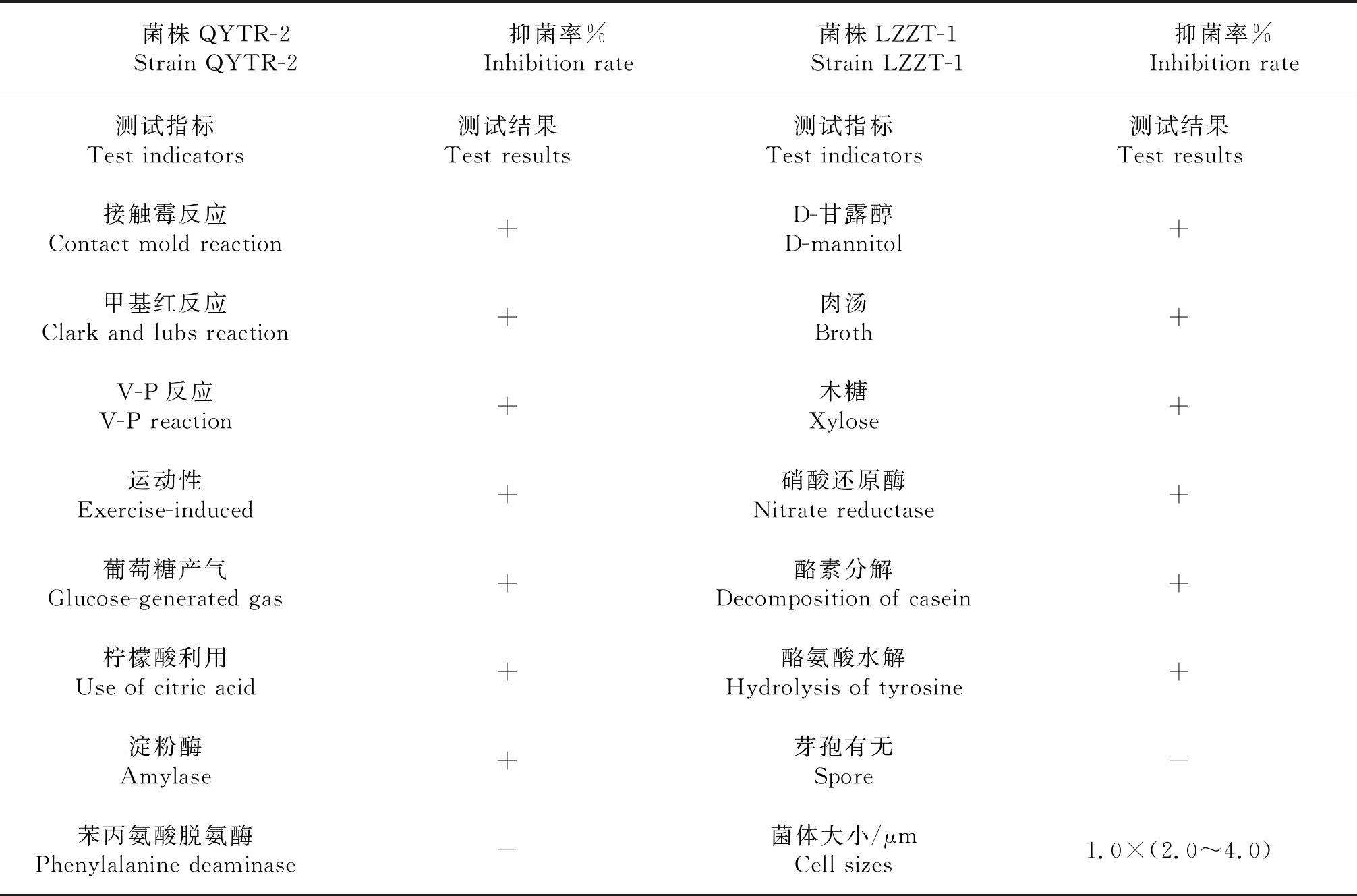
表3 筛选出的拮抗细菌菌株QYTR-2的生理生化测定结果
+:阳性反应; -:阴性反应.
+:positive reaction;-:negative reaction.
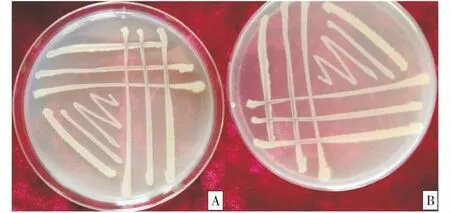
A:菌落正面;B:菌落背面.A:Colonies positive; B:Colonies back.图3 筛选出的拮抗细菌菌株QYTR-2菌落形态特征Figure 3 Colony morphology of selected antagonistic bacterial strains QYTR-2
3 讨论
拮抗细菌因其增殖速度快、易定殖、适应力强,已成为植物病害生物防治中重要的研究对象[19].拮抗细菌能形成、分泌拮抗物质,抑制病原菌孢子萌发、导致菌丝畸形,从而控制病害发生.目前利用拮抗细菌防治苹果树腐烂病已有相关报道,多集中在芽孢杆菌属(Bacillus)的一些种.黄昌华等[20-21]从小麦土壤中分离出的芽孢杆菌菌株B-HCH对小麦赤霉病和苹果树腐烂病均具有良好的防治作用,其发酵滤液对苹果树腐烂病菌抑制率达到84.10%;邓振山等[22]分离出的G2、G9、J32和Y40四株苹果树内生菌,其发酵滤液对苹果树腐烂病菌的抑制率均达到70.00%以上,并引起菌丝萎缩、畸形.王卫雄等[1]从苹果根际土壤和苹果树枝条上分离鉴定的枯草芽孢杆菌(B.subtilis)菌株LZ-1201和解淀粉芽孢杆菌(B.amyloliquefaciens)菌株TS-1203,对苹果树腐烂病菌的抑制率分别为79.00%和85.00%,离体枝条试验防治效果分别为74.43%和77.07%.此外,蔡光华等[23]分离得到的PG-10-8-11v拮抗细菌菌株对苹果树腐烂病亦具备良好的抑制作用.然而,利用寡养单胞菌属(Stenotrophomonas)细菌来防治苹果树腐烂病鲜见报道.王彩霞等[21]从土壤中分离出与本试验拮抗细菌相同属的微嗜酸寡养单胞菌(S.acidaminiphila)菌株BJ1,该菌株能有效抑制苹果树腐烂病菌分生孢子的萌发,并影响菌丝发育,造成菌丝畸形、分支增多及细胞质外渗,其菌体和发酵滤液对苹果树腐烂病菌的抑制率分别为78.38%和70.54%,本研究筛选获得的嗜麦芽寡养单胞菌(S.maltophilia)菌体和发酵液对苹果树腐烂病菌的抑制率分别达82.00%和92.23%,优于菌株BJ1,这可能是由于不同种的菌株之间生长特性、分泌拮抗物质能力等的差异性造成的.
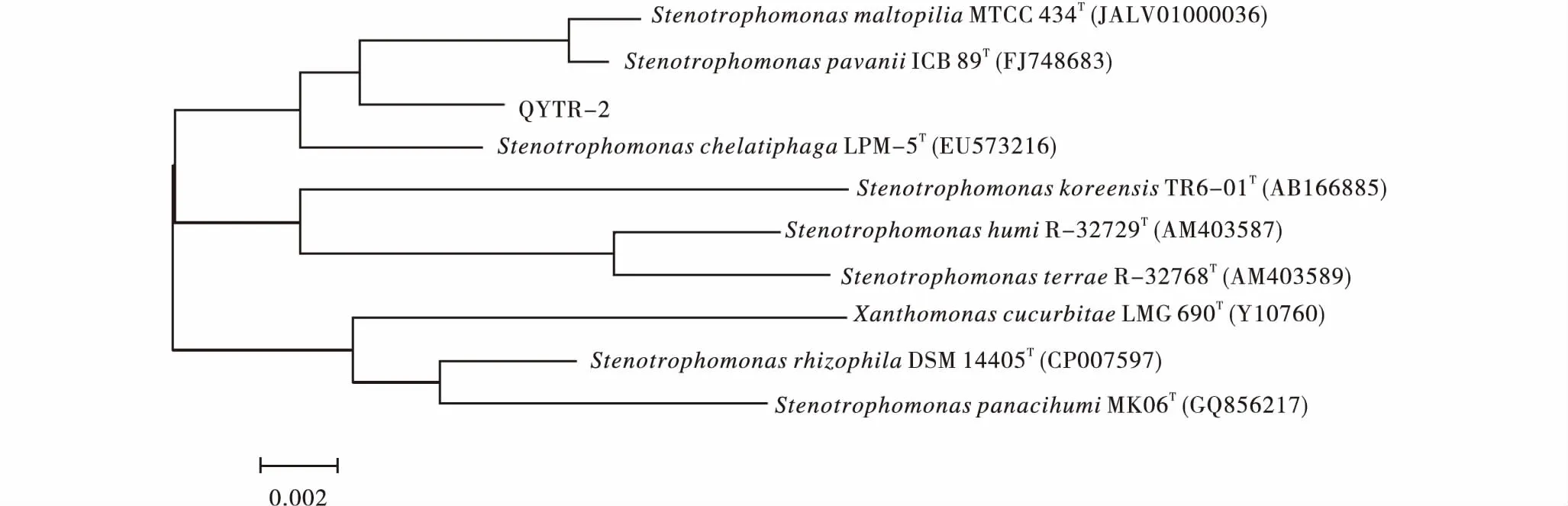
图4 基于16S rDNA序列构建的菌株QYTR-2的系统发育树Figure 4 Phylogenetic tree of strain QYTR-2 based on 16S rDNA sequence
嗜麦芽寡养单胞菌(S.maltophilia)是一种革兰氏阴性杆状细菌,广泛存在于土壤、水、植物根际、农副产品、人体和动物体表面[24-25].本试验从苹果树根际土壤分离出对苹果树腐烂病菌具有较高抑菌活性的菌株QYTR-2,经鉴定为嗜麦芽寡养单胞菌.当发酵滤液稀释到5倍时,抑率菌达到了92.23%,说明该菌株产生的次生代谢产物具有较高的抑菌活性,可以作为苹果树腐烂病的生防菌株,具有潜在的开发利用价值.但是,目前对该菌株仅进行了室内抑菌效果测定,对其抑菌机理、拮抗物质分离、离体枝条防效和田间防效等有待进一步研究.
4 结论
本研究从苹果树根际土壤和发病枝条中分离出13株细菌,利用菌丝生长速率法和平板对峙法,以苹果树腐烂病菌为目标菌,对其进行筛选.筛得的菌株QYTR-2对苹果树腐烂病菌具有明显抑制作用,其5倍稀释液抑菌率高达92.23%.通过对菌株QYTR-2的培养与形态观察、生理生化测定和16S rDNA序列分析,将菌株QYTR-2鉴定为嗜麦芽寡养单胞菌Stenotrophomonasmaltophilia.
