松萝酸对耐甲氧西林金黄色葡萄球菌的抑菌作用机制研究
2019-09-18袁中伟谷可欣张天翼申翰君周能华李超尹立子
袁中伟,谷可欣,张天翼,申翰君,周能华,李超,尹立子
(四川农业大学动物医学院,四川 成都 611130)
松萝酸又名地衣酸,主要存在于松萝属、树发属、树花属、扁枝衣属、岛衣属、石蕊属、梅衣属、茶渍属和赤星衣属等属的地衣中,是一种呋喃类强力抗生素[10].目前广泛应用于止血,抗菌,消炎,伤口愈合,除牙斑,可以增强人体免疫力,对口腔溃疡病和阴道炎有较好的疗效[11].研究发现,松萝酸对金黄色葡萄球菌(Staphylococcusaureus)、大肠埃希菌(Escherichiacoli)、短链芽孢杆菌(Bacilluspumilus)、枯草芽孢杆菌(Bacillussubtilis)和苏云金芽孢杆菌(Bacillusthuringiensis)均有一定的抑制作用[12-13].然而松萝酸对MRSA抑菌机制尚不清楚.因此,本试验选取MRSA标准菌株USA300为研究对象,通过研究松萝酸对USA300细胞膜和细胞壁通透性、蛋白质代谢、乳酸脱氢酶、形态结构和生物被膜的形成等方面的影响,阐述松萝酸抑制MRSA的作用机制,研究结果将为松萝酸及含松萝酸成分的中药用于抗MRSA感染提供可靠的理论依据.
1 材与和方法
1.1 试验材料
UV-2000型紫外分光光度计(UNICO,美国);微量分光光度计NanoDrop One(Thermo,美国);HT7700透射电镜(Hitachi,日本);ZD-85A气浴恒温振荡器(金坛市科析仪器有限公司,中国).
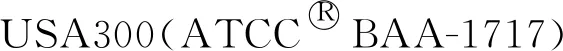
1.2 试验方法
1.2.1 敏感性试验 采用液体倍比稀释法测定松萝酸对USA300的最小抑菌浓度(minimum inhibitory concentration,MIC)[14].采用琼脂平板菌落记数法测定松萝酸对USA300的最低杀菌浓度(minimum bactericidal concentration,MBC)[15].
采用比浊法探究不同浓度松萝酸对USA300生长的影响[16].挑取USA300菌落接种至试管中,37 ℃静置培养10 h,菌液按2%接种到BHI液体培养基继续培养.当菌液OD600=0.3时,加入松萝酸,使培养基中松萝酸的终质量浓度分别为0、8、16、32、64、128、256 μg/mL.加药后的培养基置于气浴恒温振荡器(37 ℃,200 r/min)培养,在0、1、2、4、6、8、16、24 h使用紫外分光光度计测定培养基的OD600,根据吸光度值绘制生长曲线.
1.2.2 细胞内DNA泄漏的测定 109CFU/mL的USA300菌液用PBS缓冲液洗涤2次,用PBS缓冲液定容至107CFU/mL.将该菌悬浮液与松萝酸(256 μg/mL)在37 ℃条件下静置培养.在松萝酸作用0、1、2、4、6 h后,菌悬液5 500 r/min离心10 min,用微量分光光度计测定上清液中DNA含量[17].其他条件不变,以不加药组作为对照组.
1.2.3 可溶性蛋白质含量的测定 向109CFU/mL USA300菌液中加入松萝酸,使培养液中松萝酸终质量浓度为256 μg/mL.气浴恒温振荡器中培养(37 ℃,200 r/min)2、6 h时分别取悬浮液并BHI培养基稀释至108CFU/mL.菌悬液5 000 r/min离心10 min,用PBS缓冲液洗涤2次并定容,然后进行超声破碎.超声破碎液一部分用BCA蛋白浓度测定试剂盒测定其蛋白质含量.剩下的按3∶1体积比加入4×双色蛋白上样缓冲液,混匀,在沸水浴中煮沸10 min,5 000 r/min离心10 min,取上清液进行SDS-PAGE[18].其他条件不变,以不加药组作为对照组.
1.2.4 乳酸脱氢酶(LDH)的测定 将USA300菌液(109CFU/mL)与松萝酸(256 μg/mL)共培养0、1、2、4、6、8 h后取菌悬液并稀释至108CFU/mL.稀释的菌悬液离心(5 000 r/min,10 min,4 ℃),收集菌体沉淀用PBS定容混匀并超声破碎.所得样品离心(5 000 r/min,10 min,4 ℃),用乳酸脱氢酶测定试剂盒测定其LDH浓度[19].其他条件不变,以不加药组作为对照组.
如何减少学术期刊对作者利益的侵害,转变作者对学术期刊的抵制为支持呢?近年来,国内外学术期刊出版机构采取了许多措施以避免期刊与作者的利益冲突。 例如,总部设在英国的出版伦理委员会(COPE)制定了详细的学术出版伦理规范。 其内容包括: 总的伦理原则,关于编辑的伦理原则,关于审稿人的伦理原则,关于作者的伦理原则。[7] 在国内,《第三军医大学学报》编辑部制定了详细具体的出版伦理规范,为中国的学术期刊的编辑出版树立了榜样。 《第三军医大学学报出版伦理规范》包括四个方面的内容: 作者伦理,审稿人伦理,编辑伦理,出版者伦理。[8]
1.2.5 透射电子显微镜(TEM)分析 对数期的USA300菌液中加入松萝酸,使松萝酸终质量浓度为256 μg/mL,离心(4 500 r/min,10 min)后收集菌体.PBS缓冲液洗涤菌体沉淀2次后用20倍体积的Gluta固定液(电镜专用,2.5%)4 ℃固定10 h.固定后的菌体按透射电镜样品制备方法制样[20-21],于HT7700透射电镜(电压120 kv)放大10 000倍观察菌体形态和结构变化[22-23].其他条件不变,以不加药组作为对照组.
1.2.6 松萝酸对USA300菌体生物被膜形成的影响 采用结晶紫染色法测定生物被膜[24].挑取USA300菌落接种至试管中,在37 ℃静置培养10 h,菌液按2%分别接种在含有0、8、16、32、64 μg/mL松萝酸的BHI液体培养基中培养至108CFU/mL.然后分别取10 μL菌液和290 μL含有3%蔗糖(W/V)BHI液体培养基在96孔细胞培养板(平底)中37 ℃厌氧静置培养18 h;移除上层液体和浮游细菌后,用PBS洗涤2次;再加入10%的甲醛溶液100 μL,室温静置10 h;移除甲醛溶液,用100 μL的0.1%的结晶紫溶液染色30 min;用超纯水冲洗,室温干燥;加入33%冰醋酸200 μL,充分混匀后测其在490 nm的吸光度,以吸光度反映菌株生物被膜的形成能力.
1.3 数据处理
每个试验重复3次,采用Prism 7.0对数据差异显著性分析进行分析,正态计量数据用“平均值±标准误”表示.
2 结果与分析
2.1 松萝酸对USA300生长的影响
松萝酸对USA300的MIC为128 μg/mL,MBC为512 μg/mL.由图1可知,松萝酸质量浓度为128、256 μg/mL的条件下,USA300生长被抑制;当松萝酸质量浓度为64 μg/mL时,USA300在对数生长初期受到轻微的影响;而浓度为8、16、32 μg/mL时,USA300生长几乎没有影响.
2.2 松萝酸对细胞膜和细胞壁通透性的影响
为探究松萝酸对USA300细胞基本结构的影响,本试验对加入松萝酸后泄露的大分子物质(DNA)的含量进行了测定,结果如表1所示.松萝酸作用1 h后,256 μg/mL松萝酸处理组DNA含量比对照组增加(46.73±3.32) ng/μL(P<0.01),证明松萝酸可以改变USA300细胞膜和细胞壁的通透性.
2.3 松萝酸对USA300菌体可溶性蛋白质代谢的影响
SDS-PAGE结果显示,对照组条带(图2,条带1、3)是清晰明亮的,而给药组条带(图2,条带2、4)是模糊暗淡的,且这些变化呈时间依赖性.在蛋白分子量为50~100 ku区间松萝酸给药组条带明显变浅,在20~25 ku区间松萝酸给药组条带基本消失(图2,矩形).BCA蛋白浓度测定试剂盒测定结果显示,加入256 μg/mL松萝酸2、6 h后松萝酸给药组的菌体中可溶性蛋白总量分别比对照组减少(4.59±0.93)%(P<0.05)、(13.36±3.11)%(P<0.05).结果表明,松萝酸可以通过影响USA300菌体内蛋白质的代谢发挥其抑菌作用,且呈时间依赖性.
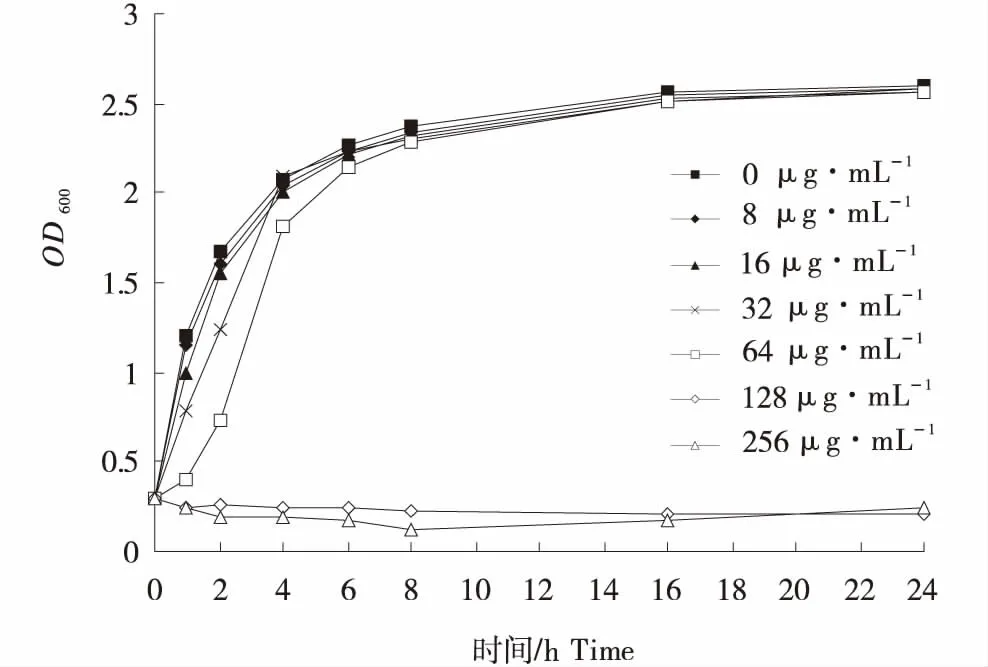
图1 不同质量浓度的松萝酸对USA300在BHI液体培养基中生长的影响Figure 1 Effect of usnic acid at different concentrations on the growth of USA300 in BHI liquid medium

表1 松萝酸对USA300菌体外渗DNA含量的影响Table 1 The effect of usnic acid on the DNA exosmosis amount of USA300
“**”表示差异极显著(P<0.01).
“**” indicates the highly significant differences(P<0.01).
2.4 松萝酸对USA300 LDH含量的影响
试验结果显示,加入松萝酸4 h内,LDH含量没有明显变化.给药6 h后,给药组LDH含量与对照组相比减少(198.8±4.2) U/L(P<0.05),到8 h时,减少量增加至(244.1±10.3) U/L(P<0.05).试验结果表明,松萝酸能有效抑制USA300的LDH的产生,且呈时间依赖性.
2.5 松萝酸对USA300菌体形态结构的影响
透射电镜结果显示对照组MRSA细胞结构完整清晰,形态饱满,边缘清晰,分裂正常,具有清晰的二分裂期分裂缢痕(图3-A、B).经256 μg/mL松萝酸作用10 h后,细胞有轻微的变形,边缘模糊,细胞壁和细胞膜出现损伤(图3-C).松萝酸处理16 h后,细胞发生严重变形,边缘粗糙,细胞壁变厚,细胞质固缩,出现一些小的空泡,细胞严重受损(图3-D).说明松萝酸能破坏细胞壁.
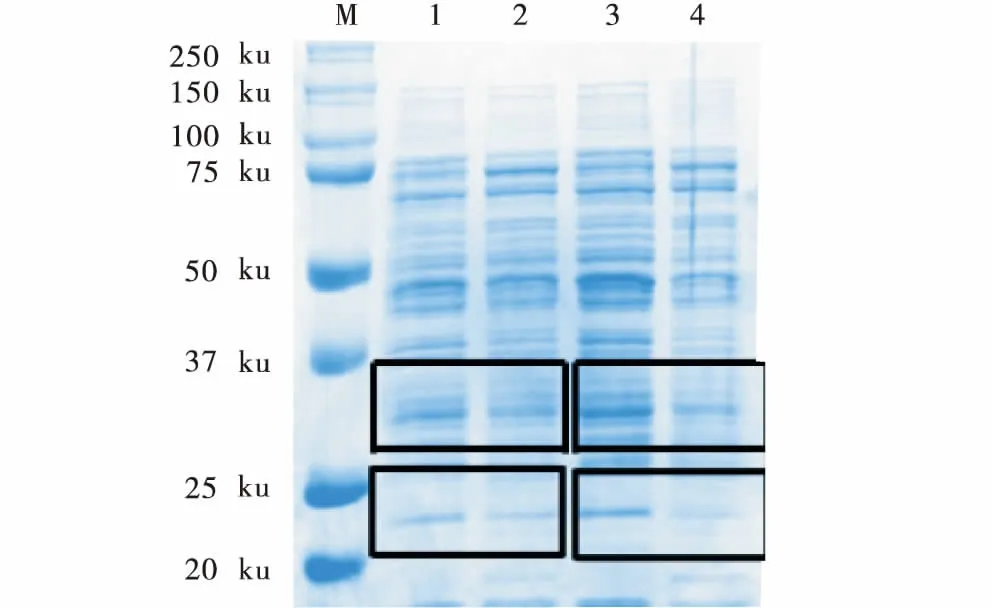
M:Maker;1:2 h对照组;2:2 h给药组;3:6 h对照组;4:6 h给药组.M:Maker;1:2 h control group;2:2 h drug group;3:6 h control group;4:6 h drug group.图2 松萝酸对USA300菌体蛋白质代谢的影响Figure 2 The effect of usniacin on the protein synthesis of USA300
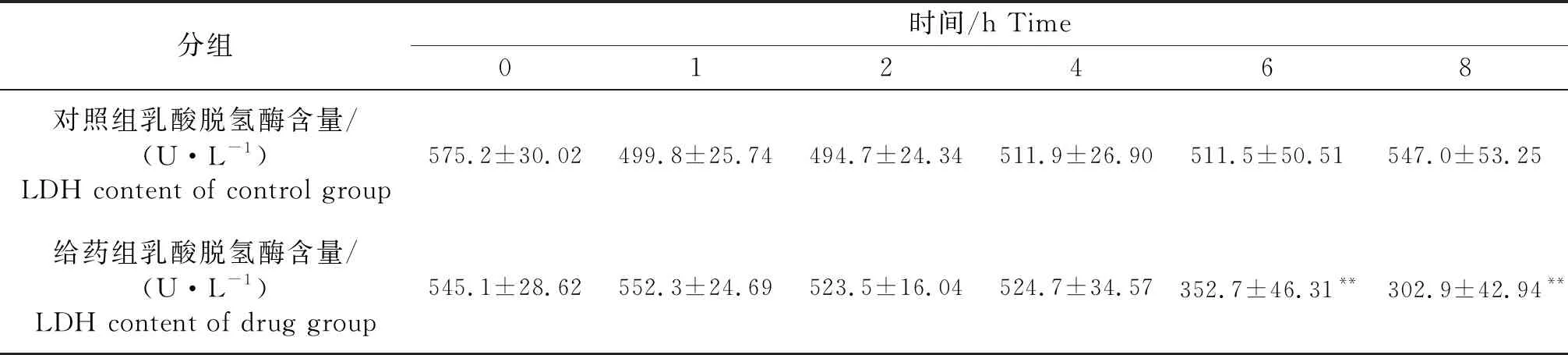
表2 松萝酸对USA300 LDH含量的影响
“**”表示差异极显著(P<0.01).
“**” indicates the highly significant differences(P<0.01).
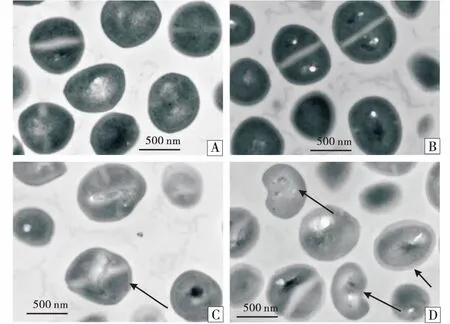
A:10 h对照组;B:16 h对照组;C:10 h给药组;D:16 h给药组.A:10 h control group;B:16 h control group;C:10 h drug group;D:16 h drug group.图3 松萝酸对USA300菌体细胞超微结构的影响Figure 3 The effect of usnic acid on the microscopic structure of USA300
2.6 亚抑菌浓度松萝酸对USA300生物被膜形成的影响
亚抑菌浓度是指低于最小抑菌浓度的药物浓度.生物被膜试验结果显示,给药组OD490值均小于对照组(图4).其中64 μg/mL松萝酸对生物被膜的形成影响最大.经64 μg/mL松萝酸处理后,USA300生物被膜总量相比对照组减少(85.85±2.19)%(P<0.01).而经8、16、32 μg/mL松萝酸处理后,USA300生物被膜总量比对照组减少(37.65±7.60)%(P<0.01)、(46.68±6.54)%(P<0.01)、(51.85±7.00)%(P<0.01).试验结果表明,松萝酸能有效抑制USA300生物被膜的形成,且呈浓度依赖性.
3 讨论
MRSA是医院感染的主要病原菌之一[25-26].敏感性试验表明松萝酸对USA300具有良好的抑菌作用,说明松萝酸具有开发为抗MRSA感染药物的潜力.
许多植物提取物通过破坏细胞结构进而影响细胞功能发挥抗菌作用[27-28].透射电镜结果显示,对照组细胞形态正常,与文献报道一致[21].松萝酸处理组则出现细胞变形,细胞壁、胞膜破损,细胞质固缩,说明松萝酸对MRSA的抗菌作用是通过破坏细菌的细胞结构,导致细胞质外流.
细胞膜为细胞的生命活动提供相对稳定的内环境,同时与外环境进行物质交换、能量交换和信息交换[29].细胞膜的损伤会使细胞质外流,严重影响菌体的新陈代谢[30].细菌细胞壁具有保护菌体、物质转运和参与致病过程等作用[31].细胞壁的损伤会影响其生长、形态和抵抗外界环境的能力等[29].DNA是重要的遗传物质,属于生物大分子,几乎不会通过渗透作用穿过细胞膜和细胞壁,当细胞的结构完整时,培养液中几乎不能检测到DNA.试验中泄露的DNA含量增多,说明细胞膜和细胞壁遭到破坏.在给药后1 h内,溶液中DNA含量迅速增加,说明松萝酸发挥药效迅速;第2 h给药组DNA含量有少量增加,说明松萝酸持续破坏细胞膜和细胞壁;2~4 h的DNA含量未见明显变化,说明细菌细胞膜和细胞壁已完全被破坏.总之,细胞内的DNA泄漏试验表明松萝酸可以改变USA300菌株的细胞膜、细胞壁的通透性.
蛋白质在生物体内具有一系列的功能,包括催化代谢反应、复制DNA和对刺激做出反应等[32].可溶性蛋白在细菌内发挥渗透调节、催化反应和营养储存等作用[33-35].本试验结果显示,与对照组相比,经过松萝酸处理后的菌体内可溶性蛋白总量显著减少,可能是由于细胞膜受到破坏,导致细菌失去相对稳定的内环境,同时细胞质大量外流,新陈代谢失去反应条件,最终表现为可溶性蛋白含量减少.说明松萝酸可以干扰菌体内可溶性蛋白的代谢,同时证明松萝酸可以影响细菌的渗透平衡.
LDH催化丙酮酸和乳酸的相互转化[36],对于金黄色葡萄球菌保持毒力、逃避宿主的先天性免疫以及生物被膜形成是至关重要的[37-38].LDH试验结果表明随着时间的延长,细胞内LDH的含量不断下降,这可能是细胞膜破裂导致大量的LDH外流.松萝酸能够减少LDH的合成,说明松萝酸在影响MRSA毒力,提高免疫响应等方面大有可为.同时LDH 本质上是一种可溶性蛋白质,所以它的减少与可溶性蛋白试验结果一致.
由于药物进入机体后不同组织分布差异极大,药物浓度会随着时间不断降低.所以探究亚抑菌浓度下松萝酸对MRSA的影响非常必要.生物被膜是吸附于惰性或活性材料表面的微生物群落,它会造成细菌的生理性耐药[39].在临床上,生物被膜是细菌在慢性感染和导尿管、假关节等医疗器械引起的感染的罪魁祸首[40].金黄色葡萄球菌感染通常起源于最先的无症状定殖,而在定殖过程中生物被膜扮演着重要的角色[41-42].它通常粘附在细胞或材料表面并保护细菌逃避免疫系统[43].因此针对慢性MRSA感染和植入性医疗器械感染要以生物被膜为治疗靶标.生物被膜试验结果表明亚抑菌浓度松萝酸可以有效抑制USA300生物被膜的形成,说明当松萝酸进入机体被代谢成较低浓度时,仍然可以干扰MRSA的定殖并使MRSA暴露在免疫系统的监控中.同时松萝酸通过抑制MRSA生物被膜的形成减少耐药性的产生.
4 结论
松萝酸可以通过改变细胞膜的通透性,破坏菌体细胞膜和细胞壁的完整性、干扰菌体内蛋白质的代谢等途径来抑制USA300的生长繁殖,并在亚抑菌浓度抑制细菌生物被膜的形成.关于其他的作用机制还有待于进一步研究.同时本研究表明,松萝酸可能是治疗MRSA感染的潜在药物,但有必要对动物模型进行疗效和毒性评价以指导临床应用.
