肾疏宁干预HBV诱导的HK-2细胞转分化及迁徙能力的研究*
2019-09-18杨熙凯王耀光
杨熙凯,徐 冰,王耀光
(1.天津中医药大学第一附属医院,天津 300381;2.天津中医药大学,天津 301617)
乙型肝炎病毒相关性肾炎(HBV-GN),简称乙肝相关性肾炎,中国是乙型肝炎病毒(HBV)感染的高发地区,HBV-GN的检出率呈逐年上升趋势[1]。目前多认为HBV-GN的发病为HBV直接侵犯肾脏上皮细胞[2]导致,同时肾脏中确定了HBV抗原的表达,并揭示了病毒复制和直接病毒诱导的病理改变[3-4]。当乙肝病毒侵犯肾脏时,会对肾小管上皮细胞造成损伤导致肾小管-间质纤维化的发生[5],肾小管上皮细胞-间充质细胞转分化(TEMT)是肾间质纤维化的关键过程。肾疏宁是黄文政教授“疏利少阳”学术思想的代表方剂,用于治疗免疫球蛋白A(IgA)肾病[6]、膜增生性肾炎[7]、HBV-GN[8]等肾病,是临床常用方剂,但是本方在治疗HBV-GN的作用机制方面尚不清楚。故本实验使用脂质体转染C基因型重组乙型肝炎病毒(pHY106-HBV)质粒至肾小管上皮细胞,旨在证明HBV质粒可以诱导HK-2细胞发生转分化,而肾疏宁含药血清可以抑制其对HK-2细胞的不良作用。
1 实验材料
1.1 主要仪器与试剂 SANYO MCO-15AC CO2恒温培养箱,SANYO公司;DMED/F12培养基(批号:C11995500BT),Gibco公司;胎牛血清(批号:35-010-CV),Cellgro 公司;Opti-MEM(批号:31985-070),Gibco 公司;lipofectamine 2000(批号:11668019),Invitrogen公司;人乙肝病毒e抗原(HBeAg)酶联免疫吸附实验(ELISA)Kit ELISA(EK0215),SAB 公司;人乙型肝炎病毒表面抗原(HBsAg)ELISA Kit(EK0216),SAB 公司;Transwell小室(PI342050),Corning公司。
1.2 实验药物 肾疏宁的方剂组成为柴胡15 g,生黄芪 30 g,黄芩 10 g,丹参 30 g,鬼箭羽 30 g,山茱萸12 g,萹蓄15 g,白花蛇舌草30 g,益母草30 g。中药购自天津中医药大学第一附属医院,煎煮后使用旋转蒸发仪浓缩至生药含量为5.512 g/mL。pHY106-HBV及pHY106真核表达载体(不含重组HBV的空载质粒),为北京地坛医院刘顺爱教授惠赠。
1.3 细胞与小鼠 HK-2细胞购自武汉普诺赛生命科技有限公司;SPF级成年C57BL/6小鼠60只,体质量20~25 g,雌雄各半,购于北京维通利华实验动物技术有限公司,饲养于中国医学科学院放射医学研究所。
2 实验方法
2.1 制备含药血清 将小鼠随机分为空白组、肾疏宁低浓度组、肾疏宁中浓度组、肾疏宁高浓度组,每组15只。根据人和动物间体表面积折算的等效剂量比率表换算,肾疏宁高浓度组生药浓度为2.756 g/mL,肾疏宁中浓度组生药浓度为2.034 g/mL,肾疏宁低浓度组生药浓度为1.313 g/mL,以每日每只小鼠0.2 mL/10 g灌胃,空白组灌服同体积生理盐水,灌胃7 d。末次灌胃前8 h禁食、不禁水,灌胃2 h后予以摘眼球采血,静置后3 000 r/min 4℃离心20 min,取上清,56 ℃水浴箱灭活 30 min,0.22 μm 滤膜过滤除菌,-80℃保存。
2.2 细胞传代 HK-2细胞用含10%胎牛血清的DMEM/F12培养基培养于37℃、5%CO2的细胞培养箱中。每隔2 d换新鲜培养基1次,培养融合至80%以上,使用胰酶消化,消化后传代培养。实验前,无血清培养基饥饿培养24 h同步细胞,重复实验3次。
2.3 实验分组 收集细胞均匀接种于6孔培养板中,培养24 h后分为6组,分别为:1)空白血清对照组:HK-2细胞用DMEM/F12培养基培养,予10%生理盐水组血清培养。2)空质粒组:将空质粒(pHY106)转染至HK-2细胞,予10%生理盐水组血清培养。3)HBV组:转染HBV质粒(pHY106-HBV)的HK-2细胞,予以10%生理盐水含药血清培养。4)肾疏宁低浓度组:转染HBV质粒的HK-2细胞,予10%肾疏宁低浓度组含药血清培养。5)肾疏宁中浓度组:转染HBV质粒的HK-2细胞,予10%肾疏宁中浓度组含药血清培养。6)肾疏宁高浓度组:转染HBV质粒的HK-2细胞,予10%肾疏宁高浓度含药血清培养。含药血清干预48 h后进行检测。
2.4 质粒转染 观察6孔板中细胞,当达到60%~70%密度时,进行瞬时转染。将2 μg质粒和5 μL Lipofectamine 2000分别加入250 μL Opti-MEM 培养基中,并轻轻混合。室温下静置5 min,将两者混合,室温静置20 min。吸取原有培基,将1.5 mL新鲜DMEM/F12培养基加入每孔。空白血清对照组另加500 μL DMEM/F12 培养基; 将 500 μL lipofectamine 2000-空质粒(pHY106)复合物加入空质粒组。将500μLlipofectamine 2000-HBV质粒(pHY106-HBV)加入HBV组及肾疏宁含药血清组,注意转染时不可加入血清。6 h后换液并分别加入各组对应的含药血清继续培养。
2.5 ELISA法检测HBsAg、HBeAg的表达 按试剂盒说明采用ELISA法检测各组细胞裂解液中HBsAg、HBeAg的含量。
2.6 免疫细胞化学法检测α-平滑肌肌动蛋白(α-SMA)、E-钙黏蛋白(E-cadherin) 将细胞用4%多聚甲醛固定,并在室温下用0.3%TritonX-100处理20 min。与3%H2O2温育后,在室温下用兔血清封闭细胞30 min。然后分别加入第一抗体 α-SMA(abcam,1∶200 稀释)、E-cadherin(abcam,1∶50 稀释),在4℃下孵育细胞过夜。使用生物素标记的第二抗体在37℃下孵育1 h。在8 min DAB孵育后,用苏木精对细胞进行反染色,随后进行梯度醇脱水,二甲苯透明和树胶密封。每组3个独立样本,每个样本随机取3个视野进行拍照。采用生物医学图像分析系统(Image pro plus)进行图像分析,用平均吸光度表示阳性物质的相对含量。
2.7 Transwell法检测细胞迁徙能力 将Transwell放置于24孔板中并标号,消化细胞,种植于Transwell上室。同时取等量细胞在24孔板中培养作为细胞总量的参考。在下室加入10%胎牛血清(FBS)的培养基以形成营养梯度。培养箱中培养48 h后,去除培养基,用4%的多聚甲醛4℃过夜后取出风干,同时去除24孔板中固定的参照细胞的多聚甲醛并风干。用0.01%的结晶紫染色30 min。清洗后拍照并检测吸光度。
2.8 统计方法 应用SPSS 21.0软件进行统计分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD检验,若数据方差不齐,进行Welch’s anova检验,两两比较采用Games-Howell法进行两两比较,P<0.05表示差异有统计学意义。
3 结果
3.1 HBsAg、HBeAg的表达 空质粒组与空白血清组比较差异无统计学意义(P>0.05);HBV组与空质粒组和空白血清组比较,HBsAg、HBeAg表达上调,差异具有统计学意义(P<0.01)。见表1。
3.2 α-SMA、E-cadherin的表达
3.2.1 α-SMA蛋白的表达结果 α-SMA蛋白为上皮细胞表型转化为间充质细胞的标记蛋白,免疫细胞化学法检测α-SMA蛋白,结果如表2,图1所示,空质粒组与空白血清组比较差异无统计学意义(P>0.05);与空质粒组比较,HBV组α-SMA蛋白表达明显上调(P<0.01);与HBV组比较,肾疏宁低浓度组、肾疏宁中浓度组、肾疏宁高浓度组α-SMA蛋白表达明显下调(P<0.01)。HBV组胞质呈棕黄色,而各治疗组胞质棕黄色颗粒表现为不同程度的减少;肾疏宁各干预组组间比较,与肾疏宁高浓度组比较,肾疏宁低浓度组α-SMA蛋白表达差异无统计学意义(P>0.05);肾疏宁中浓度组 α-SMA蛋白表达相对较多(P<0.01)。

表 1 HBsAg、HBeAg 的表达(x±s)Tab.1 Expression of HBsAg,HBeAg(x±s)
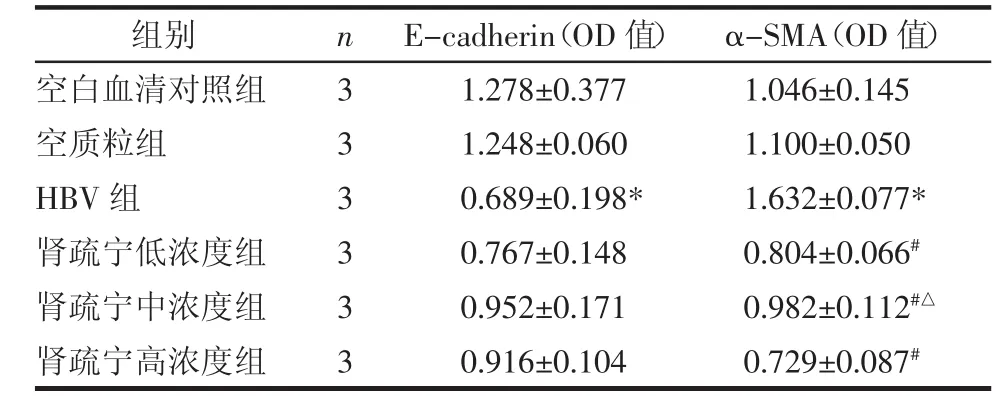
表2 各组细胞α-SMA、E-cadherin蛋白表达结果(x±s)Tab.2 Expression of α-SMA and E-cadherin proteins of cells in each group(x±s)

图1 各组α-SMA表达结果(标尺:19 μm)Fig.1 Expression of α-SMA in each group(scale bar:19 μm)
3.2.2 E-cadherin蛋白的表达结果 E-cadherin蛋白为肾小管上皮细胞间黏性连接蛋白,空质粒组与空白血清组比较差异无统计学意义(P>0.05);与空质粒组比较,HBV组E-cadherin蛋白表达下调(P<0.01);与HBV组比较,各治疗组有上调E-cadherin蛋白表达的趋势,但差异无统计学意义(P>0.05)。见表3。HBV组细胞胞浆内棕黄色颗粒减少,E-cadherin蛋白表达降低,其余治疗组较HBV组,其胞浆内棕黄色颗粒均略有增多,但增多不明显。见图2。

表3 各组细胞迁徙能力(x±s)Tab.3 Migration capacity of cells in each group(x±s)

图2 各组E-cadherin表达结果(标尺:19 μm)Fig.2 Expression of E-cadherin in each group(scale bar:19 μm)
3.3 Transwell法检测细胞迁徙能力 应用Transwell法动态观察EMT过程中细胞迁徙能力的变化,以及各治疗药物对细胞迁徙能力的抑制作用。如图3可见,空质粒组与空白血清组比较差异无统计学意义(P>0.05);HBV组与空质粒组比较,因HBV诱导HK-2细胞发生转分化发生EMT,细胞迁徙能力明显增强(P<0.01)。与HBV组比较,肾疏宁低浓度组、肾疏宁中浓度组、肾疏宁高浓度组细胞迁徙能力明显减弱(P<0.01)。肾疏宁各干预组组间比较细胞迁徙能力无明显变化,差异无统计学意义(P>0.05)。

图3 Transwell法检测各组细胞迁徙能力(标尺:25 μm)Fig.3 Migration capacity of cells detected by Transwell in each group(scale bar:25 μm)
4 讨论
中国乙型病毒性肝炎的发病人数占全球感染乙肝病毒总人数的30%[9]。HBV抗原在肾小管上皮细胞持续表达会介导免疫炎症反应,使肾小管上皮细胞发生表型转化,并向间质纤维化方向发展。
中医并无HBV-GN的病名,根据患者的临床症状和疾病的特点,可归于中医“尿浊”“尿血”“虚劳”“鼓胀”等范畴。黄文政教授在治疗肾病时,使用“三焦网络学说”作为理论指导,疗效甚佳。在治疗HBV-GN时,黄文政教授认为面对HBV-GN水肿、蛋白尿等症状,使用疏利少阳、通畅三焦的方法,调节三焦网络系统,恢复水液正常代谢。同时黄文政教授也认为HBV-GN存在湿热邪毒内蕴脏腑、病情缠绵累及脾肾的病机。所谓毒邪,即湿热、浊毒等,对于西医学而言,则为HBV侵犯人体后的有毒代谢产物、血肌酐、尿素氮等。法当解毒利湿,肝肾亏虚则应当补益脾肾,所以使用黄教授“疏利三焦”学术思想的代表方肾疏宁治疗本病,此方由柴胡、生黄芪、黄芩、丹参、鬼箭羽、山茱萸、萹蓄、白花蛇舌草、益母草组成。方中柴胡疏解少阳枢机,黄芩清解三焦郁火;黄芪补气、山茱萸养阴;白花蛇舌草、萹蓄清热利湿解毒;丹参、鬼箭羽、益母草活血化瘀通络,诸药搭配,疏利少阳,扶正祛邪。
本研究中采用的重组质粒是以中国感染患者的HBV为模板构建,拷贝的C基因型HBV的(含HBV的全基因组)pHY106-HBV,并且C基因型是中国HBV感染患者的多见基因型,具有代表性,它能在细胞内高效复制。当使用HBV质粒转染HK-2细胞时,通过ELISA检测,可以发现HBV有效的复制和表达了相应的抗原,并且通过免疫细胞化学法,也可以发现α-SMA、E-cadherin的变化,此过程中,上皮标志蛋白E-cadherin表达下调,细胞失去上皮细胞特性,细胞之间黏附能力的下降[10],而肾小管上皮细胞通过发生上皮间质转化(EMT)而转化为成纤维细胞/肌成纤维细胞,其中肌成纤维细胞的标记蛋白α-SMA蛋白表达逐渐增多。同时应用Transwell法观察发现,HBV转染增强了在HK-2细胞的迁徙能力,这无疑是上皮细胞表型以及细胞的骨架蛋白的改变,才导致了细胞迁移能力的增强。综上,HBV转染对HK-2细胞的表型转化确有影响。
而当使用肾疏宁药物干预后笔者发现,肾疏宁各浓度含药血清α-SMA蛋白的表达有明显的抑制作用,并且肾疏宁中浓度组有较好效果。遗憾的是3组药物对E-cadherin蛋白的表达虽然有一定的上调趋势,但并没有统计学意义。由此可知,肾疏宁在干预HBV-GN肾小管上皮细胞表型转化中是以抑制α-SMA为方向,达到减轻肾小管上皮细胞表型转化的目的。已有研究表明,柴胡、生黄芪等药物可抑制α-SMA[11-12],这些研究从单味药层面对中药的作用进行了阐述,间接证明了肾疏宁的有效性。同时,肾疏宁,虽然对E-cadherin蛋白的作用不明显,但其可以下调细胞的迁徙能力,这可能与中药复方的多靶点作用有关,比如基质金属蛋白酶(MMP)家族对于细胞的迁徙能力就具有重要作用[13],这也为研究者进一步研究肾疏宁的作用提供了新的方向。故本研究提示,HBV转染HK-2细胞会导致细胞转分化并增强细胞迁徙能力,而肾疏宁含药血清可以减轻由HBV导致的上皮细胞转分化并减弱其细胞迁徙能力,但其具体的机制有待进一步研究。
