盐胁迫对濒危植物夏蜡梅生长及光合生理特性的影响
2019-09-17章华婷金则新赵喆
章华婷 金则新 赵喆
摘要:以濒危植物夏蜡梅(Sinocalycanthus chinensis)幼苗为材料,研究不同浓度梯度NaCl溶液(0.15%、0.30%、0.45%、0.60%)处理90 d后对其生长和光合生理指标的影响,以分析夏蜡梅的耐盐生理机制。结果表明,(1)在盐胁迫下,夏蜡梅幼苗的株高、基径、比叶面积、根长、根表面积、根体积、根直径、根冠比、生物量均受到抑制;除0.15%盐浓度的主根长、根冠比与对照差异不显著外,其余各项指标均明显低于对照(P<0.05),0.60%盐处理的各项指标均明显低于其他3个处理(P<0.05)。(2)夏蜡梅幼苗叶片的Pn、Tr、Gs随着盐浓度的增加而下降,不同盐浓度处理与对照均差异显著(P<0.05)。叶片的Pnmax、LSP均随着盐浓度的增加而呈下降趋势,而LCP则呈增加趋势,低盐浓度处理(0.15%)与对照差异不显著,高盐浓度(0.60%)与对照差异显著。(3)叶片相对叶绿素含量随盐浓度增加而降低,不同盐浓度处理与对照差异均显著(P<0.05);0.60%盐浓度的叶绿素荧光参数(Fv/Fm、Fv/F0)均比对照显著降低。由此可见,不同浓度盐胁迫对夏蜡梅测定的各项指标均有影响,其中高盐浓度(0.60%)对夏腊梅的生长抑制最明显。
关键词:盐胁迫;夏蜡梅;生长指标;光合生理;叶绿素含量;叶绿素荧光参数
中图分类号: S685.990.1 文献标志码: A 文章编号:1002-1302(2019)07-0142-04
环境污染和人为非正当使用肥料使土壤盐渍化日益严重,已经成为制约作物生长发育和生产发展的重要非生物因素之一[1-2]。我国各种类型盐碱地的总面积为0.9亿hm2,主要分布在沿海、干旱和半干旱地区[3]。盐胁迫会对植物产生很多不利的影响,包括盐胁迫造成的渗透胁迫、离子毒害、氧化应激等,还会由于盐碱胁迫下pH值的升高对植物造成进一步的伤害[4]。例如Yang等试验证明,随着盐度和pH值的增大,苜蓿叶片中净光合速率、气孔导度和胞间CO2浓度下降[5]。薛焱等也发现,高浓度鹽会抑制濒危盐生植物长叶红砂的生长,改变植物体内渗透调节物质[6]。因此培育耐盐碱植物品种、提高植物的耐盐碱能力是缓解盐碱地对植物影响的一个有效生物措施[4]。
夏蜡梅(Sinocalycanthus chinensis)为落叶灌木,隶属于蜡梅科(Calycanthaceae)夏蜡梅属(Sinocalycanthus),是国家二级珍稀濒危保护植物,在浙江东部地区有分布,夏蜡梅花大美丽,其叶对感冒、咳嗽、气喘等具有一定的疗效,具有良好的观赏价值与应用推广价值[7]。目前模拟环境因子变化对夏蜡梅的影响已经做了一些研究,如酸雨降低了夏蜡梅的光合能力,增加了抗氧化酶[超氧化物岐化酶(SOD)、过氧化物酶(POD)]活性、丙二醛(MDA)含量和质膜透性[8]。夏蜡梅对轻度干旱有一定耐受力,中度和高度干旱对其影响较大[9],但有关盐胁迫对夏蜡梅的影响的研究报道较少。本试验采用盆栽法研究盐胁迫对夏蜡梅幼苗光合生理与生长特性的影响,旨在探讨夏蜡梅幼苗的耐盐机制,找出夏蜡梅幼苗能够承受的最大耐盐浓度,扩大夏蜡梅的生存环境,为濒危植物夏蜡梅的合理推广与利用提供参考依据。
1 材料与方法
1.1 试验材料及处理
取相似大小的一年生夏蜡梅幼苗,移栽到上口径 23.60 cm、下口径13.80 cm、高16.20 cm的花盆中,每盆装干土3.00 kg,花盆底部置托盘,每盆移植1株,浇足水分。成活后,于2017年4月8日进行盐胁迫处理,1 kg干土中的盐含量分别为0.15%、0.30%、0.45%、0.60%[10],分别代表低盐、中低盐、中盐和高盐处理,以浇等量的自来水为对照(CK)。每个处理组15个重复,为防止一次性加入盐溶液出现烧苗现象,用相应浓度的NaCl溶液分5次灌透,将渗到托盘的盐溶液倒回花盆中。每2 d浇灌1次,于2017年4月16日土壤达到相应的含盐量。处理90 d后,于2017年7月15日进行各项指标的测定。由于夏蜡梅是阴生植物,整个试验在台州学院玻璃温室中进行,采用遮阴处理,光照度为37%全光照。
1.2 测试指标及方法
1.2.1 形态参数的测定 盐处理90 d后,用直尺和游标卡尺测量株高、基径,记录植物的叶片数,参照Green等的方法[11],用蒸馏水洗净后,获取完整的根系,放置在树脂玻槽内,注水使根部充分散开,用扫描仪(Epson 1680)与WinRhizo根系分析系统扫描完整的根系图像,获得根表面积、根长、平均根直径、根体积、根尖数,并计算比根长(比根长=根长/根生物量),再用扫描仪(Epson 1680)与WinFolia叶片分析系统分析叶片图像,计算得到比叶面积(比叶面积=叶面积/叶片生物量)[12]。
1.2.2 生物量的测定 按夏蜡梅根、茎、叶不同器官采集样品,分别于105 ℃杀青30 min,在80 ℃下烘干至恒质量,测定各器官的生物量,计算得到根冠比(根冠比=地下生物量/地上生物量)[13]。
1.2.3 夏蜡梅叶片光合参数的测定 选择7月初的晴天,于09:00—11:00采用Li-6400XT便携式光合作用仪(LI-COR,USA)测定叶片的光合特性(净光合速率Pn、蒸腾速率Tr、气孔导度Gs、胞间CO2浓度Ci),设定参数如下:光合有效辐射(PAR)为1 500 μmol/(m2·s),叶室温度为25 ℃,流速控制在 500 μmol/(m2·s),相对湿度为65%,CO2浓度为 400 μmol/mol[8]。
1.2.4 光响应曲线的测定 用Li-6400XT便携式光合作用仪自带的红蓝光源,设置光照度梯度由高到低为1 500、1 200、1 000、800、600、400、200、150、100、50、20、0 μmol/(m2·s),测定夏蜡梅幼苗的光合速率。测定前用 1 500 μmol/(m2·s) 的光照度对所测叶片进行20 min的诱导。光响应测定条件设置叶室温度为25 ℃,流速控制在 500 μmol/(m2·s),相对湿度为65%[7,14]。
1.2.5 相对叶绿素含量和叶绿素荧光参数的测定[15] 选取成熟向阳面功能叶片中部进行活体测定,用CCM-200手持式叶绿素测定仪(OPTI-SCIENCES,USA)测定每个盐处理下的夏蜡梅叶片叶绿素相对含量(SPAD值),每株植物选2张叶片,在每张叶片中脉两侧选2个点,将8个点的平均值作为此株植物的相对叶绿素含量。选取与测定叶绿素含量相同的叶片,于夜晚利用OS30P便携式叶绿素荧光仪(OPTI-SCIENCES,USA)测定叶绿素荧光基本参数:初始荧光(F0),最大荧光(Fm),光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm),并计算PSⅡ潜在光化学效率(Fv/F0)。
1.3 数据分析
采用Excel对数据进行整理,用叶子飘的双曲线修正模型拟合光合数据[16]。用Origin 8.5进行绘图,不同处理之间的差异显著性采用单因素方差分析(one-way ANOVA)和最小显著性差异法(LSD)多重比较(SPSS 16.0)。
2 结果与分析
2.1 盐胁迫对夏蜡梅幼苗生长的影响
2.1.1 盐胁迫对夏蜡梅植株形态参数的影响 不同盐浓度对夏蜡梅植株形态参数的影响见表1,可见随着盐浓度的升高,株高、基径、比叶面积均呈现降低趋势,各处理组与对照相比差异均显著(P<0.05)。其中0.60%盐浓度处理对夏蜡梅植株的株高、基径、比叶面积影响最大,分别比对照降低了 64.11%、57.14%、23.25%。
2.1.2 盐胁迫对夏蜡梅幼苗根系形态参数的影响 从表2可以看出,盐胁迫抑制了夏蜡梅幼苗主根长、根平均直径、根平均体积、根表面积的生长,除0.15%盐浓度的主根长、0.15%~0.45%盐浓度的比根长与对照差异不显著外,其余各指标均差异显著(P<0.05)。随着盐浓度的增加抑制效果更加明显,其中0.60%盐浓度下主根长、根表面积、根平均直径、根平均体积分别比对照降低了69.64%、71.56%、14.81%、76.10%。而比根長随着盐浓度的增加而增加,0.60%盐浓度下的比根长比对照增加了 145.15%,且与对照及其他3个处理间差异均显著(P<0.05)。
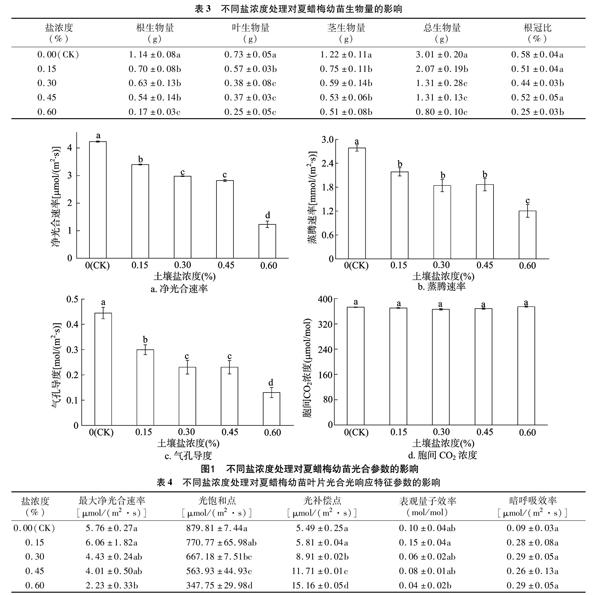
2.1.3 盐胁迫对夏蜡梅幼苗生物量的影响 由表3可见,随着盐浓度的升高,各器官及总生物量均呈现降低趋势,且不同盐浓度处理均显著低于对照(P<0.05)。就不同器官而言,根的生物量下降幅度最大,而茎的生物量下降幅度最小,其中0.60%盐浓度处理的根、叶、茎生物量分别比对照下降了 85.09%、65.75%、58.20%。总生物量与对照相比,0.15%、0.30%、0.45%、0.60%盐处理分别比对照下降了31.23%、56.48%、56.48%、73.42%。0.60%盐浓度处理的根冠比比对照降低了56.90%,差异显著(P<0.05)。
2.2 盐胁迫对夏蜡梅幼苗光合特性的影响
2.2.1 盐胁迫对夏蜡梅幼苗叶片光合参数的影响 由图1可知,随着盐浓度的增加,夏蜡梅幼苗叶片的净光合速率、蒸腾速率、气孔导度均呈明显下降趋势,不同盐浓度处理与对照相比均差异显著(P<0.05)。0.15%、0.30%、0.45%、0.60%盐浓度处理的Pn与对照相比分别下降了19.63%、29.64%、33.32%、70.88%;Tr分别下降了 21.51%、33.85%、32.96%、56.78%;Gs分别下降了 32.61%、48.20%、48.15%、70.71%。不同盐浓度处理的胞间CO2浓度与对照均无显著差异,且4个处理之间差异不显著。
2.2.2 盐胁迫对夏蜡梅幼苗叶片光合光响应参数的影响 由图2可以看出,随着光合有效幅射的增加,4种盐浓度处理以及对照的Pn均随之线性增加,当达到光饱和点(LSP)时,变化趋势趋于平缓。0.60%盐浓度与对照及其他3个处理间差异明显,对照及其他各处理组之间差异不显著。
不同盐浓度处理下夏蜡梅叶片光合光响应特征值见表4。可以看出,夏蜡梅幼苗的最大净光合速率(Pnmax)随着盐浓度的升高而下降,0.60%盐浓度处理与0.15%盐浓度组及对照之间差异均显著(P<0.05),比对照下降了61.28%;其他3个处理之间以及3个处理与对照之间均无显著差异。光饱和点随着盐浓度增加而下降,0.15%盐浓度处理与对照无显著差异,0.30%、0.45%、0.60%盐浓度下的LSP分别比对照下降了24.17%、35.90%、60.47%,均达显著差异(P<0.05)。而光补偿点(LCP)则随盐胁迫浓度的增加而增加,除0.15%盐浓度与对照无显著差异外,0.30%、0.45%、0.60%盐浓度下的LCP分别比对照增加了62.30%、113.30%、176.14%,均达显著差异(P<0.05),这3个处理之间也达显著差异(P<0.05)。表观量子效率(AQE)、暗呼吸效率(Rd)的变化规律不明显。
2.3 盐胁迫对夏蜡梅幼苗相对叶绿素含量和叶绿素荧光参数的影响
从表5可以看出,相对叶绿素含量随着盐浓度的增加而下降,0.15%、0.30%、0.45%、0.60%盐浓度处理的夏蜡梅幼苗相对叶绿素含量分别比对照下降了11.22%、15.45%、21.83%、37.44%,均达显著差异(P<0.05)。4个处理的相对叶绿素含量除0.15%与0.30%盐浓度处理之间差异不显著外,其余各处理之间均差异显著(P<0.05)。随着盐胁迫的加剧,PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学效率(Fv/F0)均呈下降的趋势。Fv/Fm、Fv/F0在0.15%、0.30%盐浓度下与对照均无显著差异;在0.45%盐浓度下均显著低于对照(P<0.05);在0.60%盐浓度胁迫下均显著低于对照及其他3个处理(P<0.05)。
3 讨论与结论
在环境胁迫下,植物会通过改变其形态和生理特性以及生活史等对策来适应环境的资源限制[17]。本研究发现,不同盐浓度处理对濒危植物夏蜡梅的生长特性有很大的影响。盐胁迫下夏蜡梅株高、基径、比叶面积、根系形态参数(根长、根体积、根表面积、根平均直径)、生物量大都显著低于对照,并且盐浓度为0.60% 时各指标受到的抑制程度最大,表明盐胁迫是影响植物生长发育的重要环境限制因子之一,会诱发植物各器官的形态结构及其相应功能的改变。而随着盐浓度的增加,造成幼苗根系有机物积累减少,生物量下降较快,使得比根长反而升高。
盐胁迫下植物的光合作用变化一直是人们研究的重点。光合速率的高低决定了植物有机物质储存的快慢,直接影响植物的生长[18]。本试验发现,随着盐浓度的加剧,夏蜡梅幼苗叶片的Pn、Tr、Gs均随之显著降低,这表明盐胁迫条件下气孔限制可能是导致夏蜡梅幼苗光合作用减弱的主要原因之一,这与李学孚等研究‘鄞红葡萄的结果[19]一致。光是植物进行光合作用必不可少的条件,植物对光利用能力的高低是植物光合速率存在差异的重要原因。本研究发现,随着光合有效幅射的增加,4种盐浓度处理以及对照的Pn均随之线性增加,当达到光饱和点时,变化趋势趋于平缓。从光合光响应参数可以看出,随着盐浓度升高,夏蜡梅幼苗叶片的Pnmax、LSP均随之下降,而光补偿点则随之增加,表明高盐胁迫使得夏蜡梅的Pnmax下降,对光能的利用范围变窄,降低了植物的光合作用能力。
叶绿素作为光合作用中光能的吸收、传递和转化的载体,在植物光合作用中起着关键的作用[20]。本试验中夏蜡梅幼苗叶片相对叶绿素含量(SPAD值)随着盐胁迫加剧而下降,各组处理与对照相比均差异显著。一方面可能是由于叶绿体色素合成酶活性降低,叶绿素合成受阻;另一方面也可能是盐胁迫引起了叶绿体功能的紊乱,或加速了叶绿素的分解和叶绿体形态结构的受损,使植物叶片内叶绿素含量减少[21]。叶绿素荧光参数在测定植物光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用[18,22]。Fv/Fm反映PSⅡ反應中心原初光能的转换效率,是反映光抑制程度的良好指标;Fv/F0可代表PSⅡ活性[23]。本研究发现,随着盐浓度的升高,Fv/Fm、Fv/F0均有不同程度的下降,且中盐和高盐处理的Fv/Fm、Fv/F0与对照差异显著,说明盐胁迫导致夏蜡梅PSⅡ的电子传递效率降低和光化学活性减弱,从而降低了叶片的光合作用。
综上所述,盐胁迫会导致夏蜡梅对光能的利用范围变窄,叶绿素含量下降,抑制光合作用电子传递链和PSⅡ光化学活性,使得夏蜡梅叶片光合作用能力减弱,导致有机物积累减少,生物量显著下降,植物根、茎、叶的生长受到抑制,尤其是在高盐浓度(0.60%)下各项指标受到的抑制更加明显。
参考文献:
[1]束红梅,郭书巧,巩元勇,等. 盐胁迫对作物根系的影响及基因工程改良[J]. 分子植物育种,2013,11(5):657-662.
[2]郭爱华. 盐胁迫对荞麦幼苗生长及结构的影响[J]. 江苏农业科学,2017,45(8):68-70.
[3]陈健妙,郑青松,刘兆普,等. 麻疯树(Jatropha curcas L.)幼苗生长和光合作用对盐胁迫的响应[J]. 生态学报,2009,29(3):1356-1365.
[4]王佺珍,刘 倩,高娅妮,等. 植物对盐碱胁迫的响应机制研究进展[J]. 生态学报,2017,37(16):5565-5577.
[5]Yang J Y,Zheng W,Tian Y,et al. Effects of various mixed salt-alkaline stresses on growth,photosynthesis,and photosynthetic pigment concentrations of Medicago ruthenica seedlings[J]. Photosynthetica,2011,49(2):275-284.
[6]薛 焱,王迎春,王同智. 濒危植物长叶红砂适应盐胁迫的生理生化机制研究[J]. 西北植物学报,2012,32(1):136-142.
[7]金则新. 夏蜡梅保护生物学[M]. 北京:科学出版社,2010:3-354.
[8]彭礼琼,金则新,王 强. 模拟酸雨对濒危物种夏蜡梅幼苗生理生态特性的影响[J]. 植物研究,2013,33(2):202-207.
[9]朱 琳,芦建国. 干旱胁迫对夏蜡梅幼苗生理特征的影响[J]. 南京林业大学学报(自然科学版),2015,39(2):179-182.
[10]宋盈颖,张饮江,李博炎,等. 盐胁迫对金森女贞生理特征的影响[J]. 上海农业学报,2016,32(2):89-93.
[11]Green J J,Baddeley J A,Cortina J,et al. Root development in the Mediterranean shrub Pistacia lentiscus as affected by nursery treatments[J]. Journal of Arid Environments,2005,61(1):1-12.
[12]Lau J A,Lennon J T. Evolutionary ecology of plant-microbe interactions:soil microbial structure alters selection on plant traits[J]. New Phytologist,2011,192(1):215-224.
[13]王穗子,金则新,李月灵,等. 铜胁迫条件下AMF对海州香薷光合色素含量、抗氧化能力和膜脂过氧化的影响[J]. 生态学报,2015,35(23):7699-7708.
[14]汪 赛,伊力塔,余树全,等. 模拟酸雨对青冈光合及叶绿素荧光参数的影响[J]. 应用生态学报,2014,25(8):2183-2192.
[15]李月灵,金则新,王 强,等. 不同生境华东野核桃光合生理特性及叶绿素荧光参数比较[J]. 浙江大学学报(理学版),2013,40(2):221-229.
[16]叶子飘. 光合作用对光和CO2响应模型的研究进展[J].植物生态学报 ,2010,34(16):727-740.
[17]Coomes D A,Grubb P J. Colonization,tolerance,competition and seed-size variation within functional groups[J]. Trends in Ecology & Evolution,2003,18(6):283-291.
[18]裴 斌,张光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5):1386-1396.
[19]李学孚,倪智敏,吴月燕,等. 盐胁迫对‘鄞红葡萄光合特性及叶片细胞结构的影响[J]. 生态学报,2015,35(13):4436-4444.
[20]姜丽丽,连秀芬,樊明寿. 细胞程序性死亡在植物适应逆境中的意义[J]. 生命科学,2005,17(3):267-270.
[21]李旭新,刘炳响,郭智涛,等. NaCl胁迫下黄连木叶片光合特性及快速叶绿素荧光诱导动力学曲线的变化[J]. 应用生态学报,2013,24(9):2479-2484.
[22]Massacci A,Nabiev S M,Pietrosanti L,et al. Response of the photosynthetic apparatus of cotton (Gossypium hirsutum) to the onset of drought stress under field conditions studied by gas-exchange analysis and chlorophyll fluorescence imaging[J]. Plant Physiology and Biochemistry,2008,46(2):189-195.
[23]趙丽英,邓西平,山 仑. 渗透胁迫对小麦幼苗叶绿素荧光参数的影响[J]. 应用生态学报,2005,16(7):1261-1264.王磊彬,陈兴望,李天宇,等. 江苏丰县地区富士苹果果实矿质元素与品质的相关性及通径分析[J]. 江苏农业科学,2019,47(7):146-151.
