西瓜幼苗在硝酸钙胁迫下生长和生理指标的变化
2019-09-17韩志平张海霞张红利
韩志平 张海霞 张红利
摘要:采用营养液水培法,研究Ca(NO3)2胁迫下小型西瓜幼苗生长、膜脂过氧化和有机渗透调节物质的变化。结果表明,随Ca(NO3)2胁迫浓度的提高,幼苗株高、茎粗、叶片数、最大叶长、最大叶宽及地上部和根系的鲜质量、干质量均明显降低;叶片光合色素含量表现出“增加—降低”的规律,质膜透性与丙二醛、抗坏血酸、脯氨酸、可溶性糖含量则明显增加。说明硝酸钙胁迫扰乱了西瓜叶片光合色素代谢,造成膜脂过氧化,破坏了细胞膜结构,导致幼苗生长严重受抑,同时植株抗氧化能力和渗透调节能力增强,从而在一定程度上减轻了盐胁迫造成的伤害。
关键词:西瓜;生长;Ca(NO3)2胁迫;膜脂过氧化;渗透调节
中图分类号: Q945.78;S651.01 文献标志码: A 文章编号:1002-1302(2019)07-0138-04
随着人们对新鲜蔬菜需求量的日益增长,我国设施蔬菜产业在近30年来迅猛发展,于2010年成为全球栽培面积和产量最大的国家[1]。但由于设施内土壤长期得不到雨水淋洗,以及作物连作和肥水管理不当等,使得盐分逐年向土壤表层积聚,造成蔬菜作物生长和产量显著降低,设施利用效率也不断下降[2]。研究表明,Ca2+和NO3-大量积累既是设施土壤次生盐渍化的主要特征,也是引起设施作物生理障碍的主导因子[3]。Ca(NO3)2浓度过高,会导致土壤水势降低,渗透压增大,细胞失水引起生理干旱,还会抑制作物对其他有益元素,如镁、钾、磷的吸收,影响生理生化的代谢过程,从而造成蔬菜作物难以立苗,阻碍了植株生长,甚至造成植株死亡[4-5]。国内外对土壤盐渍化的研究主要集中于NaCl胁迫,有关Ca(NO3)2胁迫对植物的伤害以及植物适应Ca(NO3)2胁迫的生理机制研究较少。
西瓜(Citrulus lanatus M.)是世界性的主要园艺作物,也是国内外设施栽培的主要瓜类作物。西瓜是非盐生植物,其根系对盐渍环境反应敏感,设施土壤次生盐渍化的不断加重,使西瓜的产量和品质逐年下降[6]。目前关于Ca(NO3)2胁迫对西瓜植株影响的研究报道很少。为此,本研究采用营养液水培法,研究西瓜幼苗在Ca(NO3)2胁迫下的生长变化并测定了其生理指标,为深入研究西瓜植株对Ca(NO3)2胁迫的生理和分子响应奠定基础,为设施西瓜抗盐栽培提供参考。
1 材料与方法
1.1 供试材料
试验于2015年4—5月在山西大同大学生命科学实验教学中心进行。供试材料为北京市特种蔬菜种苗公司提供的小型西瓜品种红小玉。
1.2 试验设计
取饱满一致的种子,用55 ℃温水烫种15 min后用清水浸种6 h,而后在28 ℃下避光催芽。发芽后播于石英砂基质中育苗,保持昼温18~25 ℃,夜温10~16 ℃,每天浇清水保持湿润。子叶展平后,开始浇灌0.5倍Hoaglands营养液。2叶1心时,选择整齐健壮的幼苗移栽于盛有Hoaglands营养液的35 L水槽中,通气培养(30 min/h)。3叶1心时,设置正常营养液培养(CK),含4 mmol/L Ca(NO3)2;胁迫处理共设Ca1、Ca2、Ca3、Ca4、Ca5 5个,Ca(NO3)2浓度分别为25、50、75、100、125 mmol/L。本试验对照和胁迫处理共6个,每个处理3次重复,每重复18株幼苗,完全随机排列。
1.3 指标测定
处理9 d后每个处理取8株幼苗,用常规方法测量株高、茎粗、根长、叶片数、最大叶长、最大叶宽,并称量地上部和根系的鲜质量和干质量,同时计算含水量。
取生长点下第2张完全展开叶测定各生理指标。光合色素提取参照沈伟其的方法[7]并略加改进,打孔取叶圆片置于乙醇丙酮混合液中,暗提取完全变白后测定D440 nm、D645 nm、D663 nm,按王素平等的公式[8]计算叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)含量。丙二醛(MDA)含量测定参照文献[9],质膜透性测定用电导仪[10],抗坏血酸(AsA)含量测定参照文献[11];脯氨酸含量测定用茚三酮法[12],可溶性糖含量测定用蒽酮法[10]。125 mmol/L Ca(NO3)2胁迫的幼苗,第4天开始死苗,第9天死苗率超过50%,故未测定生理指标。
数据用SPSS软件进行方差分析,用Excel软件作图。
2 结果与分析
2.1 Ca(NO3)2胁迫下西瓜幼苗生长的变化
2.1.1 形态指标 表1中的数据显示,除茎粗和根长在 25 mmol/L Ca(NO3)2胁迫下、叶片数在25、50 mmol/L Ca(NO3)2胁迫下与CK无显著差异外,其他各形态指标均随Ca(NO3)2浓度的提高而降低,且与CK差异显著。在 100 mmol/L Ca(NO3)2胁迫下,株高、茎粗、根长、叶片数、最大叶长、最大叶宽分别比CK降低57.34%、15.92%、31.83%、38.23%、27.89%、31.66%;在125 mmol/L Ca(NO3)2 胁迫下,株高、茎粗、根长、叶片数、最大叶长、最大叶宽分别比CK降低61.30%、20.40%、46.33%、43.60%、37.61%、35.47%。说明Ca(NO3)2胁迫显著抑制了西瓜幼苗的形态建成,且随Ca(NO3)2浓度增大,抑制作用明显增大。
2.1.2 生物量和含水量 由表2可知,除地上部含水量和根系鲜质量在25、50 mmol/L Ca(NO3)2胁迫下、根系含水量在 100 mmol/L Ca(NO3)2胁迫下与CK无显著差异外,地上部和根系的鲜质量、干质量和含水量均随Ca(NO3)2浓度提高而降低,且与CK差异显著。地上部鲜质量、干质量、含水量在100 mmol/L Ca(NO3)2胁迫下,分别比CK降低49.82%、25.85%、5.55%;在125 mmol/L Ca(NO3)2胁迫下,分别比CK降低62.08%、36.10%、7.82%。根系鲜质量、干质量、含水量在100 mmol/L Ca(NO3)2胁迫下,分别比CK降低45.45%、38.79%、0.78%;在125 mmol/L Ca(NO3)2胁迫下,分别比CK降低67.57%、57.17%、2.19%。说明Ca(NO3)2胁迫显著抑制了西瓜幼苗的生物量积累,且隨Ca(NO3)2浓度增大,抑制程度明显增大,且对地上部含水量的抑制程度明显大于根系。
2.2 Ca(NO3)2胁迫下西瓜幼苗光合色素含量的变化
图1显示,叶片叶绿素a、叶绿素b和类胡萝卜素含量均随Ca(NO3)2浓度的提高表现为“升高—降低”的规律,在 75 mmol/L Ca(NO3)2处理下达到最高值。在25、100 mmol/L Ca(NO3)2处理下,叶绿素b和类胡卜素含量与CK均无显著差异;在50 mmol/L Ca(NO3)2处理下,叶绿素a和类胡卜素含量显著高于CK;在75 mmol/L Ca(NO3)2胁迫下,各光合色素含量均显著高于CK。叶绿素a、叶绿素b和类胡萝卜素含量在 50 mmol/L Ca(NO3)2胁迫下,分别比CK增加27.03%、11.88%、18.94%;在75 mmol/L Ca(NO3)2胁迫下,分别比CK增加、33.64%、18.94%、27.22%;在100 mmol/L Ca(NO3)2 胁迫下,分别比CK增加16.59%、4.48%、12.21%。说明Ca(NO3)2胁迫导致西瓜幼苗光合色素代谢紊乱,使其含量随Ca(NO3)2浓度的提高而发生明显波动。
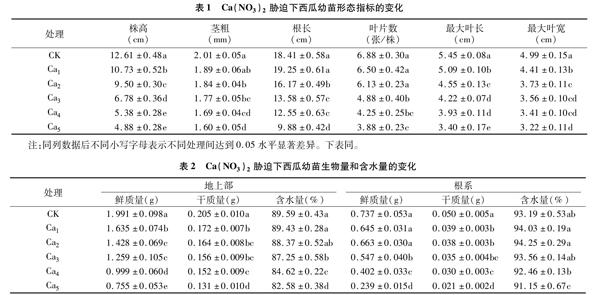
2.3 Ca(NO3)2胁迫下西瓜幼苗膜质过氧化的变化
由图2可知,除MDA含量在25 mmol/L Ca(NO3)2处理下与CK无显著差异外,叶片MDA含量、相对电导率和抗坏血酸含量均随Ca(NO3)2浓度提高而明显增加,与CK差异显著。MDA含量、相对电导率和抗坏血酸含量在75 mmol/L Ca(NO3)2胁迫下,分别比CK增加42.30%、49.10%、81.79%;在100 mmol/L Ca(NO3)2胁迫下,分别比CK增加67.09%、70.63%、101.52%。说明Ca(NO3)2胁迫对西瓜幼苗造成了过氧化伤害,细胞膜结构被严重破坏,胞内电解质大量外渗,且随Ca(NO3)2浓度提高,膜质过氧化伤害程度加剧;同时抗坏血酸含量显著增加,有利于增强Ca(NO3)2胁迫下幼苗的抗氧化能力。
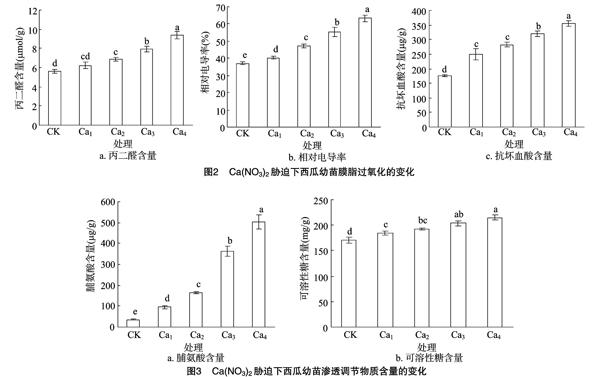
2.4 Ca(NO3)2胁迫下西瓜幼苗有机渗透调节物质含量的变化
由图3可以看出,叶片脯氨酸和可溶性糖含量均随 Ca(NO3)2 浓度提高而明显增加, 与CK差异显著, 且脯氨酸含量的增加幅度远大于可溶性糖含量。脯氨酸、可溶性糖含量在 75 mmol/L Ca(NO3)2胁迫下,分别比CK增加933.78%、19.50%;在100 mmol/L Ca(NO3)2胁迫下,分别比CK增加 1 339.41%、26.14%。说明Ca(NO3)2胁迫促进了西瓜幼苗体内脯氨酸和可溶性糖的合成和积累,这些物质的积累有利于提高植株的渗透调节能力,减轻渗透胁迫对幼苗的伤害。
3 讨论与结论
由于盐胁迫可引发渗透胁迫、离子毒害、矿质营养缺乏和过氧化伤害等次生胁迫,非盐生植物在盐渍环境下生长会受到严重抑制[13-14]。本研究中,Ca(NO3)2胁迫下西瓜幼苗的生长受到了显著抑制,75 mmol/L Ca(NO3)2胁迫下幼苗生长显著降低,但仍能维持生长发育;100 mmol/L Ca(NO3)2胁迫下植株萎蔫、濒临死亡;125 mmol/L Ca(NO3)2胁迫下幼苗死亡率超过50%。结合生长和生理指标的变化,75 mmol/L是西瓜幼苗对Ca(NO3)2胁迫耐受性的阈值浓度。
环境因子的改变会引起光合色素含量的变化,最终影响到作物的生长、产量和品质[15]。许多研究表明,盐胁迫抑制了光合色素的合成,促进其分解,导致其含量显著降低[16-17]。但也有报道表明,盐胁迫下叶片光合色素含量增加[8,18]。本试验中,叶片光合色素含量随Ca(NO3)2浓度提高呈“增加—降低”的规律,在75 mmol/L Ca(NO3)2处理下达到最大值,在 125 mmol/L Ca(NO3)2处理下观察到存活的幼苗叶片小而枯黄。结合形态指标和前人的研究,推测50 mmol/L Ca(NO3)2以下浓度生长降低幅度很小而叶绿素含量增加是由于幼苗对Ca2+和N的吸收促进了叶绿素的合成;75 mmol/L Ca(NO3)2处理下叶绿素含量增加是由于盐胁迫下叶片生长缓慢,导致叶绿体收缩,产生了“浓缩”效应[19];在100 mmol/L Ca(NO3)2 胁迫下叶绿素含量仍高于对照,则是由于叶绿素酶活性提高,同时叶绿素与叶绿体蛋白间的结合变得松弛,使其易于提取,导致测得的含量增加[20]。
盐胁迫导致细胞内活性氧大量产生,造成植物的原初伤害——膜脂中不饱和脂肪酸的过氧化,导致其终产物MDA含量和质膜透性显著增加[19,21]。这种情况诱导细胞内保护酶活性和非酶抗氧化剂含量增加,从而减轻或消除活性氧对膜脂的伤害[14]。抗坏血酸是植物体内天然的非酶抗氧化剂,能够在抗坏血酸过氧化物酶催化下将H2O2分解成H2O[21-22]。本研究中,随Ca(NO3)2浓度的提高,西瓜幼苗MDA含量、质膜透性和抗坏血酸含量显著增加。说明 Ca(NO3)2 胁迫下细胞内自由基大量生成,造成膜脂过氧化加剧,细胞膜结构被严重破坏,同时诱导幼苗抗氧化能力增强,以清除大量产生的活性氧,有助于部分缓解Ca(NO3)2胁迫对幼苗的过氧化伤害。
盐胁迫对植物伤害的原因之一是渗透胁迫造成细胞水分的亏缺。植物为维持正常的生理代谢,需要通过渗透调节降低细胞水势,促进细胞吸收外界水分[23]。非盐生植物在盐胁迫下可通过大量合成和积累脯氨酸、可溶性糖、甜菜碱等小分子溶质,降低细胞渗透势,促进细胞吸收水分,维持胞质溶胶与环境的渗透平衡,同时缓解活性氧对细胞的过氧化伤害,保证膜结构的稳定性和完整性[14,21,24-25]。本试验中,幼苗脯氨酸和可溶性糖含量均随Ca(NO3)2浓度提高而显著增加,说明Ca(NO3)2胁迫下植株的渗透调节能力增强,且脯氨酸在渗透调节中的贡献大于可溶性糖,這是西瓜植株对盐胁迫的一种适应性反应,有利于增强植株对盐胁迫的抵抗能力。
总之,Ca(NO3)2胁迫下西瓜幼苗光合色素代谢紊乱、膜脂过氧化加剧,使植株生长严重受抑,同时细胞抗氧化能力和渗透调节能力增强,在一定程度上减轻了盐胁迫造成的伤害。在设施西瓜生产中,除了培育耐盐西瓜品种、合理施肥灌水等措施外,还可通过转基因、施用外源物质等方法提高植株的抗氧化或渗透调节能力,从而保证其正常的生长发育。
参考文献:
[1]张真和,马兆红. 我国设施蔬菜产业概况与“十三五”发展重点——中国蔬菜协会副会长张真和访谈录[J]. 中国蔬菜,2017(5):1-5.
[2]陈绍荣,邵建华,王喜江,等. 我国土壤盐渍化的综合治理[J]. 化肥工业,2013,40(5):65-69.
[3]杨春霞,张 艳,李彩虹,等. 宁夏设施土壤盐分离子组成及含量变化特点[J]. 西北农业学报,2014,23(1):201-206.
[4]王 敏,王秀峰,夏燕飞,等. 硝酸盐胁迫下外源脱落酸对黄瓜幼苗生长及抗氧化酶活力的影响[J]. 山东农业科学,2012,44(3):21-24,28.
[5]Sun Y D,Luo W R,Li X Z,et al. Effects of Ca(NO3)2 stress on the growth and physiological indexes of cucumber seedlings[C]. International Conference on Environmental Science and Information Application Technology,2009:268-271.
[6]张振贤. 蔬菜栽培学[M]. 北京:中国农业大学出版社,2003:176-185.
[7]沈伟其. 测定水稻叶片叶绿素含量的混合液提取法[J]. 植物生理学通讯,1988(3):62-64.
[8]王素平,郭世荣,胡晓辉,等. 盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J]. 江西农业大学学报,2006,28(1):32-38.
[9]Rao K M,Sresty T S. Antioxidative parameters in the seedlings of pigeonpea (Cajanus cajan L. Millspaugh) in response to Zn and Ni stresses[J]. Plant Science,2000,157(1):113-128.
[10]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:208-210.
[11]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M]. 北京:科学出版社,1999:315-316.
[12]蔡庆生. 植物生理学实验[M]. 北京:中国农业大学出版社,2013:175-177.
[13]Yeo A. Molecular biology of salt tolerance in the context of whole-plant physiology[J]. Journal of Experimental Botany,1998,49(323):915-929.
[14]Parida A K,Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[15]张其德. 盐胁迫对植物及其光合作用的影响(中)[J]. 植物杂志,2000(1):28-29.
[16]Zhang R H,Li J,Guo S R,et al. Effects of exogenous putrescine on gas-exchange characteristics and chlorophyll fluorescence of NaCl-stressed cucumber seedlings[J]. Photosynthesis Research,2009,100(3):155-162.
[17]魏国强,朱祝军,方学智,等. NaCl胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响[J]. 中国农业科学,2004,37(11):1754-1759.
[18]韩志平,张海霞,李林霞,等. 硝酸钙胁迫对南瓜幼苗生长和膜脂过氧化的影响[J]. 河南农业科学,2015,44(5):117-120.
[19]赵可夫. 植物抗盐生理[M]. 北京:中国科学技术出版社,1993:230-231.
[20]Strogonov B P. Structure and function of plant cell in saline habitats[M]. New York:Halsted Press,1973:78-83.
[21]陈晓亚,汤章城. 植物生理与分子生物学[M]. 3版.北京:高等教育出版社,2007:533-551.
[22]江绪文,李贺勤,王建华. 盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应[J]. 植物生理学报,2015,51(2):166-170.
[23]Munns R. Comparative physiology of salt and water stress[J]. Plant,Cell & Environment,2002,25(2):239-250.
[24]Ashraf M,Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany,2007,59(2):206-216.
[25]陈阳春,张本厚,贾明良,等. 盐胁迫对半夏组培苗生长及生理指标的影响[J]. 江苏农业科学,2014,42(12):62-66.章华婷,金则新,赵 喆,等. 盐胁迫对濒危植物夏蠟梅生长及光合生理特性的影响[J]. 江苏农业科学,2019,47(7):142-146.
