二维Ti2CO2单层吸附H2S分子的第一性原理研究
2019-09-17王怡然王丽芳袁东玉孔月月马淑红
王怡然, 王丽芳, 袁东玉, 孔月月, 马淑红
(河南师范大学物理与材料科学学院, 新乡 453007)
1 引 言
从工业生产和生活污水中释放的硫化氢(H2S)是一种腐蚀性气体污染物,有剧毒可爆炸. 在工业生产中,H2S气体会腐蚀设备导致样品泄露,从而造成巨大损失. 此外,硫化氢还是一种剧烈的神经毒物,给人类的身体健康带来巨大危害. 因此,近年来,研究人员一直在努力探索室温下灵敏度高、选择性好的气敏传感材料能对环境中有毒有害气体进行有效的监测,并实现气体的捕集或释放[1-3].
近年来,二维层状纳米材料因其较大的比表面积、较高的载流子迁移率、独特的电子结构等优异性能而倍受学者的关注[4-6]. 其中,二维层状MXenes又由于层间距可调、官能团种类多、电子结构丰富等优点,在重金属离子吸附净化和气敏传感材料等方面具有良好的应用前景[5-12]. Yu等人的理论研究[1]表明M2CO2(M = Sc,Hf,Zr,Ti)可以作为NH3气体传感器的一种具有高选择性和灵敏性优良材料[7];并且我们组也基于第一性原理计算方法预测到Sc2CO2对SO2气体具有高选择性和敏感性,外加应变和电场等方法可以有效地调制其性能,进而实现气体的捕集与释放等[2]. 另外,现有研究还报道:不同的官能团(主要有O,OH,F)对二维MXenes性能的影响也不同[8,9],并且表面结构如空位、异质原子掺杂等对分子的吸附性质和催化性能也有较大的改变[10-12]. 目前,理论和实验研究发现:二维层状材料对NH3、SO2、和NO2等气体具有良好的气敏特性,然而关于H2S气体在层状纳米材料表面吸附性质的研究鲜见报道[13]. 因此,本文采用第一性原理计算方法,针对H2S气体在MXenes表面吸附性质,以及表面官能团、水分子、以及氧官能团空位、过渡金属替代掺杂这些因素对其吸附性质的影响进行计算研究.
2 计算方法
本文采用基于密度泛函理论的第一性原理VASP软件包进行模拟计算. 我们采用PAW赝势来描述芯电子-离子实间相互作用,广义梯度近似(GGA)下的Perdew-Burke-Ernzerhof (PBE)泛函来描述电子间的交换-关联相互作用[14-16]. 体系的周期性结构:选择3×3×1的超胞来模拟单层Ti2CO2,并在z方向上添加了20 Å的真空层. 计算参数设置;平面波展开截断能为500 eV,几何结构优化和电子结构计算时选用的k点网格分别为5×5×1和15×15×1,几何结构优化均采用共轭梯度法完全松弛,优化时采用的能量和力的收敛精度分别为10-5eV和0.01 eV/Å,同时采用DFT-D2类型的范德瓦尔斯修正来描述衬底和气体分子间长程相互作用[17]. 此外,计算测试表明H2S吸附的单层Ti2CO2具有磁性,因此在计算中考虑了体系的自旋极化效应.
气体分子的吸附能(Eads)定义为:Eads=EM2CO2+Gas-EM2CO2-EGas,其中EM2CO2+Gas、EM2CO2、EGas分别代表有、无气体分子吸附时的单层Ti2CO2的总能量和自由气体分子的能量. 吸附体系的差分电荷密度由△ρ=ρM2CO2+Gas-ρM2CO2-ρGas而得到,其中ρM2CO2、ρM2CO2+Gas、ρGas分别代表气体吸附前、后单层Ti2CO2与单个气体分子的电荷密度,它们是在气体吸附后体系的空间格子中计算的.
3 结果与讨论
3.1 H2S分子在单层Ti2CO2表面上的吸附
首先,结构优化得到的单层Ti2CO2晶格常数为3.04 Å,电子结构计算的半导体间接带隙值是0.27 eV;自由H2S分子的键长和键角分别为1.349 Å和91.9°,这些参数与之前报道的结果符合一致[18].
为得到H2S气体最稳定的吸附结构,我们不仅测试了单层Ti2CO2上高对称性吸附位点,如Ti原子或O原子的正上方顶位(Top),O-Ti键、Ti-Ti键的桥位(Bridge),以及由三个氧或钛原子组成的中心空位(Hollow);而且还针对同一个吸附位置吸附物分子的吸附构型(如分子平面平行或垂直于衬底表面,分子呈现Λ或V型)进行测试,优化后的最稳定吸附结构、电子结构态密度(DOS)和能带结构、如图1所示. 由图1得知:吸附的H2S的S原子位于Ti原子顶位,S-H键分别指向近邻的两个氧原子,分子平面与衬底几乎垂直,吸附高度约2.35 Å,吸附能较小为-0.15 eV,与水分子在其上吸附强度相当[7];吸附后H2S的键长与键角分别是1.35 Å和91.48°;Bader电荷分析表明从H2S分子转移到Ti2CO2上电荷可以忽略(0.02 e);吸附后体系的电子态密度(PDOS)和能带结构与吸附前衬底相比,几乎没有变化. 这些结果表明该吸附较弱为物理吸附,这与理论报道的H2S在其它二维层状AsP (-0.144 eV)[19]、硅烯(-0.19 eV)[20]和GeSe(-0.208 eV)[21]吸附强度接近,弱于其在锡烯上吸附强度(-0.471 eV)[22].
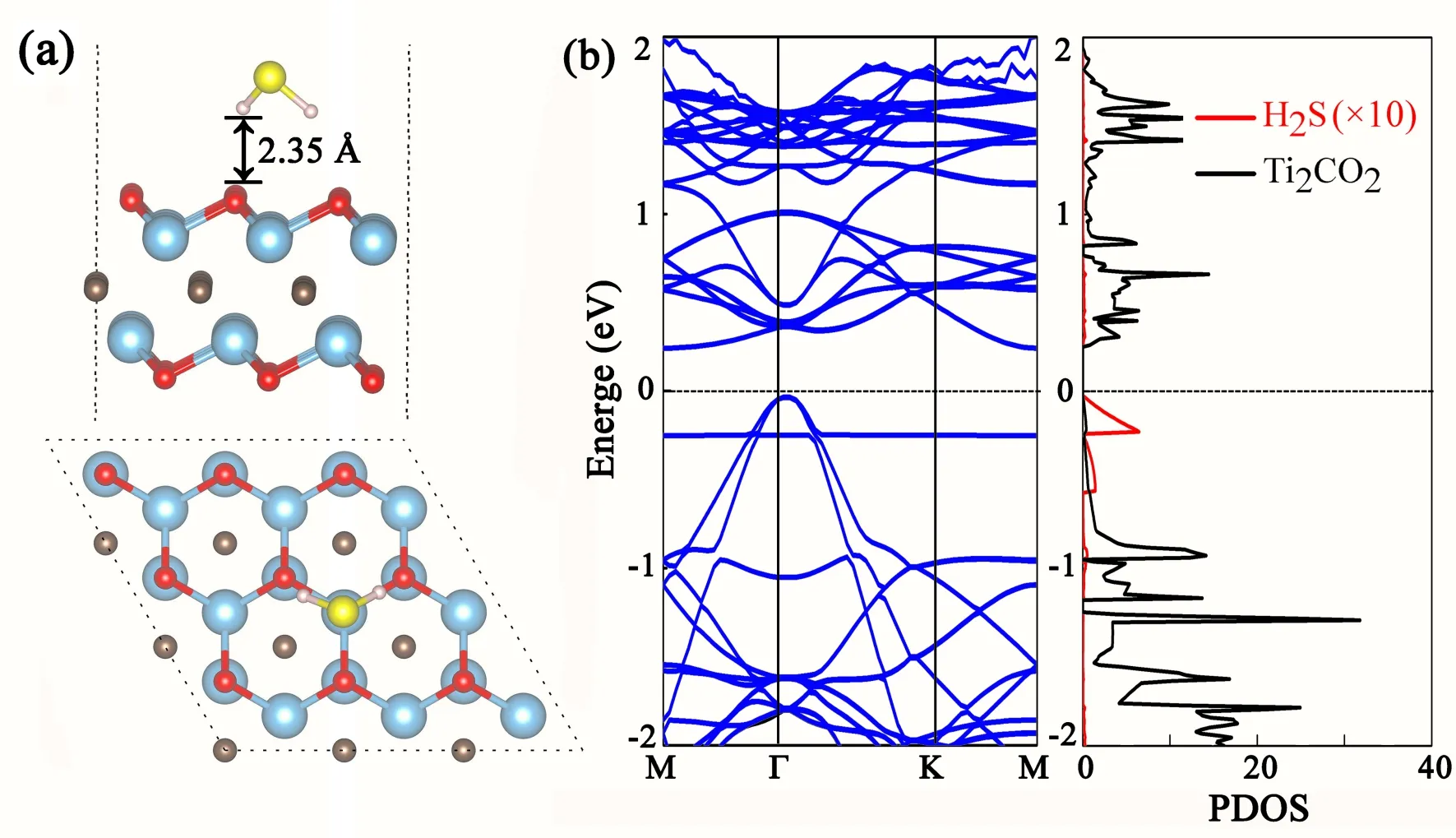
图1 H2S吸附在Ti2CO2上的几何结构(a)、电子态密度(DOS)和能带结构(b)Fig. 1 The geometric configuration (a), electronic band structure and PDOS (b) for H2S adsorbed on monolayer Ti2CO2. (The Fermi energy level is set at zero)
3.2 外加应变和电场对H2S分子吸附性质的调制
据文献报道,外加应变和电场可以有效地调节二维材料的电子结构和气敏特性[2,23]. 因此,这里也就外加双轴拉伸应变和垂直于衬底的外电场对H2S分子在Ti2CO2上吸附性质的影响进行了研究,吸附能和电荷转移计算结果如图2所示.
结果表明:吸附能和分子与衬底表面的电荷转移随拉伸应变的增加而变化不明显,即在0~5%应变范围内,H2S的束缚能(吸附能的绝对值)低于0.20 eV,相应的电荷转移量非常少,这说明二者间相互作用较弱,这与水分子在Ti2CO2上吸附强度随应变的变化情况类似[7]. 另外,H2S分子在Ti2CO2上吸附强度随外加电场强度的增加而明显增强,当场强由零增至0.5 V/Å时,束缚能接近0.55 eV;并且电荷转移量明显依赖于电场的方向和强度. 因此,外加电场可以调制H2S分子在Ti2CO2上吸附强弱,从而实现Ti2CO2对H2S气体可控的捕集与释放.
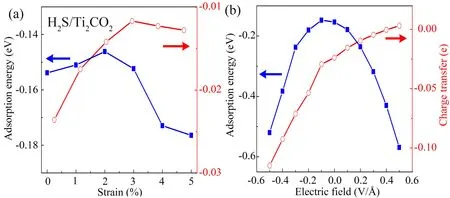
图2 H2S在Ti2CO2上的吸附能(■)和电荷转移(○)随外加应变(a)和电场(b)的变化(负的电荷转移表明H2S分子失电子而衬底得电子)Fig. 2 Variations of the calculated adsorption energy (■), charge transfer (○) as a function of external biaxial strain (a) and electric-field (b) for H2S-adsorbed Ti2CO2 monolayer.
3.3 单层Ti2CO2表面不同结构对H2S分子吸附的影响
3.3.1表面水分子修饰
现有的理论和实验研究都表明:水分子对气体分子的吸附有一定的影响[5, 24]. 因此,我们先计算了水分子在单层Ti2CO2上的吸附强度,计算结果(见表1)表明:水分子的吸附能与H2S的接近,约-0.16 eV;且随着水分数的增加,其吸附强度几乎不变,当水分子数为3时,其平均吸附能为-0.19 eV. 其次,H2S分子在水分子覆盖的Ti2CO2上的吸附结构和吸附能如图3所示,该结果表明:水分子的存在明显促进H2S分子的吸附,且束缚能随着水分子数目由1增至3而自0.31 eV增大到0.55 eV. H2S分子的吸附构型也随着水分子数目的增多而有所改变,其吸附高度增加(当n=1,2,3时,分别为3.24,3.36 和 3.37 Å),其中S-H键长基本不变,平均为1.36 Å;S-H-S键角增大(当n=1,2,3时,分别为91.34°,93.13°和93.49°).
3.3.2表面官能团掺杂
在二维材料MXenes制备过程中,其表面官能团难免存在缺陷位. 因此,这里也针对表面官能团OH和F掺杂对H2S分子吸附性质的影响进行了计算,结果如图4和表1所示. 当单层Ti2CO2一个O原子被OH取代时,H2S分子中的S原子吸附于Ti原子顶位,吸附高度约2.98 Å,吸附强度增加,吸附能达-0.49 eV;当OH数目增至2时(OH掺杂浓度为0.22 ML),H2S分子最稳定吸附位是Ti原子组成的空位,其吸附能几乎不变;当表面层氧原子完全由OH替代时,H2S分子最稳定吸附位置紧邻OH,且分子平面几乎与衬底平行,吸附减弱,吸附能降为-0.25 eV. 这表明单层Ti2CO2表面个别羟基存在促进H2S分子的吸附.
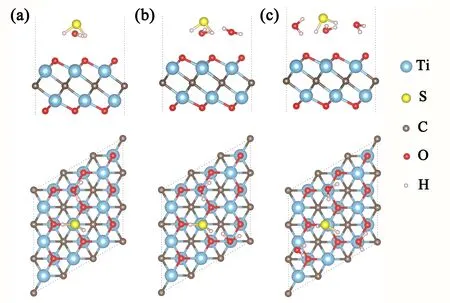
图3 H2S分子在水分子修饰Ti2CO2表面的吸附结构图 (a, b, c:水分子数分别为1, 2, 3) Fig. 3 Top and side views for H2S adsorbing configurations on Ti2CO2 decorated with H2O moleculers. (a, b, c represents the number of H2O moleculers increasing from 1 to 3, respectively).
表1 H2S分子在不同Ti2CO2表面上的吸附能(Eads)、吸附高度(H)、以及吸附时键长与键角
Table 1 Calculated results for H2S adsorbed on different Ti2CO2substrates. Adsorption energy (Eads), adsorption height (H), bond length and bond angle of H2S (ndenotes the number)
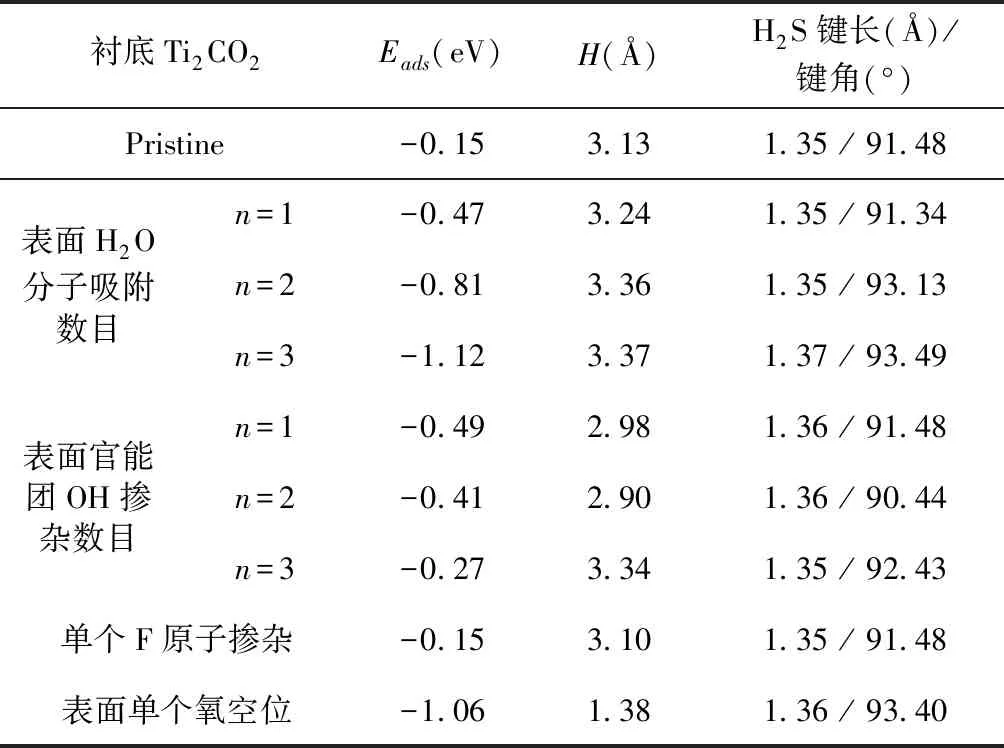
衬底Ti2CO2 Eads(eV) H(Å)H2S键长(Å)/键角(°)Pristine-0.153.131.35 / 91.48 表面H2O分子吸附数目n=1-0.473.241.35 / 91.34 n=2-0.813.361.35 / 93.13 n=3-1.123.371.37 / 93.49 表面官能团OH掺杂数目n=1-0.492.981.36 / 91.48 n=2-0.412.901.36 / 90.44 n=3-0.273.341.35 / 92.43 单个F原子掺杂-0.153.101.35 / 91.48 表面单个氧空位-1.061.381.36 / 93.40
其次,F官能团替代掺杂计算结果表明:与Ti2CO2相比,单个F原子或表面一层F原子替代掺杂都对H2S分子的吸附强度几乎没有影响,吸附位置在Ti原子的顶位,吸附高度分别增至3.10和3.12 Å,分子吸附构型几乎相同. 另外,我们还测试了F和OH同时替代二个相邻氧原子的Ti2CO2表面上H2S分子吸附,发现S原子位于F和OH最近邻Ti原子偏上方,吸附高度为3.05 Å,吸附能增至-0.49 eV,与一个OH替代掺杂情况相似,这也证明官能团F对H2S分子在单层Ti2CO2上吸附的影响可以忽略.
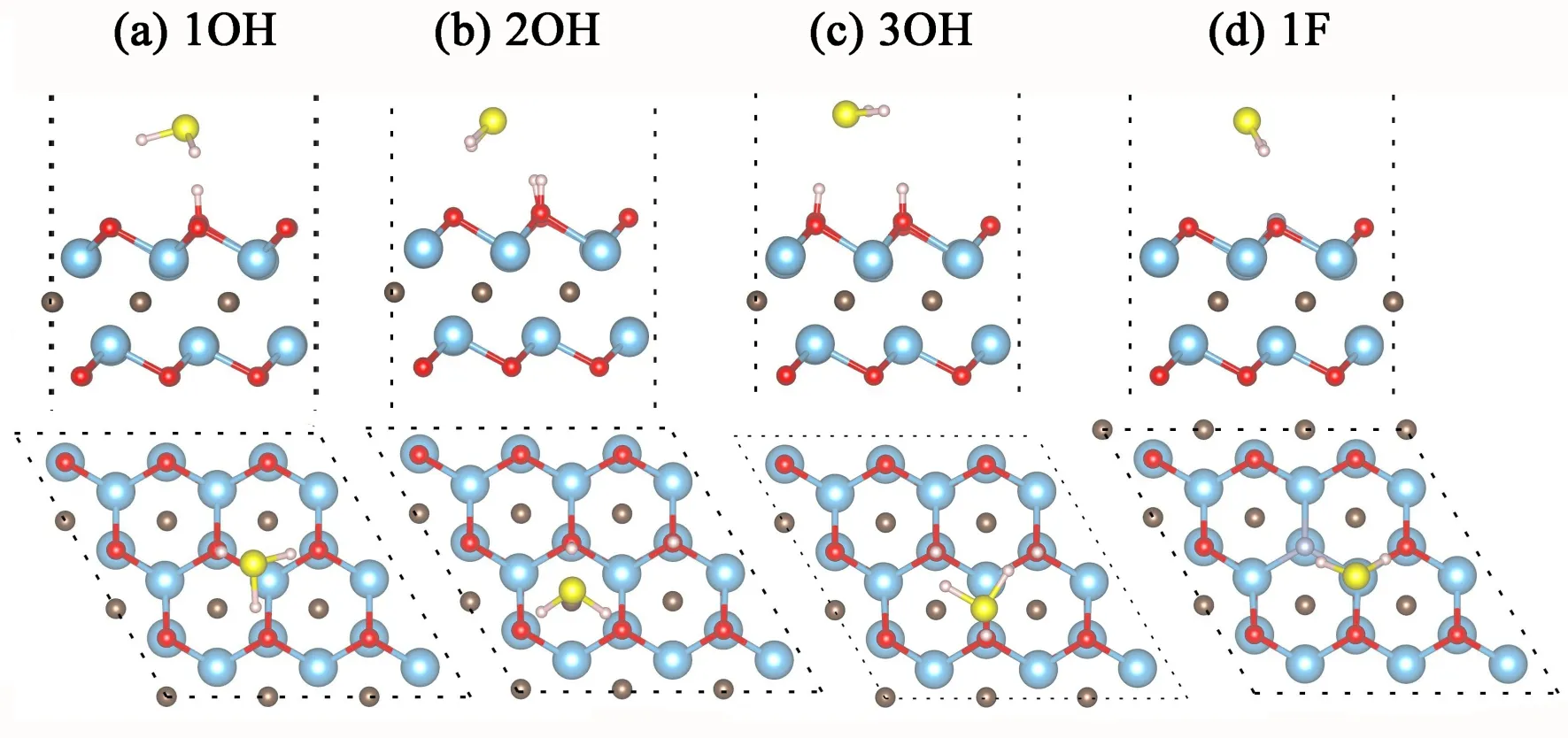
图4 H2S分子在官能团掺杂Ti2CO2表面上的吸附结构的侧视和俯视图(a-d:一个、两个、三个OH、一个F原子替代O掺杂) Fig. 4 Top and side views for H2S adsorbing configurations on Ti2CO2 doped with OH, F funcitional groups. (a-d denotes the doping of one, two, three OH, and one F functional groups in monolayer Ti2CO2)
3.3.3表面氧空位
已有研究报道:Ti2CO2表面氧空位是催化反应的活性位点,能明显降低CO2还原反应势垒[25]. 因此,这里又进一步考虑Ti2CO2表面单个氧空位对其上H2S吸附性质的影响. 如图5计算结果所示,H2S分子趋于吸附在氧空位处,分子平面平行于衬底,吸附高度为1.38 Å,S原子与紧邻Ti原子垂直距离减少为2.46 Å,吸附能增加至-1.06 eV(见表1),这表明氧空位存在的Ti2CO2(O_Ti2CO2)与H2S分子间属于较强的化学吸附. 同时还发现:吸附的H2S分子H-S-H键角由91.9°增大到93.4°,H-S键的键长为1.36 Å,Ti-C键长稍增加至2.182 Å. 其次,图5中投影电子态密度(PDOS)表明:H2S分子与氧空位存在的Ti2CO2衬底间杂化态主要分布在费米能级-1.5 eV以下和费米能级以上1.0 ~1.7 eV能量区间,二者间具有较明显的电荷转移,Bader电荷分析显示H2S分子失去0.092 e电子. 另外,H2S分子吸附在氧空位存在Ti2CO2体系呈金属性,与其在原始Ti2CO2衬底上吸附呈现半导体特征明显不同. 图6的电子结构结果显示:氧空位存在的Ti2CO2单层费米能级处主要是O-2p和Ti-3d态间杂化而呈现金属性,与完整的Ti2CO2单层相比,导带更局域化且向费米能级移动. 综上所述,氧空位存在Ti2CO2单层能实现H2S分子的捕集.
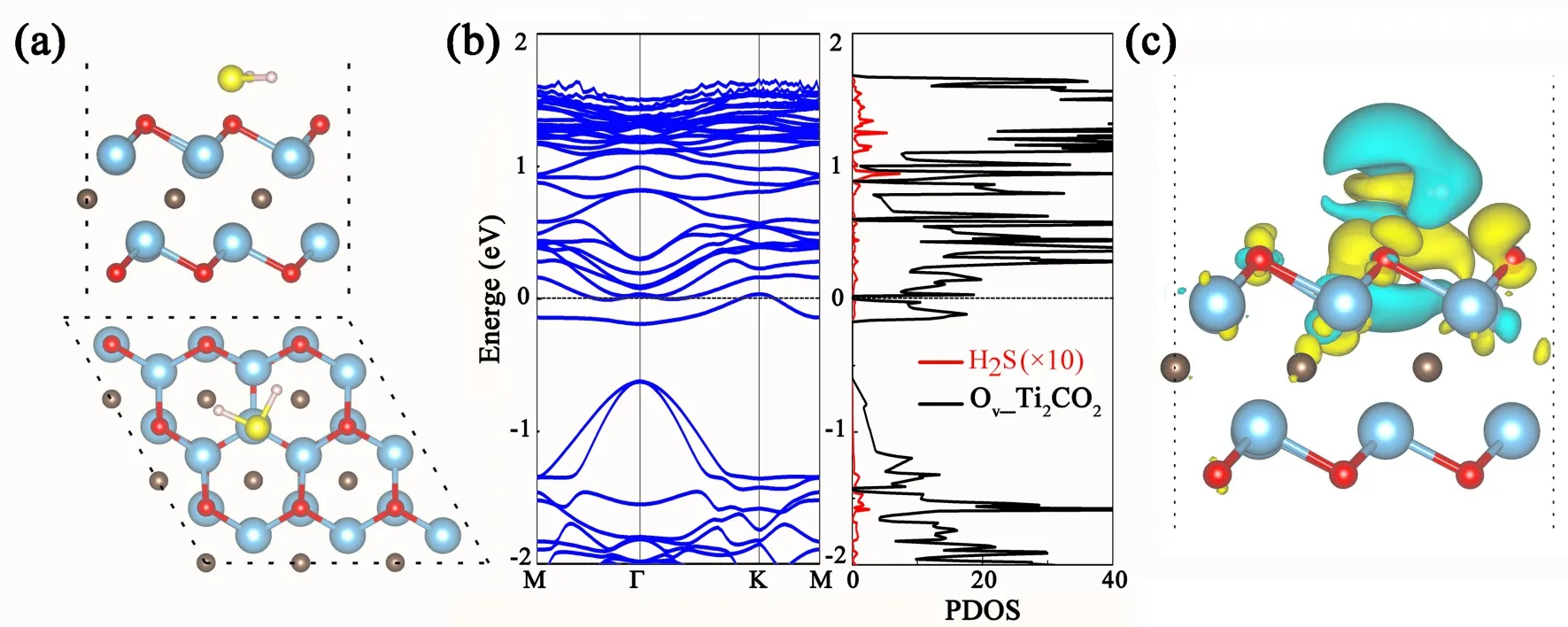
图5 H2S分子在氧空位Ti2CO2表面上吸附几何构型、能带和电子态密度(PDOS)、电荷密度差分(图中蓝色/黄色区域表示电子损失/聚集,单位:0.001 e/Å3)Fig. 5 The geometric structures (a), electronic band structure and PDOS (b) and charge density difference (c) for H2S adsorbed on Ov_Ti2CO2. (The Fermi energy level is set at zero, and blue/yellow region represents the charge depletion/accumulation with the isosurface value of 0.001 e/Å3 in c)
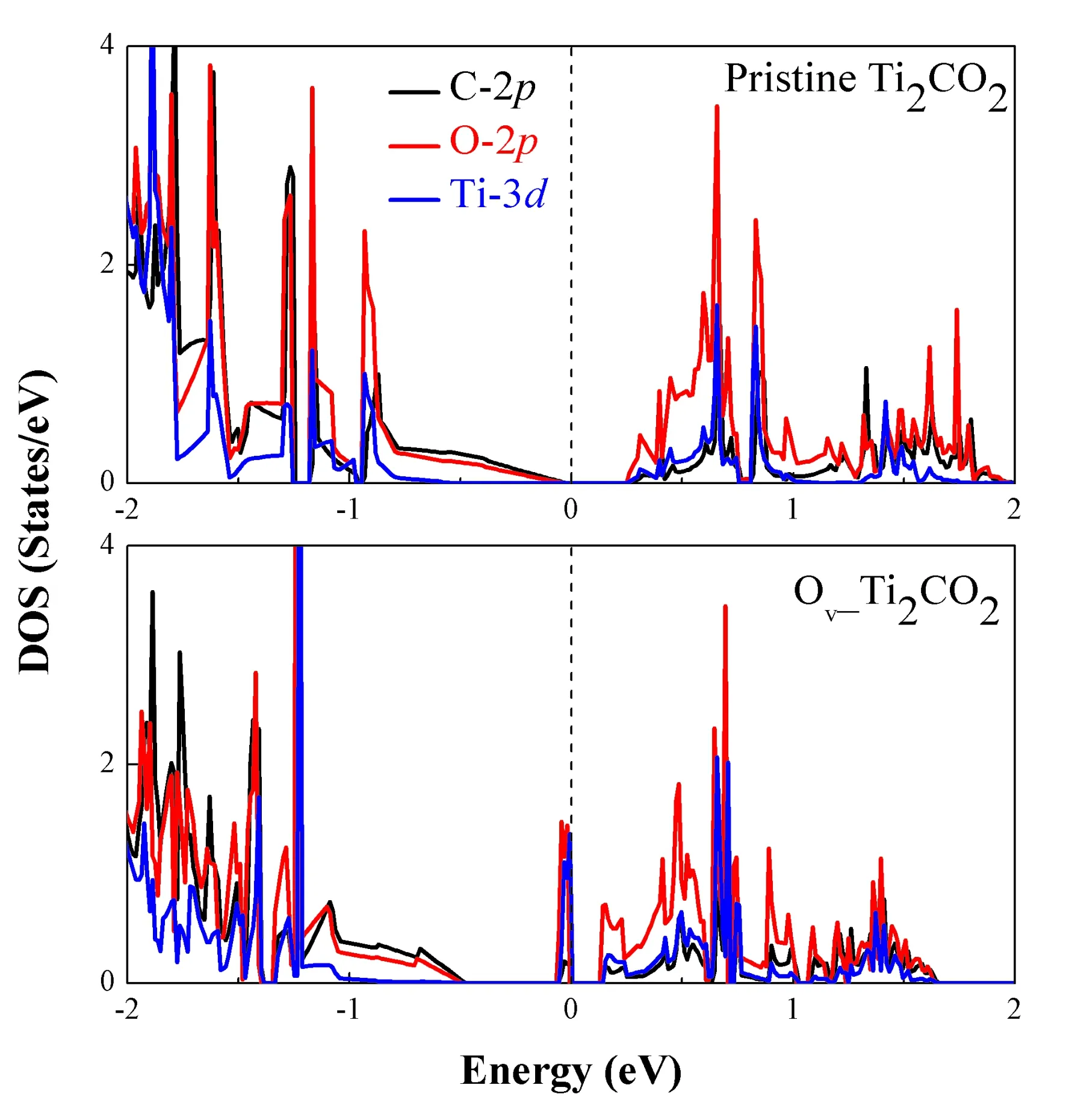
图6 完整Ti2CO2单层(上)与单个氧空位Ti2CO2单层(下)的分波态密度(DOS)比较 Fig. 6 A comparison for the projected DOS of the pristine Ti2CO2 (top) and Ov_Ti2CO2 (down).
4 结 论
我们采用第一性原理计算方法,研究了H2S分子在二维单层Ti2CO2表面上的吸附性质,以及外加应变和电场对其性质的调制;并进一步分析了Ti2CO2表面缺陷(如水分子修饰、官能团掺杂、氧官能团空位)对H2S吸附性质的影响. 结论如下:(1)H2S气体在单层Ti2CO2上的吸附较弱,且其吸附强度几乎不受外加拉伸应变的影响,但电场能有效调控H2S分子的捕集与释放;(2)表面吸附的水分子促进H2S分子的吸附,其吸附强度随H2O分子增多而增大;(3)官能团OH掺杂浓度低于0.22 mL时,H2S束缚能增至0.49 eV,随掺杂浓度升高而H2S的吸附强度下降;官能团F掺杂对H2S吸附影响忽略不计;(4)单层Ti2CO2表面的氧空位对H2S分子的束缚较强,吸附能达-1.06 eV,可以实现H2S分子的储存.
