胃泌素在结肠癌患者中的表达及其受体拮抗剂对人结肠癌细胞株的抑制作用及其对P38信号转导通路的影响
2019-09-17王斌峰郑丽芳徐秀华
王斌峰,郑丽芳,徐秀华,黄 锋
王斌峰,郑丽芳,徐秀华,金华市中心医院金西院区/金华市婺城区第一人民医院检验科 浙江省金华市 321075
黄锋,天津市东丽医院消化科 天津市 300300
核心提要: 胃泌素在结肠癌组织中的表达与肿瘤分化程度有关, 分化程度越高, 其表达量越高, 胃泌素受体拮抗剂在一定浓度范围内可拮抗胃泌素促增殖效应, 其机制与上调P38、磷酸化-P38、BAX表达及下调Bcl-2表达有关.
0 引言
结肠癌(colon cancer, CC)是我国常见消化系统恶性肿瘤,早期缺乏特异性症状诊断率较低, 导致患者丧失根治性机会, 病死率较高, 极大危害患者生命健康. 胃泌素主要是由胃肠道G细胞分泌一种激素, 与胃泌素受体结合后可刺激胃酸分泌, 促进胃肠道黏膜生长. 既往研究证实, 部分结肠肿瘤细胞株能产生胃泌素, 且大肠癌细胞表面表达有胃泌素受体, 因此推测癌细胞能通过自身分泌的胃泌素与对应受体作用, 实现相应生物学效应, 影响着肿瘤细胞增殖, 但其详细作用及机制尚未明确[1,2].丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一组能被胃泌素等激素激活的丝氨酸-苏氨酸蛋白激酶, 负责细胞表面与细胞核内部间信号传递[3].而P38 MAPK是一种重要细胞内信号转导分子, 与凋亡的启动、细胞周期的静止等息息相关[4]. 本研究选取30例CC患者, 分析胃泌素在CC患者中的表达, 并探讨其受体拮抗剂对人结肠癌细胞株的抑制作用及对P38信号转导通路的影响, 报道如下.
1 材料和方法
1.1 材料 胃泌素受体/胆囊收缩素-B受体(cholecystokinin-B receptor, CCK-BR)mRNA扩增引物(上海生工生物公司);人大肠癌细胞株SW480(中国科学院上海生命科学研究院); 荧光染料(Biosharp公司); 胎牛血清与RPMI-1640培养基(美国Hyclone公司); 逆转录试剂盒(加拿大Fermentas公司); 胰蛋白酶(碧云天公司); Trizol试剂(美国Invitrogen公司); 5-肽胃泌素(Biosharp公司); P38与磷酸化P38兔抗人多克隆抗体(美国Cell Signaling technology公司); 丙谷胺(中国药品生物检定所); β-肌动蛋白抗体(碧云天公司); 噻唑兰(MTT, Bio-sharp公司); ECL化学发光试剂(Millipore公司); 细胞周期染色试剂盒(凯基公司); 兔抗人多克隆抗体(Biosharp公司); 羊抗小鼠多克隆抗体、PVDF膜(上海户实); 离心机(湖南恒诺仪器设备有限公司); 液氮箱(上海京灿); 流式细胞仪(美国贝克曼); 酶标仪(BIOBASE-EL10A, 济南来宝医疗器械).
1.2 方法
1.2.1 免疫组化检测胃泌素表达: 取2016-01/2018-10我院病理科30例CC患者结肠癌组织标本根据世界卫生组织恶性肿瘤分化程度标准分为低分化标本、中分化标本、高分化标本, 同时选取癌旁肠黏膜组织标本, 切片常规脱蜡、复水, 缓冲液清洗2次, 滴甲醇配制0.3%过氧化氢阻断液, 10 min后缓冲液清洗, 滴加一抗工作液(稀释度1:200)37 ℃孵育1-2 h, 缓冲液清洗, 滴加抗体增强剂, 室温放置20 min, 缓冲液清洗, 滴加二抗, 室温放置30 min, 缓冲液清洗, 滴加1-2滴DAB Plus Chromogen, 自来水冲洗, 复染, 脱水, 透明, 封片, 观察不同分化程度患者结肠癌组织中胃泌素表达.
1.2.2 SW480结肠癌细胞株培养: (1)细胞复苏: 培养基、PBS于37 ℃恒温水浴预热备用, 取出SW480细胞冷冻管,立即放入37 ℃水槽中快速解冻, 离心, 弃上清, 加入培养基, 吹打, 移入培养瓶中, 加入适量培养基, 放入CO2培养箱中培养, 瓶壁长满>80%时, 进行细胞传代; (2)细胞传代: 弃去长满细胞培养瓶中原培养液, 加入0.5 ml胰蛋白酶, 瓶口塞好橡皮塞, 放在倒置镜下观察细胞, 贴壁细胞逐渐趋于圆形, 于未漂起时弃去胰蛋白酶, 加入10 ml培养液终止消化, 用吸管将贴壁的细胞吹打成悬液, 分装后继续培养; (3)细胞冻存: 工作台与细胞室以紫外线进行15 min照射, 预热小牛血清、胰蛋白酶、培养液等备用, 收集处于对数生长期细胞(冻存前日最好进行换液),用吸管吸出培养瓶中细胞培养液, PBS洗2遍, 吸出冲洗液, 加入胰蛋白酶消化处理, 弃去消化液, 加入少量新培养液, 吸管吸取培养液对瓶壁上细胞进行拍打, 至细胞悬液后, 加入培养液至冻存管中, 1000 r/min离心10 min, 去上清, 加入冻存液, 吹打成均匀状态, 放置冻存管至4 ℃10 min、-20 ℃ 30 min、-80 ℃ 16-18 h、液氮槽长期保存.
1.2.3 分组: 将细胞分为对照组(不进行任何药物处理)、胃泌素组(分别加入6.25、12.50、25.00、50.00、100.00、200.00 mg/L胃泌素进行处理)、丙谷胺组(分别加入8.00、16.00、32.00、64.00、128.00、256.00 mg/L丙谷胺进行处理)、胃泌素联合丙谷胺组(加入12.5 mg/L胃泌素与8.00、16.00、32.00、64.00、128.00、256.00 mg/L丙谷胺进行处理).
1.2.4 检测CCK-BR表达: Trizol试剂提取总RNA, 加入逆转录试剂盒合成cDNA, 以cDNA为模板进行PCR反应, 条件为: 共39个循环, 预变性95 ℃ 30 s, 之后每一步变性95 ℃ 15 s, 退火延伸53.9 ℃ 30 s, 制作溶液曲线, 95 ℃变性30 s, 冷却至65 ℃, 从65 ℃ 10 s开始,每步增加0.5 ℃, 至95 ℃ 10 s, β-肌动蛋白引物序列上下游分别为5′-TGACGTGGACATCGCAAG-3、5′-CTGGAAGGTGGACAGCGAGG-3, CCK-BR引物序列上下游分别为5′-TCTCGCGAGCTCTACTTAGGG-3、5′-AC-CGACGATGCACGTTGAAG-3, 扩增产物为203 bp、185 bp.
1.2.5 检测结肠癌细胞株SW480活力: 取对数生长期SW480细胞, 加入胰蛋白酶消化处理成单细胞悬液, 应用含胎牛血清10%培养液调整细胞为5×104个/ml浓度,以每孔200 μl接种于96孔培养板, 24 h细胞贴壁后, 去培养液, PBS洗2遍, 加入无血清培养液继续培养, 24 h后再以每孔200 μl 10%胎牛血清加入. 各组按照预设定方法与浓度进行对应处理, 分别设6个复孔, 培养48 h, 每孔加入10 μl浓度为5 mg/ml MTT, 放入孵育箱孵育(4 h, 37 ℃),去培养液, 各孔加入DMSO 150 μl, 震荡处理后应用酶标仪检测光吸收值(OD), 以492 nm下OD表示SW480活力.
1.2.6 细胞增殖检测: 采用与1.5相同方法调整细胞浓度为1.7×105个/ml, 以每孔2 ml接种于6孔培养板, 培养24 h, 更换无血清培养液继续培养, 24 h后去上清液, 以每孔2 ml加入含有处理因素1%胎牛血清, 胃泌素组(12.50 mg/L)、丙谷胺组(16.00 mg/L)、胃泌素联合丙谷胺组(12.5 mg/L胃泌素与16.00 mg/L丙谷胺)均设复孔5个, 进行48 h培养,消化离心后去上清, 加入1 ml冷PBS震荡, 离心, 去上清,滴入70% 1 ml冷乙醇进行固定, 过夜(4 ℃), 实施DNA、蛋白质染色, 流式细胞仪检测细胞增殖情况.
1.2.7 P38信号转导通路检测: 细胞总蛋白样品实施电泳处理后, 转移至PVDF膜上, 封闭120 min, TBST漂洗2次, 应用5%胎牛血清稀释至1:2000, 加入一抗, 4 ℃过夜,TBST漂洗3次, 加入二抗(辣根过氧化物酶标记过), 孵育120 min, TBST漂洗3次, 应用ECL显影, 放于全自动发光图像系统内成像, 分析平均光密度, 最终结果根据目标基因/β-肌动蛋白确定.
1.2.8 观察指标: (1)观察结肠癌组织中胃泌素表达; (2)统计SW480中CCK-BR表达情况; (3)比较各组结肠癌细胞株SW480活力; (4)比较各组细胞增殖指数; (5)比较各组P38信号转导通路表达情况:P38蛋白、磷酸化-P38蛋白、B淋巴细胞瘤-2(Bcl-2)、细胞凋亡促进基因(BAX).
统计学处理采用SPSS 22.0统计学软件处理数据,计量资料以(mean±SD)表示, 多组间比较以单因素方差进行分析, 两两比较以LSD-t检验.P<0.05为差异有统计学意义.
2 结果
2.1 结肠癌组织中胃泌素表达情况 胃泌素阳性反应着色于细胞质, 细胞核未见染色, 分化程度越高, 胃泌素表达阳性率越高, 而在癌旁肠黏膜组织中几乎不表达(图1-4).
2.2 CCK-BR表达情况 SW480中CCK-BR PCR扩增产物为185 bp, 表达量为(1.57±0.15).
2.3 结肠癌细胞株SW480活力 胃泌素组、胃泌素联合丙谷胺组不同浓度范围内SW480 OD值比较差异具有统计学意义(P<0.05); 胃泌素组6.25-200.00 mg/L范围内SW480 OD值均高于对照组(P<0.05); 胃泌素组12.50 mg/L时SW480 OD值最高(P<0.05); 胃泌素组25.00-200.00 mg/L范围内SW480 OD值比较差异无统计学意义(P>0.05); 丙谷胺组8.00-256.00 mg/L范围内SW480 OD值比较差异无统计学意义(P>0.05); 胃泌素组联合丙谷胺组在12.50 mg/L胃泌素联合16.00 mg/L丙谷胺时, SW480 OD值最低, 低于对照组(P<0.05), 之后随着丙谷胺浓度增加, SW480 OD值比较差异无统计学意义(P>0.05). (表1、图5).
2.4 细胞增殖情况 各组细胞增殖指数比较差异具有统计学意义(P<0.05); 丙谷胺组(16.00 mg/L)细胞增殖指数与对照组相比差异无统计学意义(P>0.05); 胃泌素组(12.50 mg/L)细胞增殖指数高于丙谷胺组(16.00 mg/L)、胃泌素组联合丙谷胺组(12.5 mg/L+16.00 mg/L)(P<0.05). (表2).
2.5 P38信号转导通路 各组P38蛋白、磷酸化-P38蛋白、Bcl-2蛋白、BAX蛋白表达比较差异具有统计学意义(P<0.05); 胃泌素组(12.50 mg/L)P38蛋白、磷酸化-P38蛋白、BAX蛋白低于对照组、丙谷胺组(16.00 mg/L)、胃泌素组联合丙谷胺组(12.5 mg/L+16.00 mg/L), Bcl-2蛋白表达高于对照组、丙谷胺组(16.00 mg/L)、胃泌素组联合丙谷胺组(12.5 mg/L+16.00 mg/L)(P<0.05). (表3).
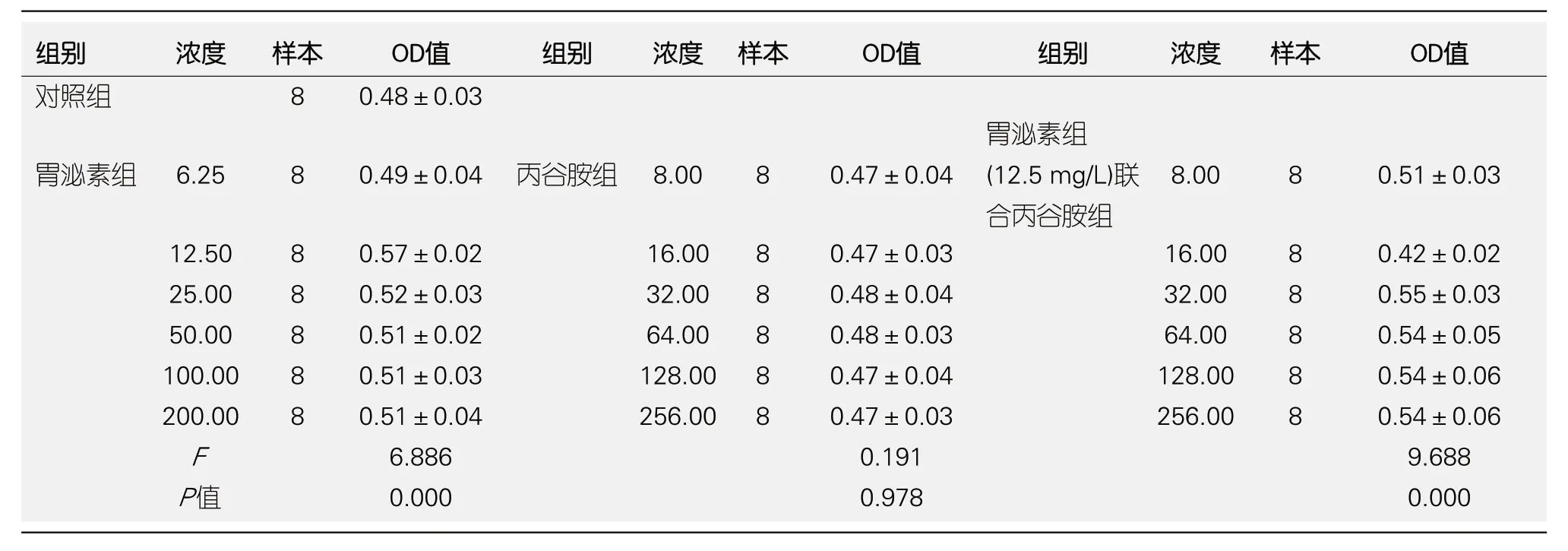
表1 比较各组结肠癌细胞株SW480活力(mean±SD)

表2 比较各组细胞增殖指数(mean±SD,%)
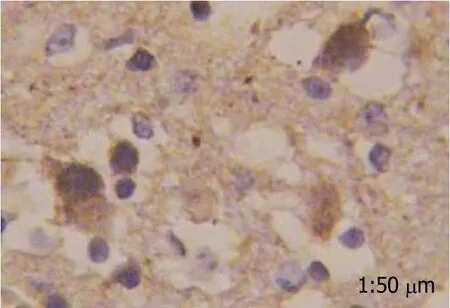
图2 低分化程度结肠癌组织中胃泌素表达情况.

图3 中分化程度结肠癌组织中胃泌素表达情况.
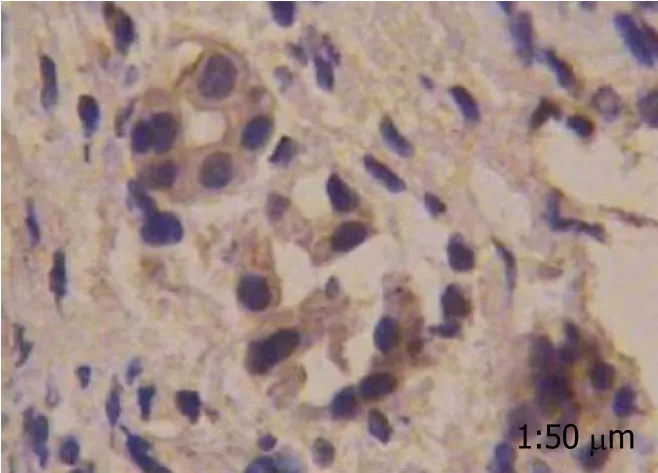
图4 高分化程度结肠癌组织中胃泌素表达情况.
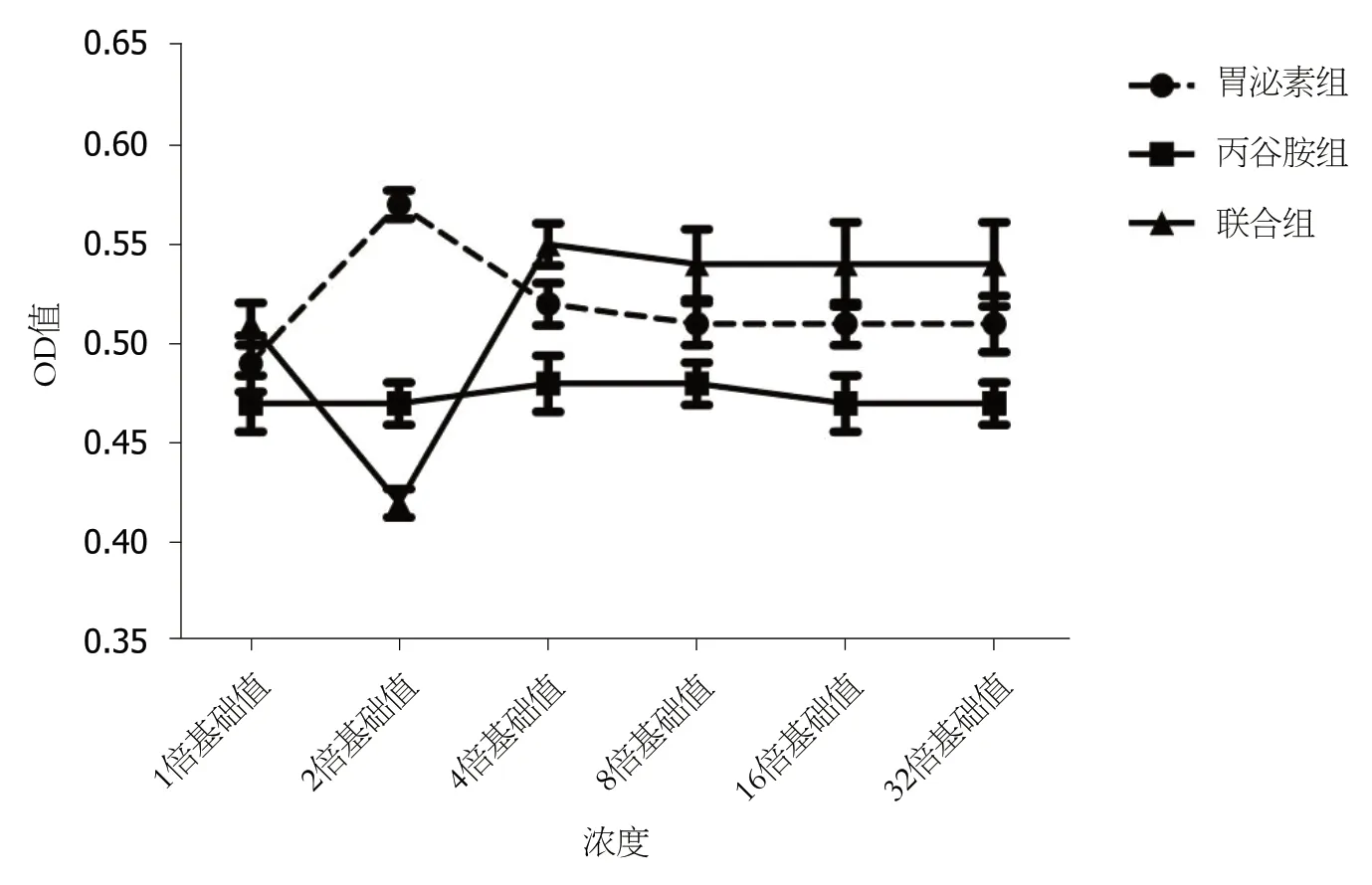
图5 各组结肠癌细胞株SW480活力.
3 讨论
胃泌素广泛存在于胰腺组织、胃肠道内, 是一种单拷贝基因, 由G细胞转录后, 在粗面内质网中翻译生成前胃泌素原, 并经蛋白酶切割与氨基酸衍生化作用完成翻译加工, 形成胃泌素[5]. 动物学实验表明, 胃泌素可通过与自身受体结合促进正常胃肠道黏膜生长[6]. 国外学者研究证实, 胃泌素在CC患者血清中呈高表达状态[7,8]. 近年来人们发现胃泌素除了这种经典远距分泌外, 还拥有其他分泌途径[9-11]. 如Rai等[12]研究指出, 胃癌患者肿瘤组织细胞膜表面存在胃泌素受体, 并推测这可能参与了恶性肿瘤细胞生长的调控. 本研究应用PCR检测CC癌细胞组织CCK-BR表达, 发现结肠癌细胞株SW480中存在CCK-BR, 提示胃泌素能通过旁分泌途径发挥生物学效应, 即胃泌素不仅能作用于自身细胞上该因子受体, 参与恶性肿瘤发生, 同时癌细胞产生胃泌素亦能与其表达胃泌素受体结合, 调控恶性肿瘤增殖过程. 同时本研究通过免疫组化染色发现, 分化程度越高, CC组织中胃泌素表达阳性率越高, 提示CC对胃泌素存在依赖性.
体外研究证实, 胃泌素异常表达造成的细胞生长失控可被胃泌素受体拮抗剂抑制[13,14]. 丙谷胺系抗酸药及治疗消化性溃疡药物, 具有抗胃泌素作用[15,16]. 本研究结果显示, 胃泌素组6.25-200.00 mg/L范围内SW480 OD值均高于对照组(P<0.05), 提示胃泌素可促进CC细胞株SW480的表达, 抑制细胞凋亡. 且胃泌素组12.50 mg/L时SW480 OD值最高(P<0.05), 而25.00-200.00 mg/L范围内SW480 OD值比较差异无统计学意义(P>0.05), 说明胃泌素12.50 mg/L时促增生能力最强, 继续增加胃泌素剂量抑制凋亡作用不再持续增强. 分析原因发现, 正常情况下机体胃泌素与其受体处于动态平衡中, 发生病变时这种平衡被打破, 持续高表达胃泌素不断与受体结合, 使受体减少, 当胃泌素到达一定浓度, 由于受体数量限制,其促进恶性肿瘤细胞增殖作用亦趋于平衡[17-19]. 同时本研究还发现, 丙谷胺组8.00-256.00 mg/L范围内SW480 OD值比较差异无统计学意义(P>0.05), 而12.50 mg/L胃泌素联合16.00 mg/L丙谷胺SW480 OD值最低, 低于对照组(P<0.05), 之后随着丙谷胺浓度增加, SW480 OD值比较差异无统计学意义(P>0.05), 提示丙谷胺在16.00 mg/L时可拮抗胃泌素促增殖效应, 继续增加浓度, 受其受体饱和影响, 不会增加拮抗效应, 这可为临床治疗CC提供思路与参考.
此外胃泌素组(12.50 mg/L)细胞增殖指数高于丙谷胺组(16.00 mg/L)、胃泌素组联合丙谷胺组(12.5 mg/L+16.00 mg/L)(P<0.05), 直接佐证了胃泌素能促进CC细胞增殖, 但其作用机制目前尚未明确. P38信号通路是MAPK四个亚家族之一, 信号传导过程精确、复杂, 不同刺激因素可传递不同信息, 其中BAX是BCL-2基因家族中细胞凋亡促进基因, 其高表达可拮抗BCL-2促使细胞发生凋亡[20-23]. 邹存华等[24]报道发现, P38可通过上调uPA表达促进卵巢癌细胞侵袭、转移. 隋欣等[25]研究指出, P38阳性高表达是胃腺癌预后生存期有利因素. 可见在不同疾病中P38信号通路具有不同生物学效应, 因此有必要探究其在CC中作用. 本研究结果显示, 胃泌素组P38蛋白、磷酸化-P38蛋白、BAX蛋白低于对照组、丙谷胺组、胃泌素组联合丙谷胺组, Bcl-2蛋白表达高于对照组、丙谷胺组、胃泌素组联合丙谷胺组(P<0.05),提示胃泌素能下调P38、磷酸化-P38、BAX表达及上调Bcl-2表达, 这可能是其促进CC增殖机制. 值得注意的是,目前已明确人结肠癌细胞株有HCT116、HT-29等多种,本研究仅对SW480进行探索, P38信号通路在其他类型是否具有相似影响有待后续基础实验及临床实验验证.
白雪皑皑,冬月盈盈,黄粱有梦,万花有因。这十六字真言并非虚谈,说的就是冬至日午夜的星象,合乎王积薪所记媪妇谱,世外的旅客,可据此找到往万花谷的道路。少年们随两位老人往天上看,各自手攀棋盘与树枝,仰着头,一时也看得心神俱醉。
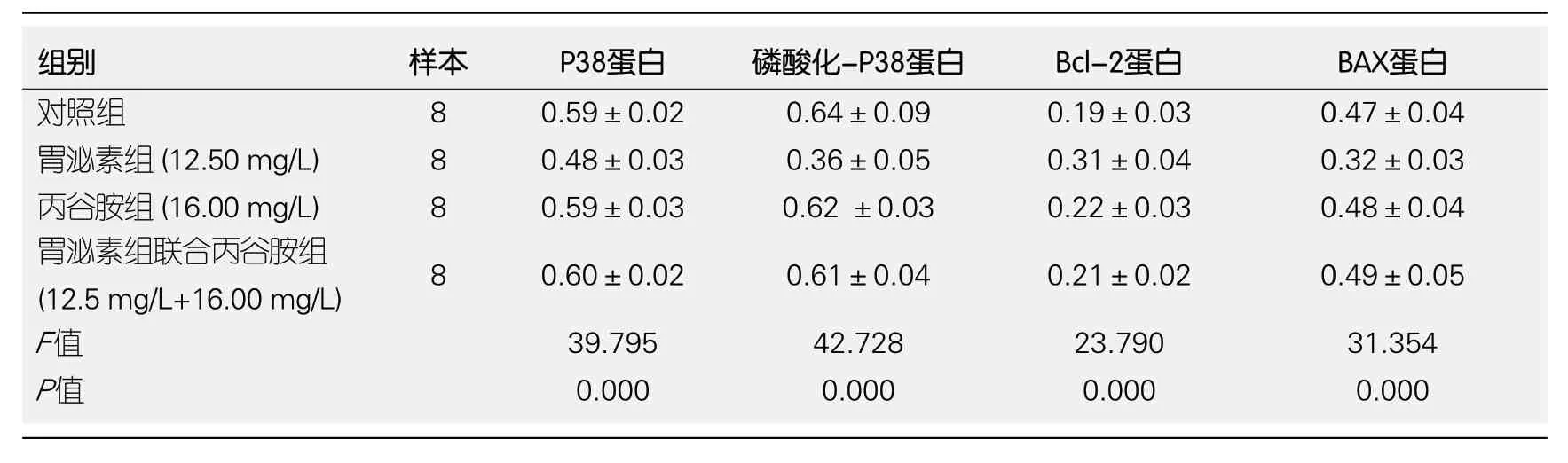
表3 比较各组P38信号转导通路表达情况(mean±SD)
综上所述, 胃泌素可抑制人结肠癌细胞株SW480的凋亡, 且在结肠癌组织中的表达与肿瘤分化程度有关,分化程度越高, 其表达量越高, 胃泌素受体拮抗剂在一定浓度范围内可拮抗胃泌素促增殖效应, 其机制与上调P38、磷酸化-P38、BAX表达及下调Bcl-2表达有关.
文章亮点
实验背景
结肠癌为临床多见恶性肿瘤, 由于患者前期缺少特异性症状, 造成多数患者在就诊时已失去最佳手术时机, 对患者身心健康造成了严重影响.
实验动机
胃泌素和其受体能够刺激分泌胃酸, 加速胃肠道内黏膜的生长, 相关研究显示, 胃泌素对肿瘤细胞增殖可能有促进作用.
实验目标
实验方法
免疫组化检测临床结肠癌患者癌组织标本内胃泌素阳性表达, 检测丙谷胺组对人大肠癌SW480细胞活力、增殖和P38信号转导通路影响.
实验结果
结肠癌患者癌组织分化程度越高则胃泌素的阳性率也越高, 丙谷胺可有效抑制SW480细胞增殖.
实验结论
胃泌素拮抗剂可抑制SW480细胞的增殖, 其作用机制可能和下调Bcl-2表达及上调P38、磷酸化-P38、BAX表达有联系.
展望前景
今后还需进一步分析其他肠癌细胞如CaCo2、HT29、HCT116等的胃泌素表达水平, 为阐释胃泌素对结肠癌患者癌细胞的影响提供更有力佐证.
