基于UHPLC-ESI-HRMS的仿刺参磷脂轮廓产地差异比较
2019-09-17王雪松张鸿伟张晓梅林黎明徐杰薛长湖
王雪松,张鸿伟,,张晓梅,林黎明,徐杰*,薛长湖
(1. 中国海洋大学食品科学与工程学院, 青岛 266003; 2. 青岛海关检验检疫技术中心, 青岛 266000)
仿刺参(ApostichopusJaponicus)自古以来名列“海八珍”之一,具有很高的经济价值及营养价值[1]。磷脂(phospholipid,PL)是仿刺参脂质组成的重要成分之一,可分为甘油磷脂与鞘磷脂,其基本骨架分别为甘油和鞘氨醇。甘油磷脂是一种两性分子,一端为亲水性的含氮或含磷的头基,另一端为疏水(亲油)性的长烃基链[2]。尽管仿刺参中磷脂相对于蛋白质是低含量组分,但其对人体的营养价值仍十分可观[1]。仿刺参磷脂中富含长链多不饱和脂肪酸(PUFA),如二十碳五烯酸(C20:5 n-3,EPA)和二十二碳六烯酸(C22:6 n-3,DHA),而膳食PUFA中n-3/n-6比例的增加具有降低血浆脂质浓度[3],预防心血管疾病[4],并降低患癌症风险的作用[5]。
中国仿刺参主要产自辽宁、山东和福建等地。市场上大连仿刺参的价格相对而言较高,相应地也出现了以异地海参冒充辽参高价出售的现象。为了防止少数商家进行不正当牟利,从而保护消费者的合法权益,保证水产养殖产业的平稳高速发展,有必要开展仿刺参的产地溯源研究。目前常见的水产品溯源技术主要是根据稳定同位素比率、元素分布和生物分子(DNA、蛋白质和脂质)等信息对产地进行鉴别[6-8]。已有研究利用海参中游离脂肪酸含量差异,通过气相色谱-质谱联用技术实现产地溯源[6],但需要对脂肪酸进行衍生化,操作复杂且耗时较长,此外,气相色谱难以检测不易挥发的脂质,具有一定局限性,因此,开发快速、高通量的液相色谱-质谱联用方法将使其具有更好的应用潜力。研究表明,作为重要生物活性脂质,磷脂的一系列变化反映了生物体内代谢的变化,且海产品的磷脂组成会随生长的环境等条件的不同而变化[9-10]。研究不同产地仿刺参磷脂轮廓的差异,不仅能够为产地溯源和营养学评价提供数据支持,还可为研究外界环境变化对仿刺参代谢的影响提供思路和方法学依据。
本研究旨在利用UHPLC-ESI-TOF-HRMS技术高灵敏度、高分辨率和高通量的特点,采用脂质组学分析策略对来自3个产地仿刺参的磷脂分子组成、相对含量进行测定,并结合化学计量学方法对获取的磷脂组数据进行信息挖掘,分析确定产地差异分子标志物,在磷脂分子种水平探讨仿刺参产地鉴别分析的可行性,并进一步为其营养学评价和代谢组学研究提供基础资料。
1 材料与方法
1.1 实验材料
于2018年11月分别自大连、胶南及威海3个不同产地(下文分别简写为DL、JN及WH)的当地水产品市场购买新鲜仿刺参样本(体长约25 cm),去除内脏后液氮冷冻,置于-80 ℃暂存。每种仿刺参分别取5个完整个体,冷冻干燥后用高速研磨仪(IKA A11basic,德国)于液氮浴中研碎成粉末,保存于50 mL旋盖离心管中,-20 ℃冻存,分析待用。
磷脂提取所用三氯甲烷、甲醇和异丙醇均为分析纯试剂,购自国药(上海)集团。流动相所用甲醇、乙腈和异丙醇均为质谱级试剂,购自美国Merck公司。超纯水采用Milli-Q Gradent系统制备(18.2 MΩ·cm)。甲酸和甲酸铵购自美国Sigma-Aldrich公司。溶血磷脂酰胆碱(lysophosphocholine,LPC)、磷脂酰胆碱(phosphocholine,PC)、溶血磷脂酰乙醇胺(lysophosphoethanolamine,LPE)、磷脂酰乙醇胺(phosphoethanolamine,PE)、磷脂酰甘油(phosphoglycerols,PG)及磷脂酰肌醇(phosphoinositols,PI)的标准品,纯度均>99.1%,购自Avanti Polar Lipids公司(Alabaster,USA)。
1.2 实验仪器
主要仪器包括:ShimadzuNexeraX230A超高效液相色谱仪(岛津公司,日本);Triple TOF 5600+四级杆/飞行时间质谱伙(AB Sciex美国),配有复合DuoSpray离子源,应用软件为AnalystTF(版本1.7);DUC-1C氮吹仪(TAITEX公司,日本);ABS35-S精密分析天平(梅特勒-托利多公司,瑞士);CR22GⅡ高速冷冻离心机(HATACHI公司,日本);A11basic高速研磨仪(IKA公司,德国)。
1.3实验方法
1.3.1 样品前处理
采用改良型Folch法[11]进行磷脂提取。取制备好的仿刺参粉末0.1 g,使用6 mL氯仿/甲醇(2∶1,V/V)振荡提取10 min,加入2 mL超纯水,涡旋20 s,5 000 r/min离心10 min,转移上层至新离心管中(下层氯仿层留置待合并)。向新离心管中加入4 mL氯仿涡旋20 s,静置5 min,重复提取2次,合并所有氯仿层提取液,氮气吹干溶剂,并复溶于1 mL的异丙醇/乙腈/水(2∶1∶1,V/V)中,经过0.22 μm有机滤膜过滤后于-20 ℃储存,备用。上样前超声30 s。
1.3.2 仪器参数
色谱条件:Nexera超高效液相色谱系统(日本岛津公司);C18柱(50.0 mm × 2.1 mm,1.7 μm,美国ThermoFisher公司)。流动相A为甲醇/水(65∶35,V/V),流动相B为甲醇/乙腈(20∶80,V/V),A、B相均含1 mmol/L甲酸铵。采用梯度洗脱:0~15.0 min,100% A;15.0~17.0 min,0~80% A;17.0~17.5 min,80%~100% A;17.5~18.0 min,100% A。流速0.5 mL/min,柱温25 ℃。
质谱条件:Triple TOF 5600+四级杆/飞行时间质谱仪(AB Sciex美国);ESI负离子模式-4.5 kV,离子化温度500 ℃,雾化气(GS1)60 psi,辅助加热(GS2)35 psi;气帘气(CUR)15 psi;扫描范围m/z120~1 000,IDA自动二级扫描模式;进样量10 μL。
1.3.3 数据分析
使用Lipidview软件(版本V1.2,美国AB Sciex公司)中内置数据库对样本中的磷脂轮廓进行自动鉴定,获得海参的磷脂轮廓信息。并根据标准品的特征碎片,对自动鉴定的结果进行人工筛选,过滤除去假阳性结果。通过MS-DAIL软件(版本V3.12,日本RIKEN研究所),对海参样品中检测到的磷脂分子种进行色谱峰对齐以及归一化预处理,并导入SIMCA-P+软件(版本V14.0瑞典Umetrics公司)进行多元统计分析,后构建正交偏最小二乘法-判别分析(OPLS-DA)模型,用于寻找不同产地仿刺参磷脂分子标志物。
2 结果与分析
2.1 仿刺参磷脂组分鉴定
仿刺参中LPC和LPE保留时间在4~8 min,PC和PE的保留时间在8~14 min(图1)。不同产地的仿刺参在总离子流图上具有差异,说明其磷脂组成不同;为进一步研究造成差异的主要因素,需对仿刺参中磷脂分子种进行鉴定。
首先对仿刺参中的磷脂分子种组成进行了分析。图2给出了在负离子采集模式下3种产地仿刺参中确认鉴定的磷脂分子种的质荷比-保留时间二维展开图。如图2所示,主要磷脂分子种的洗脱时间在2~14 min。磷脂分子种的质荷比主要集中在400~1 000区间内,确认了包括PE、LPE、PC和LPC等主要磷脂亚类约160余种磷脂分子种。
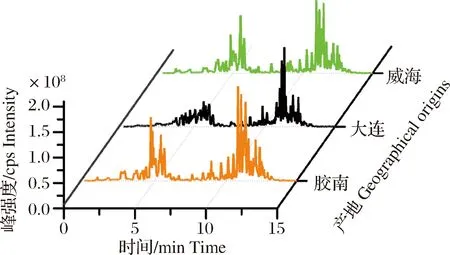
图1 3种产地仿刺参磷脂总离子流图Fig.1 TIC of A. japonicus phospholipids from three geographical origins
仿刺参中主要磷脂分子种(至少1个产地的仿刺参中该分子种在其对应磷脂亚类中含量高于5%)总结于表1。由表可知,仿刺参中磷脂以富含C20∶5、C20∶4和C22∶5等多不饱和脂肪酸的分子种为主,如PC(18∶1-20∶5)、PE(18∶1-22∶5)及PI(18∶0-20∶5)等。而溶血型磷脂(LPC、LPE)中则以饱和或单不饱和中长碳链脂肪酸为主,如LPC(18∶0)、LPE(18∶1)等,与Lou等[12]对仿刺参脂质轮廓分析结果相一致。不同产地仿刺参中磷脂分子种的相对含量有所不同,说明磷脂轮廓具有进行产地区分和鉴别的功能。但由于变量数量较多,利用方差检验评估其差异显著性会导致不可接受的假阳性率(例如,假设规定的检验水准为0.01,则对于n次检验,存在假阳性错误的概率αn=1-(1-0.01)n,当n增加时,αn趋于1[13]),因此宜采用多元统计模型。

图2 3种产地仿刺参磷脂分子种鉴定Fig.2 Identification of phospholipid molecular species from A. japonicus samples from three geographical origins
表1 仿刺参中主要磷脂分子种及相对含量
Tab.1 Main phospholipid molecular species and their relative abundances inA.japonicasn=5
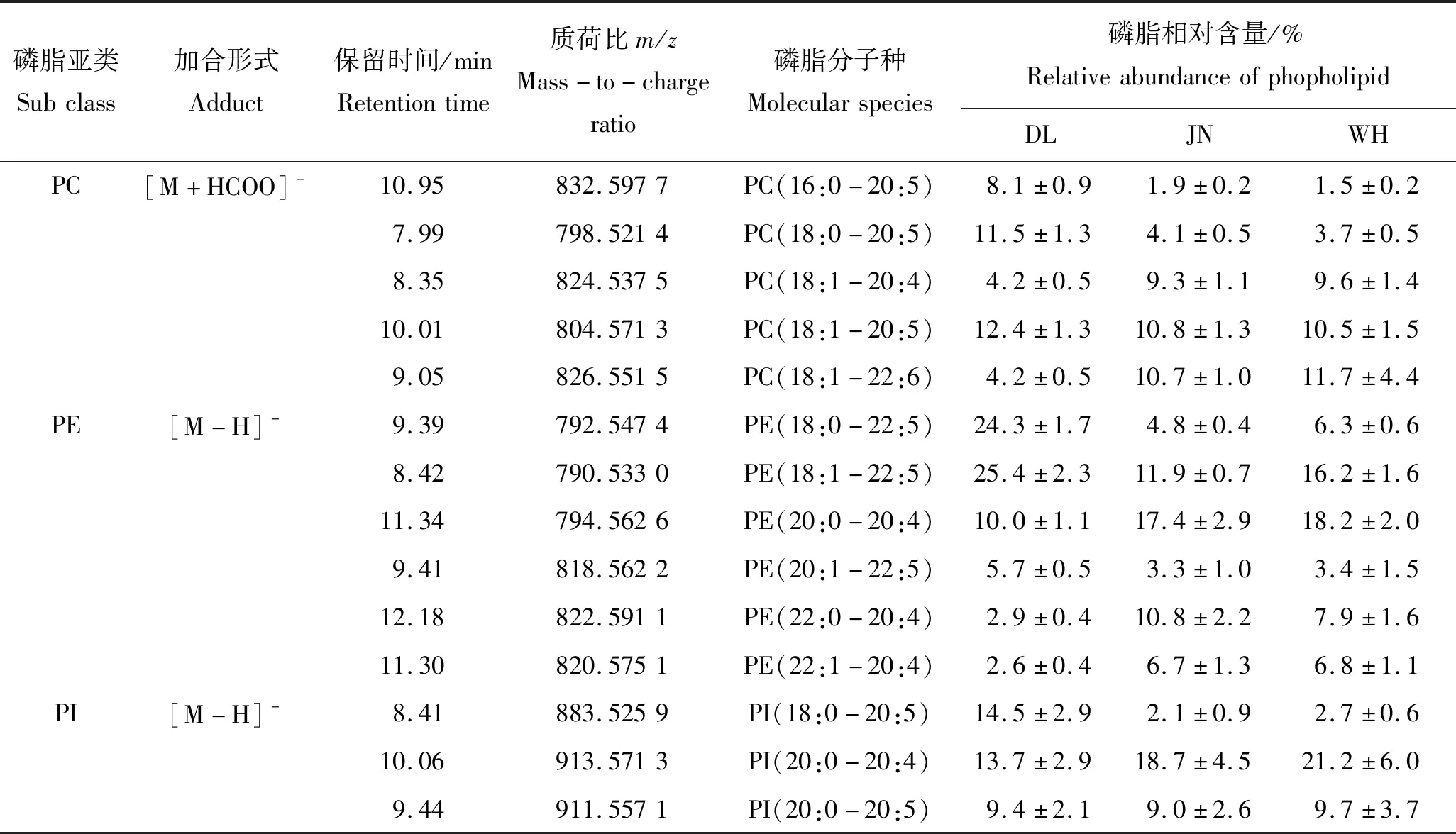
磷脂亚类Subclass加合形式Adduct保留时间/minRetentiontime质荷比m/zMass-to-chargeratio磷脂分子种Molecularspecies磷脂相对含量/%RelativeabundanceofphopholipidDLJNWHPC[M+HCOO]-10.95832.5977PC(16:0-20:5)8.1±0.91.9±0.21.5±0.27.99798.5214PC(18:0-20:5)11.5±1.34.1±0.53.7±0.58.35824.5375PC(18:1-20:4)4.2±0.59.3±1.19.6±1.410.01804.5713PC(18:1-20:5)12.4±1.310.8±1.310.5±1.59.05826.5515PC(18:1-22:6)4.2±0.510.7±1.011.7±4.4PE[M-H]-9.39792.5474PE(18:0-22:5)24.3±1.74.8±0.46.3±0.68.42790.5330PE(18:1-22:5)25.4±2.311.9±0.716.2±1.611.34794.5626PE(20:0-20:4)10.0±1.117.4±2.918.2±2.09.41818.5622PE(20:1-22:5)5.7±0.53.3±1.03.4±1.512.18822.5911PE(22:0-20:4)2.9±0.410.8±2.27.9±1.611.30820.5751PE(22:1-20:4)2.6±0.46.7±1.36.8±1.1PI[M-H]-8.41883.5259PI(18:0-20:5)14.5±2.92.1±0.92.7±0.610.06913.5713PI(20:0-20:4)13.7±2.918.7±4.521.2±6.09.44911.5571PI(20:0-20:5)9.4±2.19.0±2.69.7±3.7

续表1,Tab.1 Continued
注:DL,JN和WH分别表示大连、胶南和威海。下同。
2.2 仿刺参磷脂轮廓数据多元统计分析
2.2.1 基于仿刺参磷脂轮廓的聚类分析
图3为不同产地仿刺参鉴定的磷脂分子种数据PCA-X得分图。图中散点间距离表示其在主成分上的差异[14]。如图3所示,不同产地的仿刺参样本被分为3类,表明磷脂轮廓能够将3个产地的仿刺参有效区分。大连仿刺参与其他产地的磷脂组成差异较大;同属山东半岛的胶南和威海两个产地仿刺参则较为接近,表明其磷脂组成具有相似性。Yun等[15]所产的仿刺参在DNA序列上存在差异。因此,磷脂轮廓的差异一方面可能与其产地环境因素有关[16-17],另一方面,也可能受不同产地仿刺参遗传物质差异的影响。生物体内脂质代谢受生理状态等多种因素影响[18],胶南仿刺参个别样本超出了PCA-X得分图的T295%置信区域,可能是个体差异导致,不影响后续分析。
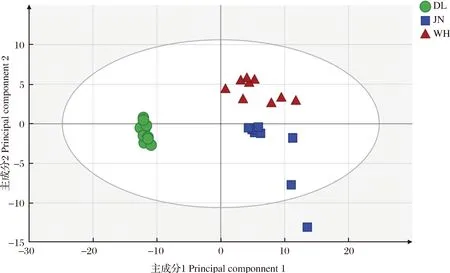
图3 3种产地仿刺参PCA-X分析模型的得分图Fig.3 Score plot of PCA-X model for differentiating A. japonicus samples from three geographical origins
产地溯源技术的原理是基于不同产地农产品光谱特性或化学组成等方面存在的差异进行分析,如张鹏等[19]基于不同产地苹果中糖分等有机物含量的差异,利用近红外光谱技术建立了有效的产地鉴别模型。目前,已有研究尝试根据海参皂苷指纹图谱进行产地溯源,但受个体差异等多种因素影响,其结论具有一定局限性[20]。本研究表明,磷脂轮廓可以有效地对不同产地的仿刺参进行区分,具有进一步筛选对产地差异贡献较大的磷脂标志物的价值。为了更好地研究不同产地的仿刺参在磷脂轮廓上的差异,需要利用有监督作用的多元统计工具OPLS-DA,对不同产地仿刺参磷脂轮廓构建模型进行分析。图4给出了仿刺参磷脂轮廓的OPLS-DA模型得分图,其参数[R2X=0.889(cum),R2Y=0.979(cum),Q2=0.954(cum)](其中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2标示模型的预测能力,理论上R2、Q2数值越接近1说明模型越好,通常情况下,R2、Q2高于0.5 (50%)较好)显示模型的拟合度和预测能力符合要求。如图4所示,在OPLS-DA模型中样本类聚度明显优于PCA分析,特别是胶南和威海两个产地仿刺参的分离更好,且全部样本都位于PCA-X得分图的霍特林T2的95%置信区域内,说明该模型对仿刺参产地的鉴别能力优于PCA模型。

图4 3种产地仿刺参OPLS-DA分析模型的得分图Fig.4 Score plot of OPLS-DA model for differentiating A. japonicus samples from three geographical origins
2.2.2 OPLS-DA两两比较及产地差异海参磷脂分子标志物的筛选
聚类分析表明,不同产地仿刺参磷脂轮廓差异显著。但是,为了筛选对产地差异具有较大贡献的分子种(即产地差异的磷脂标志物),需进一步构建OPLS-DA模型进行两两比较差异分析。表2给出了OPLS-DA模型两两比较的质量评估参数。所有构建的OPLS-DA模型在拟合优度[R2X(cum),R2Y(cum)]、预测能力Q2(cum)、稳健度(R2,Q2的回归曲线截距)方面均满足要求[21],可以用于产地差异磷脂分子标志物的筛选。
表2 3种产地仿刺参磷脂分子标志物筛选OPLS-DA模型质量评估参数表
Tab.2 Quality evaluation parameters of OPLS-DA models for differentiating phospholipid molecular biomarkers inA.japonicussamples from three geographical origins

序号Number比较组别GroupsR2X(cum)R2Y(cum)Q2(cum)置换检验回归曲线截距RegressioncurveinterceptofpermutationtestRb2Qb21DLvsJN0.9310.9990.9990.204-0.6042DLvsWH0.8930.9990.9980.203-0.3483WHvsJN0.5950.9750.9210.321-0.471
注:回归曲线截距(Rb2<0.35,Qb2<0.05)时,表示模型稳健[22]。
为保证筛选出的磷脂标志物具有统计学意义,根据磷脂分子种在OPLS-DA模型中的变量投影重要度(variable importance for the projection,VIP)值、变化倍数(foldchange)和p值(pvalue)对结果进行了过滤,并通过载荷图刀切置信区间进行检验[23]。最终筛选出10个磷脂分子种作为产地差异磷脂分子标志物(表3),主要是PE和PC。值得注意的是,磷脂标志物多筛选自胶南-大连、大连-威海两组模型,而在威海-胶南模型中则较少,这说明胶南和威海两个产地仿刺参磷脂轮组成差异较小,此结论与PCA聚类分析的结果一致。在未来研究中,通过表面解吸常压化学电离质谱等检测技术[24]对少数产地差异标志物进行快速检测,有望开发更加高效的仿刺参产地鉴别方法。此外,脂质是影响农产品感官质量和营养成分的重要因素[25],本研究筛选的磷脂标志物不仅在仿刺参产地溯源方面具有应用潜力,也可以作为仿刺参营养价值评估的重要指标。
表3 仿刺参产地差异磷脂分子标志物
Tab.3 Qualified phospholipid molecular biomarkers ofA.japonicusfrom three geographical origins

序号Number分子种Molecular species统计差异显著组别Groups with significant difference1LPC(18:0)DL-JN; DL-WH2LPC(20:1)DL-JN3PC(18:0-20:5)DL-JN; DL-WH4PE(22:0-20:4)DL-JN; DL-WH; JN-WH5PE(20:0-20:4)DL-JN; DL-WH6PC(16:0-20:5)DL-JN; DL-WH7PC(18:1-20:4)DL-JN; DL-WH8PE(18:0-22:5)DL-JN; DL-WH9PC(18:1-22:6)DL-JN10PC(18:1-18:2)DL-JN
3 结论
本研究利用UHPLC-ESI-TOF-HRMS分析体系结合多元统计分析模型,建立了仿刺参磷脂组鉴定分析与产地差异磷脂分子标志物筛选方法。PCA分析结果表明,不同产地仿刺参能够根据其磷脂轮廓进行有效区分。通过OPLS-DA模型筛选出10个产地差异磷脂分子标志物(主要是PE和PC),有望进一步用于开发仿刺参产地快速鉴别方法。另外,多不饱和脂肪酸被认为是海产品中重要生物活性成分之一,分析发现筛选的产地差异标志物富含C20:4和C20:5等多不饱和脂肪酸,表明不同产地的仿刺参营养价值可能有所不同。本研究为高值海产品的溯源研究提供了方法学参考,同时为评价不同产地仿刺参营养价值差异提供了数据支持。
