低氮对苦荞苗期土壤碳转化酶活性的影响
2019-09-16崔亚茹孙从建张永清
陈 伟,杨 洋,崔亚茹,孙从建,张永清,2
(1.山西师范大学地理科学学院,山西 临汾 041000;2山西师范大学生命科学学院,山西 临汾 041000)
关键字:苦荞;低氮;苗期;土壤;β-葡糖苷酶;蔗糖酶;纤维素酶
碳是构成植物和微生物生命体最重要的基础元素,在根际系统中所占比重最大,转化过程也比较复杂[1],很大程度上决定着根际系统运转的方向与强度。施用氮肥对土壤碳素转化积累有一定影响,能促进土壤有机碳库的积累[2]。王慧等[3]研究证明,合理施用氮肥可以有效促进黄土高原旱地0~20 cm土层土壤有机碳、有机氮积累,提高土壤氮素矿化能力,降低氮素矿化速率,可以有效提高旱地土壤有机氮、有机碳含量和土壤供氮能力。杨瑒等[4]认为施入适量的氮肥可以改善寒区盐碱地的土壤理化性质,促进土壤微生物的生长,从而改善土壤质量。夏雪等[5]的研究证明氮肥的施用可以提高土壤微生物群落碳源利用率、微生物群落的丰富度和功能多样性。而碳素的存在是促进土壤氮素转化的相关因素[6]。碳素对土壤氮素的转化速率也有一定影响[7],研究表明,葡萄糖的添加使土壤微生物对无机氮素固持作用显著增强,无机氮向有机氮的转化速率也相应提高[6]。土壤酶参与了土壤环境中的生物化学过程,是土壤中的生物催化剂[8],也是土壤有机体的代谢动力,与有机物质分解、能量转移等密切相关[9-10],其活性比较敏感,一定程度上反映土壤的状况[11]。土壤酶活性与土壤肥力的关系十分密切[12]。安婷婷等[13]研究表明,小麦根际土壤特性可以通过改善土壤酶活性,从而促进土壤氮素的顺利转化和供应,提高根系生长和植株养分的吸收。土壤β-葡糖苷酶、土壤蔗糖酶与土壤纤维素酶均可表征土壤碳转化循环速率,可作为指标表征其影响。目前,关于低氮胁迫对作物的影响已有较多研究,但大多数研究集中在作物的生理响应、作物适应性、产量等地上部分,对于作物的不同品种在低氮胁迫下响应机制研究较少。
植物在逆境条件下能够感应外界胁迫,并通过自身调节系统使之在生理和形态上发生应激反应,以增强在胁迫条件下的生存机会,而且不同作物及同一作物不同品种对逆境的适应性有很大的差异[14-16]。植物根系通过吸收和分泌作用改变了根际土壤的环境条件,进而影响植物养分的有效性及其吸收转化[17]。有研究表明植物在逆境环境下根系向土壤中的分泌物发生改变,且不同耐性的品种表现出不同的碳源选择偏好,如耐瘠性的品种更倾向于利用结构简单的碳源,而敏感品种更倾向于利用结构相对复杂的碳源[18]。有研究表明种子成熟期80%的氮素供给来自开花前植物体内养分的积累及后期在体内的转移[19],玉米花前营养器官氮素转运对籽粒氮素累积贡献率为42%~62%[20],所以作物开花前即苗期的土壤养分供给研究尤为重要。李敏等[21]研究表明,与低产作物品种相比,高产作物品种具有苗期氮素积累快的特点。隋鹏祥等[22]的研究表明,施氮能显著提高花前氮素转运率和转运量,且随着施氮量的增多氮素积累逐渐增大,但施氮量超过一定量后,氮素积累差异不显著。Chen等[23]研究表明,逆境胁迫下土壤养分循环中酶起到的调节作用显著大于微生物。苦荞是自然界中甚少的药食两用作物,苦荞不仅拥有很高的营养价值、药用价值及保健功能[24],对于一些逆境环境也有一定的自我调节功能,不同苦荞品种对于养分的利用以及在逆境下的响应机制是否有所差异?是否也存在碳源选择偏好?本研究拟通过两种不同耐氮性苦荞品种,设计不同施氮量的盆栽试验,对苦荞苗期土壤碳转化酶(单糖酶:β-葡糖苷酶;二糖酶 :蔗糖酶;多糖酶:纤维素酶)活性进行分析研究,以期为苦荞的优质高效生产提供指导。
1 材料与方法
1.1 供试材料
供试土壤为黄土母质上发育而成的褐土,土壤pH值为7.75,土壤有机质为2.07 g·kg-1,有机碳含量为1.2 g·kg-1,铵态氮含量为0.39 mg·kg-1,硝态氮含量为0.23 mg·kg-1。供试作物为耐氮能力强的迪庆苦荞(DQ)和耐氮能力弱的黑丰1号(HF)[25],迪庆苦荞由迪庆藏族自治州农业科学研究所提供,黑丰1号由山西省农业科学院高寒作物研究所提供。两个品种生育期无明显差异,均为105 d左右。
1.2 试验设计
试验于2017年5-8月在山西师范大学塑料大棚里进行。采用盆栽试验,营养钵大小为35 cm×35 cm,每盆均装入10 kg黄土。试验采取二因素完全随机设计,因素A为不同耐氮性苦荞品种:迪庆苦荞和黑丰1号;因素B为不同氮素处理水平:对照(CK,不施氮肥)、低氮处理(N1,0.8 g·10kg-1)和正常供氮(N2,1.6 g·10kg-1)。共有6种处理组合,每个处理均重复4次。氮肥为尿素(含氮量46.4%),其中磷肥(P2O5,150 mg·kg-1)和钾肥(K2O,60 mg·kg-1)均作为底肥施用,将肥料与黄土充分混匀,所有肥料均为一次性施入。每盆精选16粒饱满均匀无病虫害的苦荞种子,经过蒸馏水冲洗干净后放置在装有清水的烧杯中,浸泡24 h后于2017年5月8日均匀播种后正常浇水,所有盆栽每日等量浇入400 mL水以保证正常生长。为尽可能减少气候对试验的影响,试验期间如遇雨天加盖塑料薄膜以防雨,气温超过30℃时会在中午加盖遮阳网以避免温度过高对试验的影响。
苦荞苗期(2017年6月3日)从各处理随机挑选3株,靠近苦荞根际小心将苦荞整株采出,并收集深度为0~10 cm的土壤。土壤样品一部分除杂质后过1 mm尼龙筛,4℃冰箱内保存,用来测定土壤氨态氮、硝态氮以及酶活性;另一部分风干后除杂质过筛,用来测定土壤pH值、有机碳等理化指标。
1.3 测定指标及方法
1.3.1 苦荞形态指标 用直尺测定株高;茎粗用游标卡尺测定;叶面积采用Li-3000便携式叶面积仪测定。
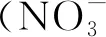
1.3.3 蔗糖酶 以8%蔗糖溶液为底物,土样在37℃下培养24 h后离心,取1 mL上清液后加入3 mL DNS试剂,沸水浴加热5 min,显色,冷水浴中冷却至室温并定容至50 mL,在508 nm的条件下比色测定还原糖[12]。
1.3.4 纤维素酶 以1%羧甲基纤维素溶液为底物,将土样在37℃下培养72 h后离心,取1 mL上清液后加入3 mL DNS试剂,沸水浴加热10 min显色,冷水浴中冷却至室温并定容至25 mL,在540 nm的条件下比色测定还原糖[12]。
1.3.5β-葡糖苷酶 用缓冲的对硝基苯-β-D葡糖苷为底物,土样在37℃下培养1 h,生成的对硝基酚与碱性THAM缓冲液显色,用比色法测定。
1.4 数据统计与分析
采用Microsoft Excel 2007进行处理;使用SPSS 18.0软件进行裂区分析,采用单因素(ANOVA)方差分析,用Duncan’s对不同处理间进行多重比较来判断差异显著性(P<0.05),采用CANOCO 4.5软件进行主成分分析;用Origin 8.0作图。
2 结果与分析
2.1 低氮处理对不同耐氮性苦荞苗期形态指标的影响
由表1可知,不同氮处理对HF的株高有一定影响,N1和N2处理的株高与CK处理的株高存在显著差异(P<0.05),N1和N2处理分别比CK处理高30.2%和32.8%。同一氮处理下的两种苦荞之间株高无显著差异。HF的茎粗在N2与CK处理之间存在显著差异(P<0.05),CK处理下茎粗最小,为2.84 mm,N2处理下的茎粗最大,CK较N2低17.2%;在CK和N1处理下DQ茎粗显著高于HF,两种处理分别比HF高了23.6%和25.3%。N1和N2两种处理下,两种苦荞的叶面积显著高于CK,HF分别比CK高84.2%和84.9%,DQ则分别比CK高119%和136%。HF与DQ均表现为随施氮水平的提高株高、茎粗和叶面积逐渐增大,且同一氮处理下HF的各项形态指标均小于DQ。综上可见,氮肥的添加可以有效促进苦荞株高、茎粗和叶面积的生长,耐氮性强的苦荞表现出品种优势,在低氮胁迫下具有更强的耐性,长势更好。
2.2 低氮处理对不同耐氮性苦荞苗期土壤理化性质的影响
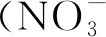
2.3 低氮处理对不同耐氮性苦荞苗期土壤酶活性的影响
氮处理、品种及其交互作用均对苦荞土壤β-葡糖苷酶和蔗糖酶产生极显著影响,品种及其与氮处理的交互作用对纤维素酶也产生了极显著的影响(P<0.01)(表2)。由图1(a)可以看出,同一氮处理下两种苦荞的土壤β-葡糖苷酶活性均存在显著差异(P<0.05),在CK和N1处理下均表现为DQ>HF,而在N2处理下则表现为HF>DQ,且HF在N2处理下表现为酶活性最高。CK和N1处理下DQ较HF分别增加了11.6%和58.3%,N2处理下DQ比HF低了19.7%。HF的N2处理显著高于其余两种氮处理,分别比CK和N1高了92.1%和94.2%;DQ施氮肥的处理(N1和N2)显著高于CK,分别高了40.2%和38.2%。可见,施氮肥可以显著提高苦荞的土壤β-葡糖苷酶活性。由图1(b)可知,两种苦荞之间的土壤蔗糖酶均存在显著差异,HF 3种氮处理下的土壤蔗糖酶活性之间均存在显著差异,DQ的N1处
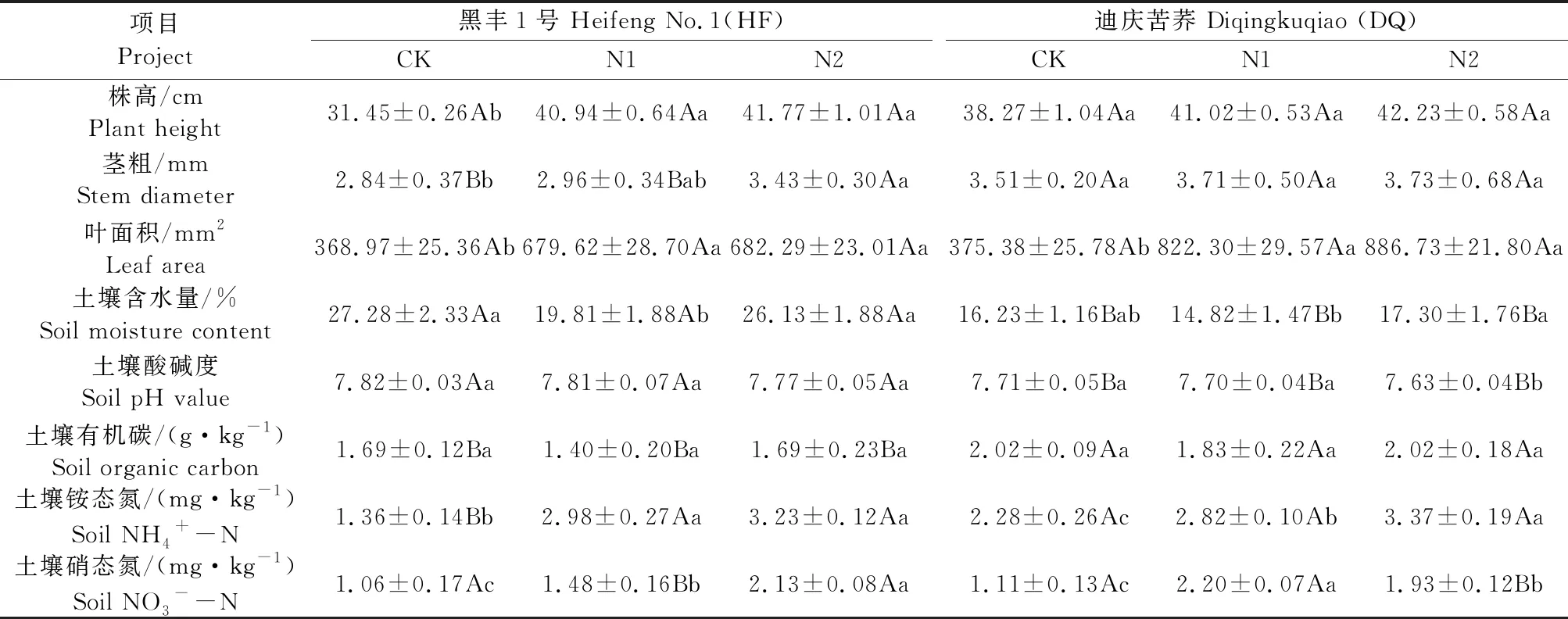
表1 不同氮处理下苦荞苗期形态及土壤理化指标
注:表中数据为平均值±标准差。不同大写字母表示同一氮处理不同品种在P<0.05水平差异显著,不同小写字母表示同一品种不同氮处理在P<0.05水平差异显著。CK—不施氮肥,N1—低氮处理,N2—正常供氮处理,下同。
Notes: Data in the
Table are mean ± standard deviation. The different uppercase letters represent different varieties significantly different in the probability level ofP<0.05 under the same treatments; different lowercase letters indicate that the different treatments have significant differences in the probability level ofP<0.05 with same variety. CK—no nitrogen fertilizer, N1—low nitrogen treatment, N2—normal nitrogen treatment, the same below.

表2 苦荞苗期不同品种及氮处理土壤理化指标裂区分析
注:*表示有显著影响,**表示有极显著影响,ns表示影响不显著。
Notes:“*” indicates significant effects (P<0.05). “**” indicates very significant effects (P<0.01). “ns” is not significant effects.
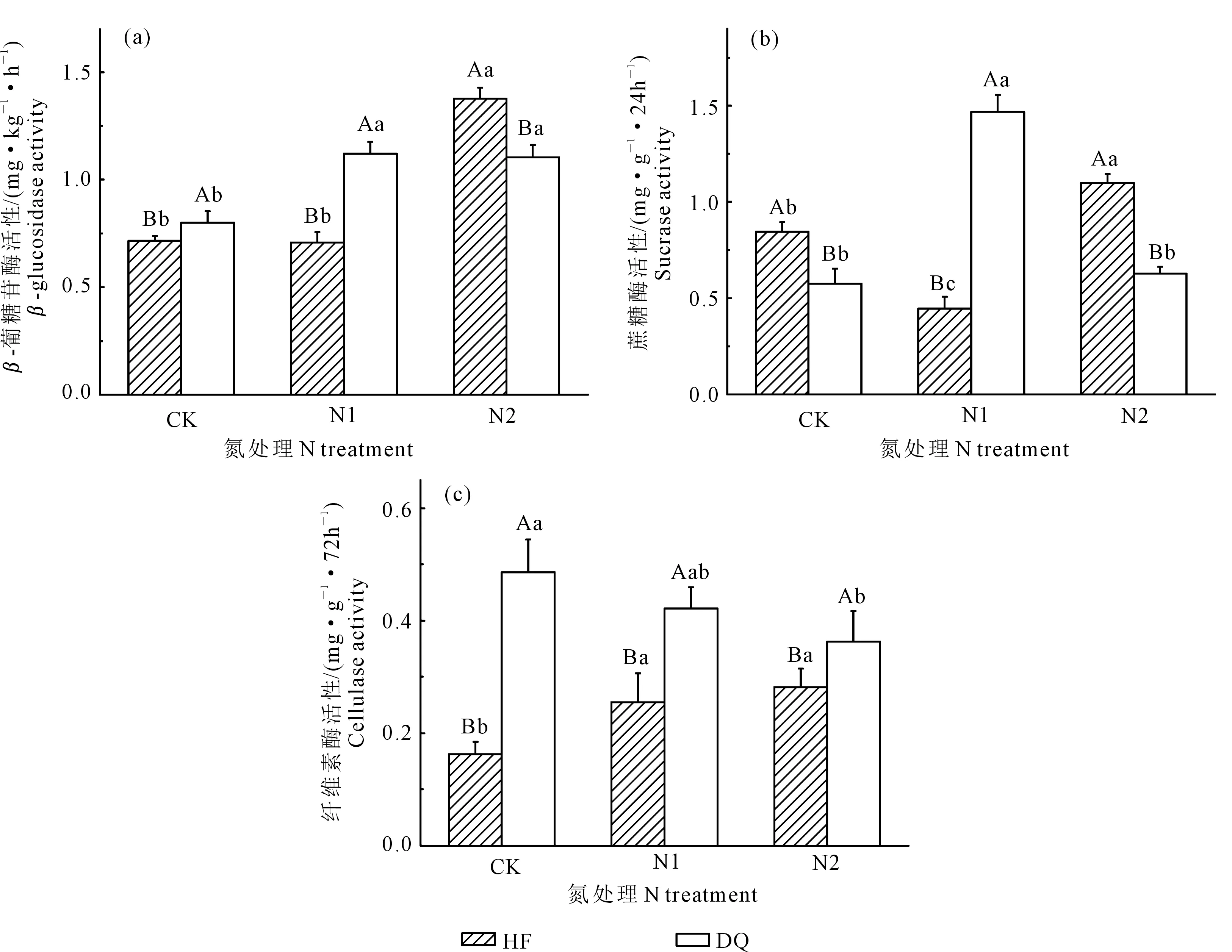
注 Note:HF—黑丰1号 Heifeng No.1;DQ—迪庆苦荞 Diqingkuqiao. 下同。The same below.图1 不同氮处理下不同苦荞品种苗期根际土壤碳转化酶活性Fig.1 Three carbon invertase activities in rhizosphere soils of different varieties of tartary buckwheat during the seedling stage under different N treatments
理显著高于其余两种氮处理(P<0.05)。N1处理下DQ为HF的3.3倍,其余两种氮处理下均表现为DQ
2.4 低氮对不同苦荞品种苗期土壤碳转化酶活性及理化性质影响的主成分分析
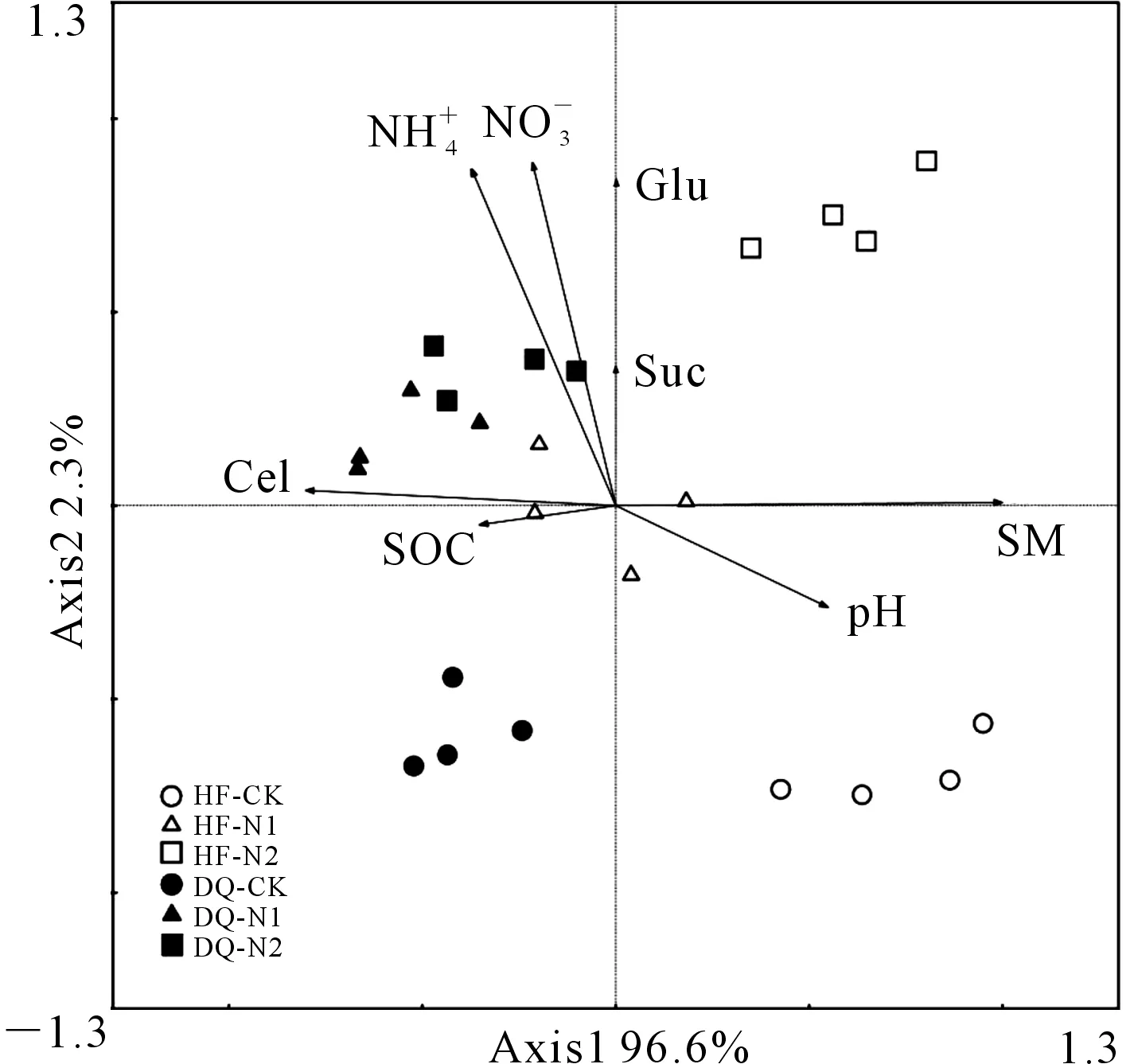
注 Note:Suc—蔗糖酶 sucrase;Cel—纤维素酶 cellulase;Glu:β-葡糖苷酶 β-glucosidase;SM—土壤含水量 soil moisture content;pH—土壤pH值 soil pH;SOC—土壤有机碳 soil organic 铵态氮 soil 硝态氮 soil 图2 不同氮处理下2个苦荞品种苗期土壤酶 及理化性质的主成分分析Fig.2 Principal components analysis (PCA) of soil enzymes and physicochemical properties of tartary buckwheat seedlings under different nitrogen treatments
3 讨 论
在农业生态系统中,碳循环是作物养分有效性中的重要一环,土壤中的碳供应缺失可能会影响到其它养分的有效性,进而可能会导致农产品产量与品质的下降[27]。土壤酶在土壤生态系统中很活跃,在营养物质转化与有机质分解等方面起着很重要的作用[19],其活性反映了土壤中各种生物化学过程的强度和方向,是土壤质量和生态系统健康的重要指标。施肥可以通过改善土壤养分状况以及促进作物发育而影响土壤酶活性。适量施用N、P、K等无机肥料和长期有机与无机肥配施都能显著提高土壤酶活性[28],进而提高农田生态系统的生产力。
3.1 低氮胁迫下苦荞苗期形态特征
本研究中,同一氮处理下耐低氮苦荞品种的株高、茎粗、叶面积均大于不耐低氮苦荞品种,可能是在低氮胁迫下,苦荞会通过自身的一些生理生化调节以更好地适应低氮环境。株高、茎粗、叶面积反映苦荞的生长状况,同一品种的苦荞株高、茎粗、叶面积均随着施氮水平的提高而逐渐增大。张楚等[29]研究表明,低氮胁迫下苦荞幼苗叶片面积显著下降,耐低氮苦荞品种在低氮环境中具有更好的地上部生长形态,受低氮影响较小,适应性更强。白文琴[30]研究表明随着氮肥用量的增多苦荞株高呈现出增加的趋势,同时充足的氮素会促进苦荞细胞的分裂与增长,进而促进苦荞叶面积的增大,与本研究结果基本一致。
3.2 低氮胁迫下苦荞苗期土壤理化性质特征

3.3 低氮胁迫下苦荞苗期不同品种碳源选择偏好
β-葡糖苷酶是单糖酶,它能降解真菌细胞壁作为氮源和碳源,也是纤维素降解过程中参加限速步骤的酶;蔗糖酶为二糖酶,可以利用低分子量底物,蔗糖酶活性的高低也可以表征土壤中碳循环速度[37];纤维素酶为多糖酶,可以分解土壤中的纤维素。土壤中碳酶分解生成的葡萄糖作为土壤微生物的可用能量和碳源,可以引发土壤微生物活动和生长,增加了无机氮的固定,并且具有较低的氮矿化速率,可以促进植物体对氮素的吸收利用[38]。
本文研究结果显示,迪庆苦荞在低氮胁迫下可以利用更多结构简单的碳源,而在常氮处理下,不耐低氮的黑丰1号显示出品种的差异,利用更多碳源。孙波等[17]研究表明,根际环境中氮素匮乏通常会刺激到植物根系的生长从而增加吸收面积,提高养分的空间有效性。张楚等[29]研究表明,在低氮胁迫下耐低氮苦荞品种的主根长、根系平均直径、根系体积、根系表面积、根系干重等均高于不耐氮品种,低氮环境在一定程度上可以促进耐氮品种根系生长,不耐低氮品种受低氮胁迫的影响更大。大量的根系在土壤中穿插使根尖破损会释放出更多的胞外酶,低氮胁迫下,耐低氮苦荞品种可能通过单糖酶数量的增加来调节土壤中的碳氮比值,增加微生物等代谢的活性,增加土壤中氮素的释放,提高对养分的利用,满足自身的生长需求。有研究表明,耐受性小麦品种对碳源利用率的增加是由于土壤微生物代谢活性的提高,有利于提高碳利用效率并降低呼吸损失[18]。较少的根系生物量会降低土壤中的纤维二糖水解酶活性和乙酰葡糖胺-氨基己糖苷酶活性[39]。有研究表明,低氮胁迫下,耐低氮苦荞根系活力和硝酸还原酶活性高于不耐低氮苦荞[29]。吕凤莲等[40]通过研究发现低水平的氮添加对油松幼苗土壤蔗糖酶和脲酶活性均有促进作用,这与本研究结果基本一致。
低氮胁迫下,多糖酶(纤维素酶)活性在品种间的趋势和单糖、二糖酶相同,均为迪庆苦荞大于黑丰1号,但是常氮处理下,与单糖和二糖酶相比较,迪庆土壤中的纤维素酶活性依然显著高于黑丰1号,结果表明耐低氮能力强的迪庆苦荞偏好于结构较复杂的碳源,而耐低氮能力弱的黑丰1号则更偏向利用碳源结构较为简单的化合物。孙锋等[41]发现在棕黄砂质土壤中纤维素酶活性的强弱与土壤中氮素供给有很好的相关性。Bao等[18]的研究结果表明,土壤微生物并非平等利用所有可用的碳源,不同耐受性的作物品种拥有不同的碳源选择偏好。有研究表明[5]不同施氮水平土壤微生物功能多样性差异明显,起分异作用的主要碳源是糖类和氨基酸类。土壤微生物的活性可能会因逆境胁迫对作物根系分泌物的影响而发生改变,这为微生物分解提供了基质[39]。在氮素丰富的土壤中,土壤微生物吸收作为低分子量微生物溶解有机氮的氨基酸为它们提供碳以刺激呼吸,进而满足其的氮需求[33]。由于土壤微生物可以通过改变营养物质的可利用性和资源分布来间接影响植物生产力,土壤酶活性的这些变化也可能反映了苦荞品种对低氮胁迫的敏感性,并反过来影响植物的生长。
4 结 论
氮肥处理和品种均对苦荞土壤碳转化相关酶活性产生显著的影响。低氮胁迫下,迪庆苦荞土壤中单糖、二糖、多糖酶的活性均高于黑丰1号,但是在常氮处理下,黑丰1号的单糖、二糖水解酶显著高于迪庆苦荞,而多糖水解酶的活性却显著低于迪庆苦荞。不同耐氮性的苦荞品种对碳源的选择偏好不同,耐氮能力强的苦荞品种更偏向于利用较为复杂的碳源,在低氮胁迫的环境下则偏向于利用结构简单的碳源,而耐氮能力弱的苦荞品种更偏向于利用简单的碳源,但多集中在正常施氮的环境下,低氮胁迫下对碳源利用较少。
致谢:非常感谢迪庆藏族自治州农业科学研究所与山西省农业科学院高寒作物研究所对本课题提供的品种。
