基于“有效成分—性状”的关联分析评价丹参品质的研究*
2019-09-14陈军峰陈万生
王 芸,陈军峰,张 磊,陈万生**
(1.第二军医大学附属长征医院 上海 200433;2.上海中医药大学中药资源与生物技术中心上海 201203;3.第二军医大学药学院 上海 200433)
性状鉴定是中药鉴定的主体,“辨状论质”是传统中药鉴定的精髓与总结[1,2]。“辨状”即辨药材的外观:形、色、气、味、表面特征、质地、断面特征等,“论质”则是由“状”的差异来判断药材的真伪优劣[2]。在中药材质量优劣评价方面,市场流通过程中依旧遵循着“看货评级,分档议价”的古法,即依照中药材商品规格对中药材进行定档定价。我国自建国以后共颁布过三次中药材商品规格标准,分别是1954 年颁布的《38 种药材商品规格标准》,1964年颁布的《54种药材商品规格标准》以及现行的由国家医药管理局和卫生部于1984年联合颁布的《76种药材商品规格标准》[3,4]。
本研究以常用大宗药材丹参为对象,以现代科学对中药材“辨状论质”的科学内涵进行探索。丹参(Salviae miltiorrhizae Radix et Rhizoma),作为临床常用大宗药材,在生产和市场流通过程中,其品质评判主要依据两类评价体系:一类是以“辨状论质”为核心的性状鉴定,即依据性状的差异建立“商品规格”从而对丹参的品质进行评价,该方法简单易行、直观明了,在产地、市场流通中广泛应用,但是主观性强,缺乏可量化标准;另一类评判体系即国家标准,依据《中国药典》(2015 版)要求,测定指征性活性成分的含量(丹酚酸B >3%,总丹参酮>0.25%)来判定丹参是否合格,药典标准科学、准确,但是实施条件要求较高,难于在丹参药材的生产和流通的各个环节普遍应用。两种评判体系与依据各具优势,然而,两类体系是否一致,能否相互印证,并未有相关研究报道。此外,两个评价体系一致或不一致的内在机制为何,解释以上问题,才能阐明丹参“辨状论质”理论的科学内涵。基于以上问题,本研究对两种丹参品质评判体系进行进一步深入解析,利用植物表型组研究策略,建立和补充,阐明丹参药材“辨状论质”的科学内涵,以此促进中药传统性状鉴定的持续发展。
1 材料与方法
1.1 仪器
高分辨率透射扫描仪(UMAX PowerLook 2100XL,台湾);安捷伦1200A-6410A 型三重四级杆串联质谱仪(安捷伦,美国);安捷伦1290A-6538A型四极杆-飞行时间质谱仪(安捷伦,美国);质谱数据分析使用MassHunter(Ver.B.01.04及B.07.00);安捷伦ZORBAX SBC18色谱柱(2.1×100 mm,3.5 μm)(安捷伦,美国);沃特世XSELECT CST-C18色谱柱(2.1×50 mm,2.5 μm),沃特世ACQUITY UPLC HSS T3色谱柱(2.1×100 mm,1.8 μm)(沃特世,美国);WinRHIZO rootscan(Ver2015)植物根系高分辨率扫描分析系统(WinRHIZO,加拿大)。
1.2 试药
丹参酮ⅡB、紫丹参甲素、丹参二醇B、紫丹参萜醚标准品(纯度≥98%):云南西力生物技术有限公司;丹参素钠、迷迭香酸、丹酚酸A、丹酚酸B、丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮、二氢丹参酮和华法林标准品(纯度≥98%):上海源叶生物有限公司。
1.3 植物材料
研究所用丹参样品均为陕西商洛丹参GAP 基地的栽培丹参。
1.4 丹参样品处理
采挖新鲜丹参后在不破坏根系表面结构的情况下简单迅速处理掉表面泥沙等杂质后,统一以主根(或母根)与茎相交处上方(形态学)1-3 cm 处作为检测材料。按长度比将材料均分为两部分,选择靠近根尖的部分置于固定液中进行保存后续用于制作石蜡切片;另一部分的厚片沿横切面直径均分作2 份,一份不做处理,另一份则拆分为周皮,皮层+韧皮部、木质部用作有效成分含量测定。
将已完成上述处理的丹参样品自然干燥;将干燥后的样品,以游标卡尺测定主根中上部直径,以高分辨扫描仪采集根表面图像,Image J获取丹参全区域内表面颜色的色度值。
1.5 丹参药材的定档分级
目前在市场中使用的中药材商品规格依旧是1984年颁布的《76种药材商品规格标准》,以其中所收录的“家种川丹参的标准”作为丹参样品的定档标准,以采收自陕西商洛的102株丹参样品作为测试材料进行定档分级。
1.6 丹参主要活性成分的含量测定
以LC-MS/MS 技术完成酚酸类成分—丹酚酸B、丹参素钠、迷迭香酸、丹酚酸A,丹参酮类成分—丹参酮IIA、丹参酮I、隐丹参酮、二氢丹参酮(TSN IIA,TSN I,CTSN,DHTSN)的含量测定,同时以UHPLC-Q-TOF/MS的方法实现25类丹参酮类成分的相对定量分析[5,6]。
1.6.1 LC-MS/MS技术定量测定主要酚酸类成分
色谱条件:色谱柱为安捷伦ZORBAX SB-C18 色谱柱(2.1×100 mm,3.5 μm);流动相为2 mmol·L-1醋酸铵-0.1%甲酸-乙腈,梯度洗脱:7%乙腈(0-2 min),7%-95%乙腈(2-3 min),95%乙腈(3.5-8 min),后运行时间6.5 min;流速0.3 mL·min-1;进样量:5 L;柱温35℃。
质谱条件:离子源为电喷雾离子源;离子化模式为负离子模式;离子源温度105℃;干燥气和雾化气为氮气,干燥气温度350℃,流速10 L·min-1;雾化压力40 psi;离子喷雾电压4000 V;碰撞气为高纯氮气,压力0.1 MPa。目标化合物检测采用多反应监测模式(Multiple reactions monitoring mode,MRM)。
对照品和供试品溶液的配制:对照品分取1 mg配成终浓度1 mg·mL-1的母液,用甲醇稀释各储备液配制成酚酸类成分标准系列工作液。供试品材料适量磨粉过100 目筛,分取0.1 mg 粉末置于10 mL 容量瓶,加入甲醇至刻度线,称重,超声30 min,冷却后补足失重。取100 L提取液于35℃,2000 rpm转速下挥干,10倍体积复溶,复溶液于4℃离心30 min后分取上清作为供试品溶液。
1.6.2 LC-MS/MS技术定量测定主要丹参酮类成分含量
色谱条件:色谱柱为沃特世XSELECT CST-C18色谱柱(2.1×50 mm,2.5 μm);流动相为2 mmol·L-1醋酸铵-0.1%甲酸-乙腈,60%乙腈等度洗脱,洗脱时间5 min;流速0.3 mL·min-1;进样量:5 L;柱温35℃。
质谱条件:离子化模式为正离子模式;其余同上。对照品和供试品溶液的配制同上。
1.6.3 UHPLC-Q-TOF/MS 技术相对定量测定丹参酮类成分
色谱条件:色谱柱为沃特世ACQUITY UPLC HSS T3色谱柱(2.1 X 100 mm,1.8 μm);流动相:0.1%甲酸-乙腈,梯度洗脱,流动相为0.2%甲酸-乙腈,梯度洗脱:5%-95%乙腈(0-20 min),后运行时间3 min;流速0.3 mL·min-1;进样量:3 L;柱温30℃。
质谱条件:采用双喷流电喷雾离子源,正离子模式扫描,以高纯氮气作为雾化电离气,设置干燥气温度350℃,流速11 L·min-1,雾化气压45 psi,鞘气温度、流速设置与干燥气相同,毛细管电压4 kV,碎片电压120 V,锥孔电压60 V,采集范围为100-1700 m·z-1。仪器使用前以调谐液对仪器进行校正,使用过程中不间断加入参比液进行质量校准。
对照品和供试品溶液的配制:精密称取内标化合物华法林标准品1 mg 置1 mL 容量瓶内加入甲醇配制成浓度为1 mg·mL-1溶液作标准内标储备液。用甲醇稀释储备液至终浓度为20 ng·mL-1作内标溶液;其余标准品溶液处理同上。
1.7 丹参商品规格等级同活性成分的关联分析
丹参定级后,分别以药典中规定的指征性活性成分:丹酚酸B 和总丹参酮含量为统计参数,以SPSS 21.0软件对不同等级样品中的活性成分含量进行正态性分布检验,,将符合正态性分布的活性成分含量以完全随机设计的单因素方差分析(ANOVA)进行统计分析。同时将测定的活性成分含量结果以log10 算法进行归一化处理,以SIMCA-P V11.5.0 Demo对均一化的数据进行主成分分析考察群体样本间的离散情况。
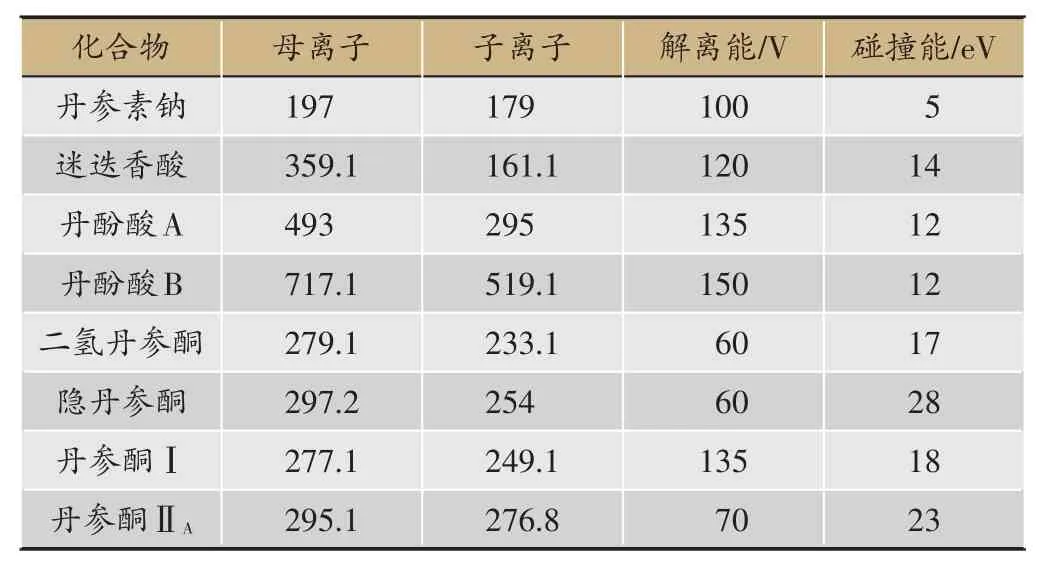
表1 丹酚酸和丹参酮类成分MRM参数。
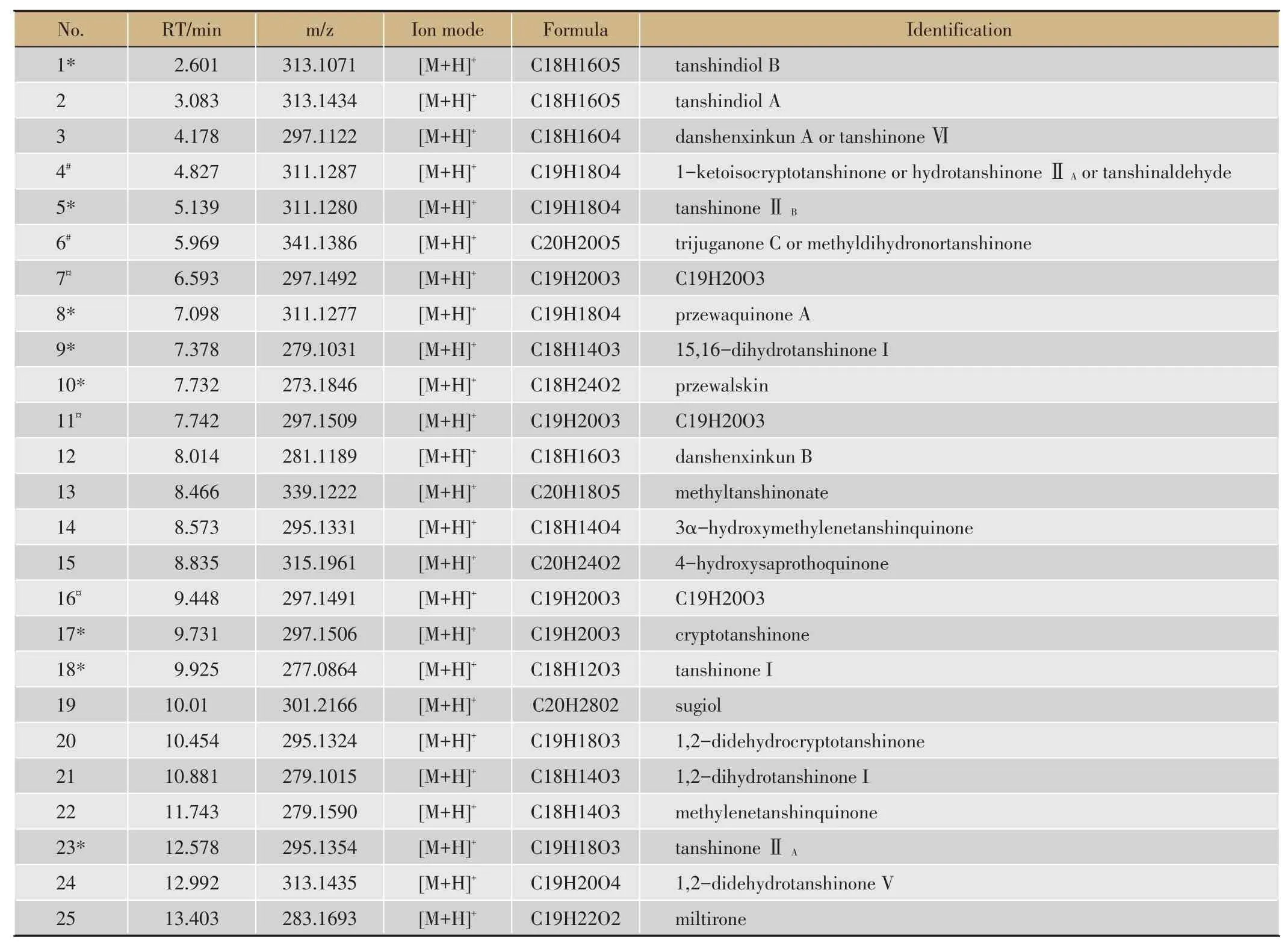
表2 相对定量测定的丹参酮类成分列表。
1.8 丹参样品的重新分级
严格按照《中国药典》(2015 版)中丹参指征性活性成分的含量限度要求,对已完成含量测定的丹参样品进行重新分组。本批样品中丹酚酸B的含量远高于药典标准,故最后仅以总丹参酮的含量作为分组标准。按照药典规定的总丹参酮含量不得低于0.25%的限度要求将现有丹参材料分为合格组和不合格组,合格组总丹参酮含量不低于0.25%,不合格组总丹参酮含量低于0.25%。
1.9 丹参根系结构特征的研究分析
根系在不破坏整体结构的条件下,清洗去除泥沙等杂质后经WinRHIZO系统配备高分辨率扫描仪进行扫描获得高分辨率图像(300 dpi),然后图像经WinRHIZO和ImageJ软件获得丹参根系结构特征参数[7-10]。
将保存在固定液中的丹参厚片制作成石蜡切片并经番红固绿染色,染色切片经高通量快速切片扫描仪扫描后,使用Pannoramic Viewer对切片进行图片获取,根据统一比例尺(2000 M)调整切片图像尺寸,然后图像经RootScan软件依次识别皮层组织、木质部结构,完成各类细胞识别计数,获得丹参根系组织分布特征数据[8]。
1.10 构建丹参根系“表型-化学特征”关联性分析
首先对数据进行预处理。对于数据严重缺失的参数可以采用手动去除,对于无法判断的参数本研究采用格拉布斯(Grubbs'test)检验进行异常值的筛选,将组内单一植物样品的每个性状参数进行假定正态分布分析(Assumption of normal distribution),将离群值所指征的表型特征删除,并进行迭代测试直到无异常值存在。而后基于皮尔斯相关系数(Pearson Correlation Coefficient)构建有效参数的“表型-化学特征”相关性网络。
1.11 拟合丹参品质评价模型
随机筛选合格组和不合格组内各2/3的样本设为测试集,以二元Logistic回归统计分析的方法建立品质评价模型,以验证集验证该模型。
1.12 丹参活性成分组织分布特异性研究
以LC-MS/MS的方法测定拆分后丹参各组织结构中的主要活性成分含量,用log10 算法对丹参样品中主要活性成分的含量进行归一化处理,经主成分分析和层次聚类分析后获得丹参根系主要活性成分的分布差异情况。
2 结果与分析
2.1 丹参药材的定档分级结果
严格按照商品规格标准将丹参样品材料分为一等品、二等品和等外三个规格,其中一等品39 个,占比38.24%,二等品59 个,占比57.84%,等外4 个,占比3.92%。
2.2 丹参商品规格等级同活性成分的关联分析
统计分析结果显示一等品中丹酚酸B和总丹参酮含量均略高其他等级,但不同等级间样品并不存在显著性差异(图1-A,B)。主成分分析结果显示对于丹参酮类成分,无论是以药典中规定的丹参酮ⅡA、丹参酮Ⅰ和隐丹参酮作为分析指标,抑或是增加分析指标,以相对定量测定的25种丹参酮类成分作为分析指标,不同等级间样品均无法实现聚类(图1-C,D,E)。与上述结果相似,以丹酚酸类成分—丹酚酸B、丹酚酸A、迷迭香酸、丹参素钠作为分析指标,不同等级间样品同样无法实现聚类(图1-F)。
上述研究结果表明现行的商品规格标准存在一定的局限性和不合理性。为了对现行商品规格标准进行补充,我们以药典中所规定的指征性活性成分含量作为分级标准对丹参样品进行重新分级,然后以单一性状特征或多个性状特征连锁分型同活性成分构建相关性分析,发现真正具有品质指征作用的关键性状,最后通过拟合评价模型验证性状的品质指征作用。

图1 不同商品规格等级丹参样品的活性成分含量差异情况
2.3 丹参样品的重新分级结果
图2显示丹参样品中丹酚酸B的含量远高于药典标准,故仅以总丹参酮的含量作为分组标准。重新分组标准为合格组总丹参酮含量不低于0.25%,不合格组总丹参酮含量低于0.25%。重新分组结果为合格组共计90 个,占比88.24%,合格组共计12 个,占比11.76%。
2.4 构建丹参根系“表型-化学特征”关联性分析

图2 丹参样品中丹酚酸B(LAB)(A)和总丹参酮(B)含量分布散点图
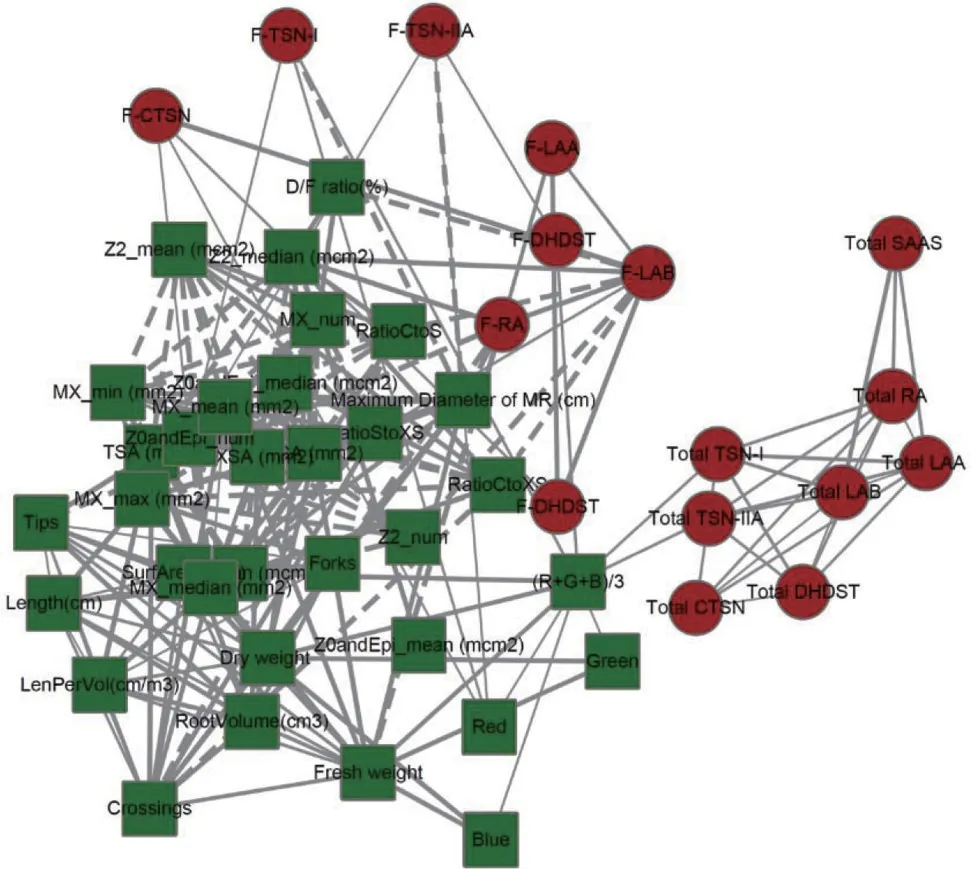
图3 丹参根系表型与代谢物累积相关性网络
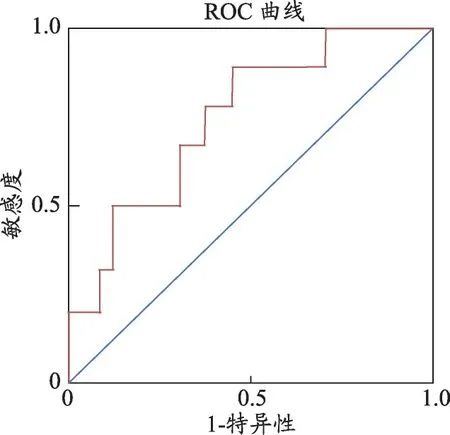
图4 拟合评价模型的ROC曲线
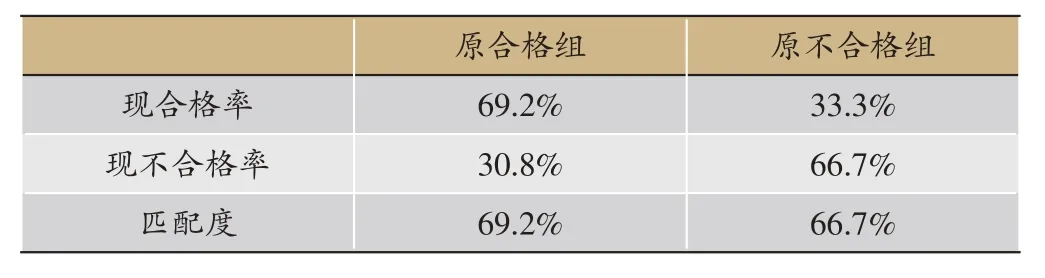
表4 验证集内丹参样品重新分组结果
通过数据预处理共剔除异常参数31项,所剔除参数均为表型参数。而后构建有效参数的“表型-化学特征”相关性网络。构建的“表型-化学特征”相关性网络(图3)显示共有49个参数间具有显著相关性(P <0.05),其中表型参数33个,化学参数16个,共呈现390组关联,343 组关联为正相关,47 组为负相关,其中极显著关联(P <0.01)188组,多发生在表型特征参数之间。利用Cytoscape 软件对关联性进行关联性网络可视化构建,发现整个网络可以明显分为两个聚类,表型参数可分为一类,化学特征参数可分为一类。其中个别表型参数,不仅与其他表型参数具有显著关联性,同时也与化学特征参数之间具有显著关联性,表明该表型特征与活性成分含量水平具有一定的关联性,可以作为具有品质指征性作用的候选性状。与活性成分具有极显著差异的表型特征有6 个,分别是与丹参酮I、丹参酮IIA、和隐丹参酮的含量具有正相关性的红色色度值(Red),与丹参酮I的含量具有正相关性的绿色色度值(Green),与丹参酮I、二氢丹参酮的含量具有正相关的平均色度值((R+G+B)/3);与丹参酮I、丹参酮IIA和迷迭香酸的含量具有负相关的主根最大直径(Maximum Diamater of MR,MD);与丹酚酸B含量具有负相关,但与丹参酮IIA、的含量具有正相关的形成层外区域占比(RatioCtoXS)以及与丹酚酸B 含量具有负相关,但与丹参酮I、隐丹参酮的含量具有正相关的形成层外内面积比(RatioCtoS)。其中形成层外内面积比以及形成层外区域占比在生物学意义上具有重复性,故仅只以最大直径、色度值(Red、Green、R+G+B)/3)、切面形成层外内面积比作为具有品质指征性作用的候选性状。
2.5 丹参品质评价模型
以最大直径、色度值(Red、Green、R+G+B)/3)、切面形成层外内面积比作为模型参数以二元Logistic回归统计分析的方法建立品质评价模型,获得经过logit转换的公式如下:

利用得到的预测概率P 值进行ROC 曲线分析(图4),其曲线下面积为0.703,P <0.05,敏感度87.5%,特异性55.0%,表明该模型具有一定的准确性。以验证集验证该模型,将验证集内样品按上述评价模型重新分组(表4),其中原合格组内样品重新分组后的合格率为69.2%,原不合格组内样品重新分组后的不合格率为66.7%,即该模型验证后对于合格组和不合格组而言其匹配度分别为69.2%和66.7%。上述匹配结果表明该模型具有一定的准确性,所挑选的关键性状具有品质指征作用。
进一步分析筛选出来的关键性状特征,发现最大直径、根系表面色度值、切面形成层外内面积比均为切面特征或切面相关特征。切面特征是中药传统鉴定中的一个重要指标,是传统性状鉴定的重要判断依据。在已有的中药材性状研究中发现主要有效成分多分布在薄壁细胞中,薄壁细胞较多的结构所占比例越大,相应的有效成分量越高,甚至可以表现出某些质地特征[3]。所以通过解析活性成分的组织分布特异性可以实现对关键性状特征形成机制的探索。
2.6 丹参活性成分组织分布特异性
丹参样品中主要活性成分的含量归一化处理后经主成分分析和层次聚类分析获得丹参根中主要活性成分的组织分布差异情况。结果(图5)显示,不同组织结构样本表现出较明显的聚类和分离,无论是酚酸类成分或是丹参酮类成分,总体均可以分为两个集合簇,其中周皮样本(图中以绿色表示)聚类在一起,而木质部和韧皮部样本(图中蓝色表示木质部样本,红色为韧皮部+皮层样本)混合聚类在一起。结果提示我们造成上述聚类结果的原因可能是丹参不同组织中活性成分种类和含量有所差异。故进一步以层次聚类分析的方法来解释上述结果。热图(图6)显示不同种类的活性成分的组织分布特异性,结果表明丹参酮类和酚酸类两类化合物具有明显区别的组织分布规律:以丹酚酸B 为代表的酚酸类在根的各组织结构中均有分布,但在木质部和韧皮部中的含量远高于周皮层内,与之不同的是丹参酮类成分则主要分布在周皮层。
同时,根据已发表丹参转录组数据(Accession:SRX753381,SRR1640458,SRP028388,SRP051564),分析丹参各组织结构中参与丹参酚酸类途径和丹参酮类途径的关键通路基因的转录变化情况,发现参与MEP 途径的关键酶基因SmDXSs、SmDXR、SmMCT、SmCMK、SmMDS、SmHDS、SmHDRs、SmIPI 和SmGGPPSs,参与MVA 途径的关键酶基因SmAACTs、SmHMGSs、SmHMGRs、SmMK、SmPMK、SmMDCs、SmIPI、和SmGGPPSs以及丹参酮合成途径的关键酶基因SmCPS1、SmKSL1 和CYP76AH1 主要在周皮层富集表达,而参与酚酸类途径的关键酶基因SmPALs、SmC4Hs、Sm4CLs、SmTATs、SmHPPRs、SmRASs 和SmCYP98A78 在周皮层中的表达量相对较低,而主要于木质部和韧皮部内相对高表达[11,12]。基因转录表达结果与代谢检测结果具有一致性,证明了丹参酮类和酚酸类两类化合物的组织特异性形成主要是由于活性成分合成部位具有组织特异性而非转运机制的参与。
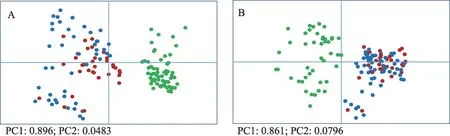
图5 丹参主要酚酸类成分(A)和丹参酮类成分(B)的组织分布差异
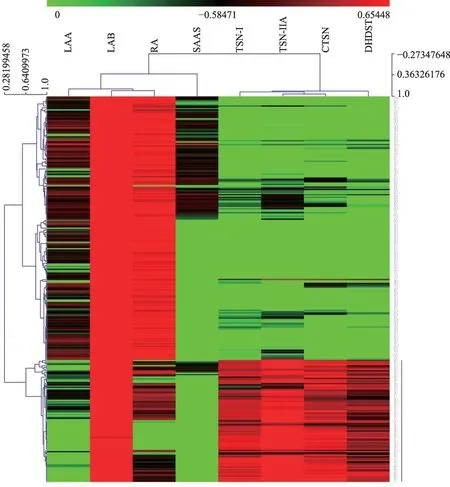
图6 丹参不同组织结构中主要活性成分的分布差异热图
以活性成分组织特异性的规律来探索关联性的内在机制:丹参酮类化合物多呈橘红色,大量积累在周皮结构,使根呈现红色,所以“色越红”表明该原药材中含有的丹参酮类成分含量越高;根越粗,相应的根比表面积值会减小,周皮结构相对体积减小,导致丹参酮类成分的含量水平降低;形成层内外面积比影响的各组织结构的相对比例,从而影响丹参酮的含量。
3 总结与讨论
传统中药的“辨状论质”是在上千年中药材使用过程中得出的经验总结,合理性与局限性并存,利用现代科学阐明其科学内涵并进行修正,是科学合理地传承“辨状论质”的必由之路。“辨状论质”的科学内涵即利用科学手段解释中药“状”与“质”直接的关联。鉴于中药的品种、性状特征、应用部位等存在复杂的多样性,长期以来并未形成系统性的研究体系,主要问题在于难以将性状特征进行高效准确的量化和分析,同时无法有效地构建性状特征与有效成分累积之间的关联[3]。本研究针对丹参根系为药用部位的特点,利用植物表型组学的概念,尝试探究丹参药材品质的内涵,为建立合理可行的丹参商品规格标准提供参考。
首先,我们以活性成分为评判标准,比较现行丹参药材的“商品规格”和《中国药典》(2015 版)规定的丹参药材标准是一致。结果显示,简单的依据尺寸、形态来分级的“商品规格”并不能完全准确地反映出药材的活性成分水平,从而难以准确反映其药效物质基础。此外,不难想象,除了丹参,这种商品规格与药材真实品质不一致的状况必然在其他药材中普遍存在。可见,有必要找寻出性状特征与活性成分,与药效的相关性。
为了发现能够明确指征丹参品质的形态特征,针对丹参药材的特性,本研究整合了多种植物根系形态分析的软件,经过筛选,可以快速获取丹参药材的形态特征参数。利用高通量的图像分析可以获得多种形态特征参数,极大地提高参数获得的速度和准确度,同时,还可以获得许多通过手工测量或者直接观察无法获得的数据,比如预测根系的总表面积、组织分布比例、根系结构等参数。结合代谢分析,构建形态参数—活性成分的关联网络,进而筛选出关键特征,用以拟合丹参品质评价模型。虽然该模型尚待通过大量样本的纠正以及验证,且从理论到实际应用尚存在很长的距离,但本研究依然为中药材“辨状论质”科学内涵研究提供了研究新思路和新方法,以多科学手段讨论药材的质量,更可进一步对药材的质量标准或是商品规格的指定提供参考。
