风湿定胶囊治疗类风湿关节炎模型大鼠的相关机制研究
2019-09-13王景靓徐晓峰张家国
王景靓,徐晓峰,张家国
(辽宁省大连市第二人民医院骨科,辽宁 大连 116011)
类风湿关节炎(RA)属常见自身免疫性疾病,主要病理表现为多个关节滑膜的炎症、增生等,如不及时有效地治疗,随着病情的不断进展,会出现不同程度的关节畸形及活动功能障碍[1]。近年来,中医药低毒性及多靶点治疗的特点越来越受到重视,已成为研发治疗RA药物的新靶点[2]。风湿定胶囊具有补气养血、扶正祛邪、驱寒除湿等功效,能治疗RA及坐骨神经痛等病症,其作用机制可能与其能调节Janus激酶/信号转导子与转录激活子(JAK /STAT)信号通路有关[3]。JAK /STAT 信号通路属诸多细胞因子发生信号转导的一个共同途径,能广泛地参与到细胞增殖、分化、凋亡,以及机体的炎性反应过程,并能依靠负调节因子同其他信号通路发生相互作用,还可通过STATs的共价修饰途径实施信号调节。此信号通路能促使各类炎症类疾病的形成和发展,对其实施靶向治疗逐渐成了当前研究的重要方向。本研究中探讨了风湿定胶囊治疗RA的作用机制。现报道如下。
1 材料与方法
1.1 动物、试药与仪器
动物:SPF级健康未交配性成熟的雄性Wistar大鼠100只,体质量为 180~220g,足趾容积为 1.70~2.30mL,购自广州中医药大学,动物合格证号为 SYXK(粤)2014-0144,予以标准饲料和水饲养,保证生存室温为18~22℃,相对湿度为40% ~50%。本试验经医院试验动物伦理委员会审批。
试药:风湿定胶囊(陕西健民制药有限公司,国药准字 Z20044165,规格为每粒 0.3 g);Ⅱ型胶原(规格为每支10 mg),完全弗氏佐剂,均购自大连宝生物工程有限公司。
仪器:总RNA提取试剂盒,逆转录试剂盒,实时荧光定量PCR试剂盒购自上海恒远生物科技有限公司;DAB显色试剂盒(武汉博士德生物技术有限公司);p-JAK3及p-STAT3单抗购自上海康朗生物科技有限公司;荧光定量PCR仪(南京贝登医疗股份有限公司);Western Blotting相关试剂盒(上海英拜生物科技有限公司)。
1.2 方法
动物分组:根据随机数字表法将大鼠分为5组,分别为空白对照组(A组),模型组(B组),风湿定胶囊低、中、高剂量组(C1组,C2组,C3组),每组 20 只。
风湿定胶囊灌胃溶液配制:按照不同剂量取风湿定胶囊加入0.9%氯化钠注射液中,制成混悬液,低、中、高剂量分别为 10,20,40 g/L,给药体积为每 100 g体质量2 mL。大鼠的风湿定胶囊灌胃浓度根据体表面积法,以临床成人给药剂量计算。
CⅡ乳剂配置:无菌条件下用0.1 mol/L冰乙酸充分溶解Ⅱ型胶原,随后置4℃冰箱过夜。于次日取出,加入等体积完全弗氏佐剂混合,经振荡乳化得CⅡ乳剂,置4℃冰箱保存。
RA模型大鼠制备:采用10%水合氯醛麻醉处理,选择大鼠背部及左右足跖多点皮下注射0.5 mL CⅡ乳剂。A组与B组予等量生理盐水,C1组,C2组,C3组分别予200,400,800 mg/(kg·d)的风湿定胶囊,连续给药 4 周。
p-JAK3及p-STAT3蛋白表达水平检测:提取各组大鼠的关节滑膜组织,置研钵内,添加300 μL的裂解液,研磨10 min,再充分振荡后放置10 min,4℃下以14 000 r/min离心 10 min,获得上清总蛋白,通过 BCA法测定蛋白浓度,再提取适量的总蛋白,通过5倍的上样缓冲液稀释后,置95℃条件下5 min。再将变性蛋白置120 g/LSDS-PAGE内实施电泳,并添入一抗 p-JAK3和p-STAT3,4℃下与辣根过氧化酶发生结合的山羊抗兔共同孵育过夜,通过BeyoECL Plus发光测定,完成后清除免疫印迹,测定甘油醛-3-磷酸脱氢酶(GAPDH),有关操作步骤同上。利用图像分析软件对条带实施灰度分析,将二者的蛋白灰度比记为表达水平。
1.3 观察指标
比较给药后 0,7,14,21,28 d 时各组大鼠的体质量与足部肿胀体积变化情况,对比给药4周后各组大鼠的p-JAK3和p-STAT3蛋白表达水平。
1.4 统计学处理
采用 SPSS 20.0统计学软件处理。计数资料以率(%)表示,行 χ2检验。计量资料以 X±s表示,行 t检验;多组间的计量资料比较实施方差分析,计算 F值。P<0.05为差异有统计学意义。
2 结果
结果见表1和表2及图1。
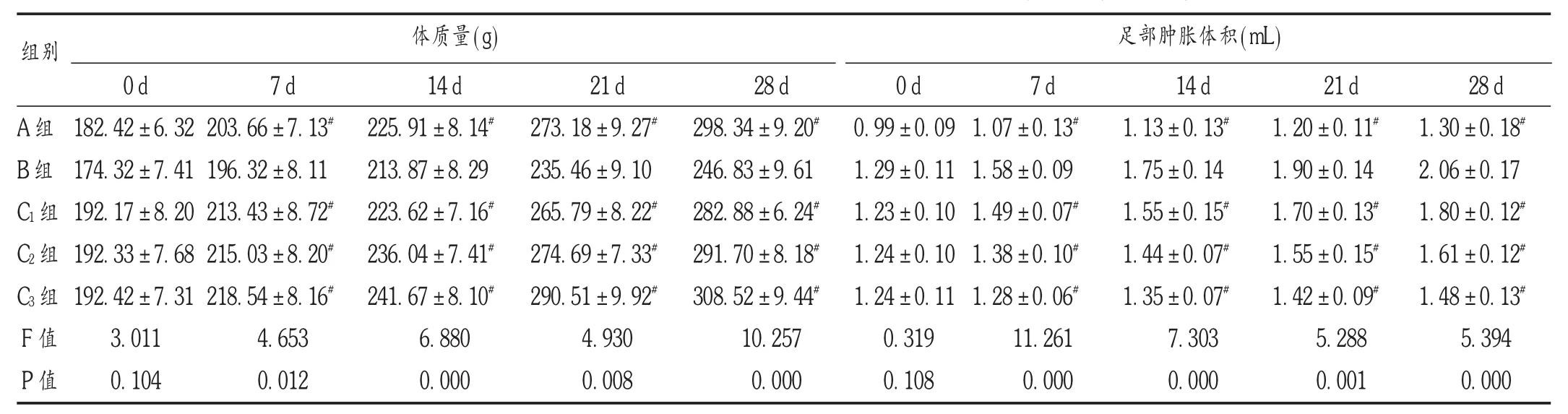
表1 各组大鼠不同时间点体质量和足部肿胀体积比较(X±s,n=20)
表2 各组大鼠滑膜组织中的p-JAK3和p-STAT3蛋白表达水平比较(s,n=20)
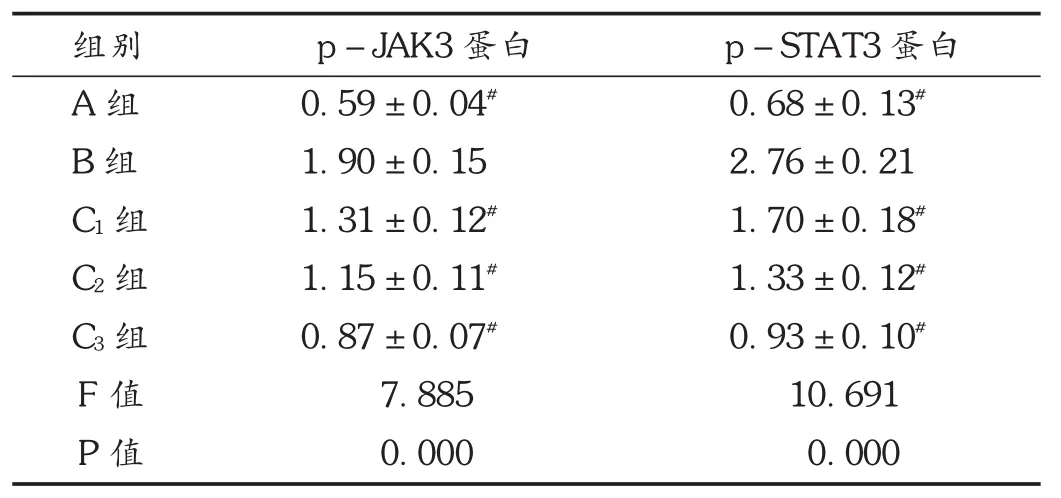
表2 各组大鼠滑膜组织中的p-JAK3和p-STAT3蛋白表达水平比较(s,n=20)
组别A组B组C1组C2组C3组F值P值p-JAK3蛋白0.59 ± 0.04#1.90 ± 0.15 1.31 ± 0.12#1.15 ± 0.11#0.87 ± 0.07#7.885 0.000 p-STAT3蛋白0.68 ± 0.13#2.76 ± 0.21 1.70 ± 0.18#1.33 ± 0.12#0.93 ± 0.10#10.691 0.000

图1 各组大鼠滑膜组织中的p-JAK3和p-STAT3蛋白表达水平
3 讨论
RA患者普遍存在不同程度的关节功能障碍,加之免疫系统失调,极易导致感染性疾病及心血管疾病[4-5]。目前,临床主要采用激素类药物治疗,但长期服用极易引发不良反应,降低患者的依从性及耐受性,不利于预后[6]。RA中医治疗主要是从病机根源“痹病”出发,辨证施治,且以扶正驱邪为主要原则。目前,中医针对RA的治疗常用有清热解毒、活血化瘀、祛风散寒等功效的复方药,虽然临床疗效明显,但其具体的作用机制尚未完全明确。
本研究结果显示,A组和风湿定胶囊给药组大鼠于7,14,21,28 d时的体质量均比B组高,且随着风湿定胶囊剂量的不断增加呈逐渐增长趋势。风湿定胶囊方中,甘草清热解毒、补气益脾、和中缓急,八角枫祛风除湿、散瘀止痛、舒筋活络,徐长卿祛风止痛、止痒消肿,白芷祛风除湿、活血排毒、生肌止痛,诸药联用,共奏镇痛、抗炎、消肿及活血通络功效,可有效改善RA的预后。A组和风湿定胶囊给药组大鼠7,14,21,28 d时的足部肿胀体积均比B组低,且随着风湿定胶囊剂量的不断增加而逐渐降低,表明风湿定胶囊有利于降低大鼠的足部肿胀体积,主要原因与风湿定胶囊能有效改善关节滑膜组织增生、炎症有关。
A组和风湿定胶囊给药组大鼠滑膜组织中的p-JAK3和p-STAT3蛋白表达水平均比B组低,且随着风湿定胶囊剂量的不断增加而呈逐渐降低趋势,这与文献[7-8]报道相符,提示风湿定胶囊可有效降低RA大鼠滑膜组织中的p-JAK3和p-STAT3蛋白表达水平与其能调节Janus激酶/信号转导子与转录激活子(JAK /STAT)信号通路等因素有关。JAK /STAT 信号通路是哺乳动物机体中较常见的一种信号转导途径,通常含有4个JAKs及7个STATs,其中JAKs属非受体类酪氨酸激酶,主要有 JAK1,JAK2,JAK3,Tyk2 等成员,相对JAK3存在7个保守性结构域,不含跨膜结构域,其C-末端的JH1和JH2域存在催化功能,而N-末端所含4个JH域不存在酪氨酸激酶的活性,但可能参与到JAKs和其他有关的信号蛋白分子互相结合过程[9-11]。STATs源自研究干扰素的信号转导机制过程,其主要包括STAT1,STAT2,STAT3,STAT4,5aSTAT,5bSTAT,STAT6等成员。STAT3是常见的家族蛋白成员,其所含有的C-末端残基构成了转录激活域,并与其他STATs成员间具有较大差异,因此可促使其与RA有关的其他转录调节信号发生联系[12-13]。此信号通路是人体内重要的多功能细胞因子转导通路,参与了体内细胞增殖分化、炎性反应、免疫调节等多种病理生理过程,并与RA的发生及进展有关。研究发现,RA大鼠治疗后关节滑膜组织中的 JAK3及 STAT1等均存在显著降低[14]。风湿定胶囊可能正是通过下调组织滑膜中的p-JAK3和p-STAT3蛋白表达水平调控JAK/STAT信号通路,发挥治疗RA的作用。
综上所述,风湿定胶囊治疗RA模型大鼠的可能机制为下调组织滑膜中p-JAK3和p-STAT3蛋白表达水平,参与JAK/STAT信号通路的调控过程,进一步发挥治疗作用。
