胰岛素抵抗状态下阿尔茨海默病大鼠模型的建立
2019-09-12张梁黄新宇黄康柏白东艳郝燕吴清龙
张梁, 黄新宇, 黄康柏, 白东艳, 郝燕, 吴清龙
(广州中医药大学针灸康复临床医学院,广东广州 510006)
阿尔茨海默病(Alzheimer’s disease,AD)的发生原因与机制到目前为止在神经科学领域仍未可知[1]。根据AD的发病原因以及各种假说,国内外众多学者已经建立了多种AD动物模型,但是均存在一定局限性[2]。目前转基因动物模型能够复制出AD的部分神经病理特征,如β-淀粉样蛋白(amyloid β-protein,Aβ)沉积、营养障碍性神经炎症、神经胶质增生等[3],但这并不能模拟出AD的全部发病过程。有研究指出,AD与胰岛素抵抗(insulin resistance,IR)有密切关联。糖尿病与AD的分子机制之间存在重叠和交叉点,胰岛素信号通路受损引起的胰岛素抵抗是2型糖尿病和AD的共同特征,说明了AD与糖尿病的强相关性。因此,胰岛素抵抗可视为AD发生的主要机制之一,AD可被认为是一种脑特异性糖尿病[4]。本研究就是以胰岛素抵抗模型大鼠——OLETF大鼠为基础,尝试建立同时具有胰岛素抵抗和AD特征的复合动物模型,探索一种较为理想并且更加接近真实病理情况的AD大鼠模型,也为深入研究AD的发病原因、发病机制及治疗方法提供理论与实验基础,现将研究结果报道如下。
1 材料与方法
1.1实验动物5周龄SPF级同品系雄性LETO大鼠12只和雄性OLETF大鼠24只,均购自于日本SLC Inc.公司。大鼠全程饲养于广州中医药大学实验动物中心,SPF级饲养环境,给予充足饲料和饮水。统一普通饮食,饲料配方按照质量比如下:小麦18%,玉米31%,稻谷4%,豆粕21%,麸皮10%,黄豆2%,鱼粉5%,蛋黄粉3%,植物油1.5%,预混料3.5%,多种维生素1%。温度:18~22℃;湿度:40%~85%;光照:12 h明/12 h暗,每日手动开关;照度:150~300 Lx。
1.2试剂与仪器D-半乳糖(批号:G0750)、三氯化铝(AlCl3)(批号:249882),购自美国Sigma公司;水合氯醛(批号:30037517),购自康达药业有限公司;葡萄糖(Glu)测试盒(货:F006-1-1),购自南京建成生物工程研究所;胰岛素(INS)酶联免疫吸附分析(ELISA)试剂盒(批号:CEA448Ra)、C肽(C-P)ELISA试剂盒(批号:CEA447Ra),购自美国Cloud-clone公司;Tau蛋白ELISA试剂盒(批号:AB32057)、Aβ ELISA试剂盒(批号:Ab22258),购自美国Abcam公司;β淀粉样前体蛋白(APP)ELISA试剂盒(货号:CSBEL001950RA)、β位淀粉样前体蛋白裂解酶1(BACE1)ELISA试剂盒(货号:CSB-E15038r),购自武汉华美生物工程有限公司;早老素1(PS1)ELISA试剂盒(货号:SEC200Ra),购自美国Cloud-Clone公司。Morris水迷宫采用DigBehv动物行为分析系统,购自上海吉量软件科技有限公司。
1.3实验分组所有大鼠适应性饲养1周,待所有大鼠适应环境后进行水迷宫测试,参照Morris水迷宫的实验方案,初步剔除不合格模型[5]。剔除标准:①定位航行平均逃避潜伏期较长的大鼠;②空间探索中跨越原平台次数较少的大鼠;③有效区停留时间较短的大鼠。将不合格的大鼠淘汰,然后进行分组。
将筛选合格的8只正常LETO大鼠作为正常LETO组。将筛选合格后的OLETF大鼠依照随机数字表[6]随机选取8只作为OLETF组,剩余OLETF大鼠进行AD造模处理。造模完成后,用Morris水迷宫进行行为学测试,再按随机数字表挑选8只大鼠作为复合模型AD-OLETF组。
1.4造模方法以胰岛素抵抗OLETF大鼠为基础对象,采用腹腔注射D-半乳糖(60 mg·kg-1·d-1)联合灌胃AlCl3溶液(50 mg·kg-1·d-1)的方法建立AD模型[7](作为AD-OLETF组)。按照10 mL/kg溶液体积配制溶液,连续造模90 d。
1.5观察指标与方法
1.5.1 行为学观察 在造模期间和造模后,观察各组大鼠的饮食、体质量、毛发、精神状态及活动情况。
1.5.2 Morris水迷宫实验 用Morris水迷宫图像自动监视处理系统完成对实验数据的采集以及处理。
1.5.3 血浆空腹血糖(FPG)、血浆FINS、血清C-P、脑脊液INS含量测定 造模前及水迷宫测试后所有大鼠禁食12 h,按照0.003 3 mL/g的剂量腹腔注射体积分数100 g/L水合氯醛将大鼠预先麻醉,眼眶静脉窦采血,检测FPG。采用ELISA法检测血浆FINS、血清C-P、脑脊液INS含量,具体步骤严格按试剂盒说明书。
1.5.4 海马组织、脑脊液Aβ、Tau及海马组织APP、BACE1、PS1含量测定 采血后,清理并暴露小脑及延髓部,用注射器针头在脑膜上开孔,向内插入细管,收集20~50 μL脑脊液。断头取脑,取大鼠海马组织。将海马分成左右两部分备用,左侧海马CA1区进行切片染色,右侧海马检测分析相关指标。采用ELISA法检测海马组织、脑脊液Aβ、Tau及海马组织APP、BACE1、PS1含量,具体步骤严格按照试剂盒说明书进行,并记录相关参数。
1.6统计方法采用SPSS 22.0统计软件进行数据分析。数据以均数±标准差(-x±s)表示。经方差齐性检验后,若方差齐用单因素方差分析,两两比较采用S-N-K法;若方差不齐用Welch分析,两两比较用Tambane’s T2。以P<0.05为差异有统计学意义。
2 结果
2.1造模前LETO大鼠和OLETF大鼠体质量、FPG、FINS水平比较表1结果显示,造模前OLETF大鼠的体质量,FPG、FINS水平均显著高于LETO大鼠(P<0.01)。

表1 造模前LETO大鼠和OLETF大鼠体质量,FPG、FINS水平比较Table 1 Comparison of body mass,FPG,FINS in LETO rats and OLETF rats before modeling(-x±s)
2.2各组大鼠Morris水迷宫实验结果表2结果显示:在前4 d的定位航行实验中,AD-OLETF组大鼠每日的逃避潜伏期较LETO组和OLETF组明显延长(P<0.01);在第5天撤除平台后,AD-OLETF组穿越原平台象限时间占总时间百分比较LETO组和OLETF组显著减少(P<0.01)。

表2 各组大鼠Morris水迷宫实验结果比较Table 2 Comparison of Morris water maze test results in various groups (-x±s)
2.3各组大鼠FPG、血浆FINS、C-P、脑脊液INS含量比较表3结果显示:OLETF组和ADOLETF组大鼠的FPG、血浆FINS、C-P含量明显高于LETO组(P<0.01)。OLETF组和AD-OLETF组大鼠脑脊液INS含量明显低于LETO组(P<0.01),且AD-OLETF组脑脊液INS含量降低更明显。
2.4各组大鼠海马组织形态学比较实验结束后,大鼠海马组织HE染色,在高倍镜(400×)下观察大鼠海马组织CA1区形态,结果见图1。LETO组:海马区神经细胞结构正常、清晰,排列整齐,细胞核呈圆或椭圆形,形状规则,核仁清晰。OLETF组:与LETO组相比,海马区神经细胞数目较少,排列基本整齐。AD-OLETF组:与LETO和OLETF组相比,海马区神经细胞损伤变形,数量较少,排列无序混乱,细胞体积增大,细胞核固缩、染色加重,且呈现不规则外形,核仁消失,部分神经细胞呈现出月牙型、多齿形等其他形态。
2.5各组大鼠海马、脑脊液中Aβ含量的比较表4结果显示:OLETF组大鼠海马、脑脊液中Aβ含量较LETO组均有所提升(P<0.01);AD-OLETF组大鼠海马、脑脊液中Aβ含量较LETO组和OLETF组均明显升高(均P<0.01)。

表3 各组大鼠FPG、血浆FINS、C-P、脑脊液INS含量比较Table 3 Comparison of the contents of FPG,plasma FINS,C-P and cerebrospinal fluid INS in various groups(-x±s)

图1 各组大鼠海马组织形态学比较(HE染色,×400)Figure 1 Comparison of morphological features of the hippocampus in various groups(by HE staining,× 400)

表4 各组海马、脑脊液中Aβ含量的比较Table 4 Comparison of the content of Aβ in the hippocampus and Cerebrospinal fluid in various groups[-x±s,ρ/(pg·mL-1)]
2.6各组大鼠海马、脑脊液中Tau蛋白含量的比较表5结果显示:AD-OLETF组大鼠海马Tau蛋白含量明显高于LETO组和OLETF组(均P<0.01);各组大鼠脑脊液Tau蛋白含量比较,差异均无统计学意义(P>0.05)。

表5 各组大鼠海马、脑脊液Tau蛋白含量的比较Table 5 Comparison of the content of Tau protein in the hippocampus and Cerebrospinal fluid in various groups[-x±s,ρ/(ng·L-1)]
2.7各组大鼠海马中APP、BACE1、PS1含量的比较表6结果显示:AD-OLETF组大鼠海马中APP、BACE1、PS1含量明显高于LETO组和OLETF组(均P<0.01)。
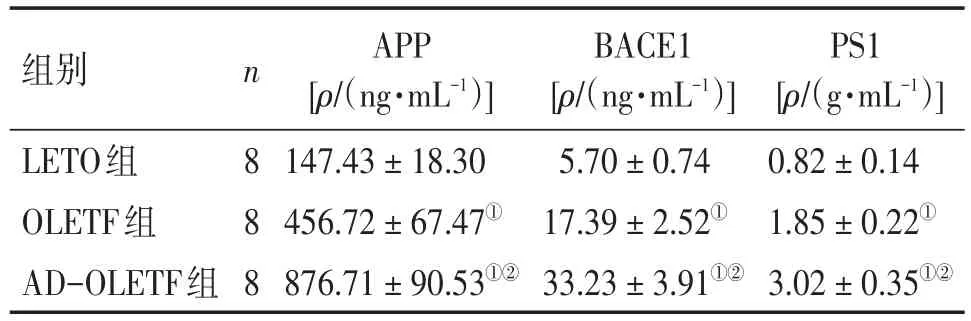
表6 各组大鼠海马中APP、BACE1、PS1含量的比较Table 6 Comparison of the content of APP,BACE1,PS1 in the hippocampus in various groups (-x±s)
3 讨论
阿尔茨海默病(AD)是一种神经退行性疾病,与记忆和认知功能障碍有关。AD主要的病理特征包括由Aβ沉淀形成的神经细胞间的大量老年斑(senile-plaques,SP)、由微管蛋白Tau过度磷酸化表达形成的神经原纤维缠结(neuro fibrillary tangles,NFTs)以及神经元的大量凋亡。有研究表明,与健康人群相比,2型糖尿病患者患AD的风险更高,其认知能力的下降幅度在20%~50%之间[8]。与血糖正常者比较,血糖受损者从轻度认知障碍(mild cognitive impairment,MCI)到AD的转化率更高,提示胰岛素抵抗在认知能力下降和AD进展中起着关键作用[9]。与糖尿病和AD进展相关的主要生物学机制尚未被阐释清楚,胰岛素信号受损、葡萄糖代谢失控、氧化应激、蛋白加工异常以及炎症通路的刺激是AD和2型糖尿病的共同特征。其中,胰岛素抵抗是AD和2型糖尿病发病的常见诱因和主要危险因素。因此,AD也被认为是“3型糖尿病”[4]。此外,一些鼻内注射胰岛素治疗AD的临床试验也说明了抗胰岛素抵抗的方法在AD治疗中具有广阔的应用前景[10,11]。
本实验的目的是设计一种专门应用在抗胰岛素抵抗治疗AD的干预措施研究上的动物模型。OLETF大鼠是一种自发性胰岛素抵抗模型大鼠,与同品系的正常大鼠LETO大鼠相比,OLETF大鼠存在的病理表现有显著肥胖,雄鼠出生18周后随着年龄的增长血糖值逐渐上升,25周时几乎所有的雄鼠都表现出高血糖并伴有高胰岛素血症,还可能出现其他表现如糖尿病肾病、糖尿病性神经症、糖尿病性视网膜症等[12]。本实验使用的OLETF大鼠模型,在造模之前其体质量、FPG、血浆FINS均明显高于LETO大鼠,符合OLETF大鼠的病理特征。
在本研究中,我们尝试在OLETF大鼠的基础上,通过使用D-半乳糖和AlCl3制作新的AD复合动物模型。有文献报道,在D-半乳糖和AlCl3的联合干预下可以制作出AD动物模型,能够引发动物记忆和学习能力障碍[13]。D-半乳糖是一种还原糖,很容易与肽和蛋白质中氨基酸的游离胺发生反应,长期低剂量服用D-半乳糖可诱导动物发生类似自然衰老过程的变化,包括认知功能障碍、氧化应激、免疫应答下降以及基因转录异常[14]。慢性全身接触D-半乳糖引起的神经毒性是研究AD机制和药物筛选的常用模型之一[15]。铝(Al)是许多日常用品的组成部分,如除臭剂、食品添加剂和药物如抗酸剂等。Al很容易渗透到人体中,在进入大脑后,Al会显著影响轴突应答,诱导炎症反应,引起突触结构异常,导致严重的神经退化[16]。人体在铝元素的环境中过度暴露会导致神经细胞中APP的过度表达和Aβ斑块的沉积,Al的神经毒性与AD等神经退行性疾病的发病机制密切相关[17]。
在造模结束后观察模型大鼠外形发现,模型AD-OLETF大鼠与正常LETO组相比,毛质粗糙、灰暗、没有光泽,质地较硬,在行为上对外界的应激性较低,反应不敏感,并且活动相对较少,几乎整日趴卧在笼中,缺乏活力。复合模型成功建立的标准是,在水迷宫实验第5天的空间探索实验中,与正常大鼠组比较,实验组大鼠的穿越平台象限时间占总时间的百分比明显减少,说明记忆受损[18]。本研究结果显示,在水迷宫前4 d的实验中,AD-OLETF组大鼠每日的逃避潜伏期较LETO组和OLETF组延长(P<0.01),表明ADOLETF组存在认知障碍。在第5天的空间探索实验中,AD-OLETF组穿越平台象限时间较LETO组和OLETF组缩短(P<0.05或P<0.01),提示模型大鼠的记忆力显著弱于正常组和OLETF组,表明造模成功。之后的海马切片观察结果显示,ADOLETF组大鼠的海马神经细胞结构异常,并呈现出混乱、无序、不规则的趋势,符合AD的特征。此外,Aβ与Tau蛋白含量显著升高,是AD的主要病理表现之一;APP、BACE1、PS1等的升高可加剧脑内Aβ沉积所形成的老年斑。这些指标的检测结果说明复合模型大鼠除了胰岛素抵抗之外,还具备AD的主要病理特征。
存在不足:本实验用于造模的D-半乳糖和AlCl3溶液的剂量是根据众多参考文献和多次预实验筛选后确定的,在正式实验中未采用多组剂量对照的方式筛选最佳搭配,有可能存在其他剂量的组合搭配也能模拟出类似的AD病理特征,在今后的实验中我们将继续探索。
本研究结果证实,以胰岛素抵抗模型大鼠为基础,运用D-半乳糖和AlCl3联合干预成功建立了一种多因素复合的AD大鼠模型。实验结果表明该动物模型在行为学以及神经病理学等方面能够较好地模拟出AD的主要特征。该动物模型可为进一步探索和研究胰岛素抵抗与AD的发病关系、发病机制以及相关治疗药物的筛选提供研究平台,也为临床上中药及针灸治疗AD提供了新的思路和方向。
