2017-2018年贵州省毕节市羊小反刍兽疫诊断及血清学监测调查
2019-09-10张平贺志昊宋德荣周大荣彭华
张平 贺志昊 宋德荣 周大荣 彭华
摘要:为切实掌握毕节市羊小反刍兽疫疫情发展趋势,增强小反刍兽疫情预警预报能力,研究对2017-2018年毕节地区部分发病羊场的小反刍兽疫羊只进行临床及实验室诊断,同时对县区利用春、秋两季集中监测及专项监测对羊小反刍兽疫免疫抗体进行血清学监测。结果显示,实验室利用荧光定量PCR方法检测更为准确。2017-2018年毕节市小反刍兽疫免疫抗体阳性率平均达80%以上,总体处于较高水平,各县区免疫抗体水平略有差异。研究调查为毕节市科学、有效防范小反刍兽疫病疫情发展趋势提供理论依据。
关键词:小反刍兽疫;抗体水平;监测评估
中图分类号:S858.26
文献标识码:B
doi:10.3969/j.issn.2096-3637.2019.24.001
0引言
小反刍兽疫(PestedesPetitsRuminants,PPR)是一种急性或者亚急性的接触性传染病,潜伏期为3~6d,最长可长21d,山羊发病时症状较绵羊严重。该病是由于感染小反刍兽疫病毒(PestedesPetitsRuminantsVirus,PPRV)而导致发病率和死亡率都较高。病羊主要是发热、水样腹泻、黑痢,口鼻有粘性、脓性分泌物,口腔黏膜溃疡、坏死,消瘦。小反刍兽疫首次在我国西藏发生。目前毕节已有该疫情发生,对毕节市畜牧业发展造成极其严重的影响。
小反刍兽疫常用的检测方法是酶联免疫吸附法(ELISA)和荧光定量RT-PCR方法。研究通过2017-2018年,对毕节市9个县(区)开展小反刍兽疫血清学与实验室诊断检测。监测结果为掌握毕节羊群小反刍兽疫免疫接种效果和感染情况,制定小反刍兽疫的防控决策提供科学依据。
1材料
1.1疫苗与诊断试剂
新疆天康畜牧生物技术股份有限公司生产的小反刍兽疫(Nigeria75/1株)弱毒活疫苗,为政府招标采购疫苗[1]。小反刍兽疫竞争ELISA检测试剂盒、小反刍兽疫荧光RT-PCR检测试剂盒,均购自中国动物卫生与流行病学中心[2]。
1.2样品采集与保存
2017-2018年,在毕节全市范围内,重点对规模养殖场、活畜交易市场和发生过小反刍兽疫疫情的区域采集羊血液、鼻拭子和部分病料样品。
1.3主要器材
酶标仪(美国伯乐BIO-RADiMark)、洗板机(美国伯乐BIO-RAD1575)、荧光PCR扩增仪(美国伯乐BIO-7500)等。
2方法
2.1临床症状观察
研究对2017-2018年毕节市各县区发生的6起小反刍兽疫疫情病例进行现场解剖及临床诊断。
2.2实验室RT-PCR检测
提取病死羊组织脏器或羊鼻腔拭子的RNA,利用荧光定量RT-PCR方法进行病毒核酸检测[3]。试验结果成立条件为,阴性对照无Ct值,同时无特定扩增曲线,阳性对照Ct值≤30并出现特定的扩增曲线[4]。待检样品Ct值≤30,且出现特定的扩增曲线判为PPRV阳性;待检样品30<Ct<37并出现特定扩增曲线判为可疑,需要重新复检,再扩增后进行检测结果判定,如仍为可疑,则可判定为阳性;被检样品Ct值≥37时,判定为阴性[5-7]。
2.3血清学监测
调查研究利用毕节市春秋防集中监测及专项监测,对毕节2017-2018年4300份羊血清进行免疫抗体监测。其中商品代养殖场2563份血清、散养户1737份血清。
3结果与分析
3.1临床症状
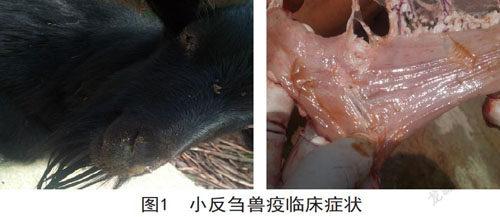
毕节发生的小反刍兽疫病例均出现精神倦怠,站立不稳,眼结膜发炎并附着有黄色粘稠物,肠系膜出血,水样腹泻,部分出现红色粪便临床症状。见图1。
3.2实验室RT-PCR检测结果
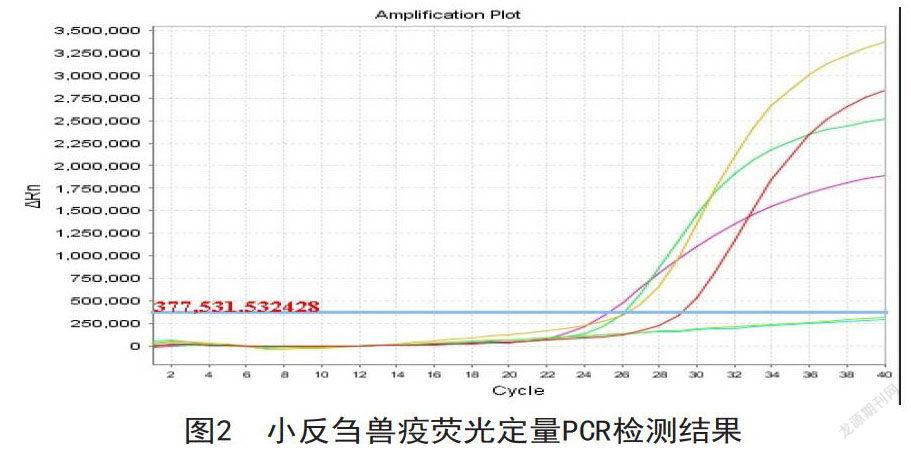
2017-2018年采集鼻拭子和组织,应用RT-PCR检测PPRV病原。病原学监测样品总数量为6份,阳性数3份,阳性率为50%,见图2。
3.3抗体监测结果
2017-2018年连续2年对毕节市免疫小反刍兽疫羊的抗体水平进行了监测。38个规模场(户)55个散养户开展小反刍兽疫抗体监测工作,检测血清样品4300份,免疫抗体合格样品3746份,免疫抗体合格率87.11%。结果显示,各年份抗体阳性率平均达到80%以上,均已经达到国家规定的70%的标准。
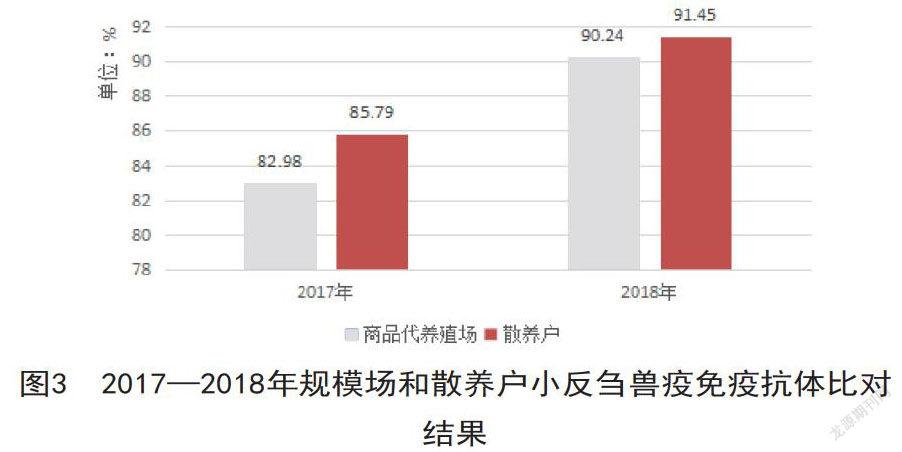
比较规模场和散养户免疫后抗体的阳性率,发现各年度二者之间的差异均不显著。其中2017年养殖场与散户的免疫抗体水平低于2018年养殖场与散户的免疫抗体水平近10个百分点,见图3,2018年呈上升态势。2017年散养户高于规模场PPR抗体阳性率近3%,2018年毕节规模场和散养户PPR抗体阳性率基本接近。
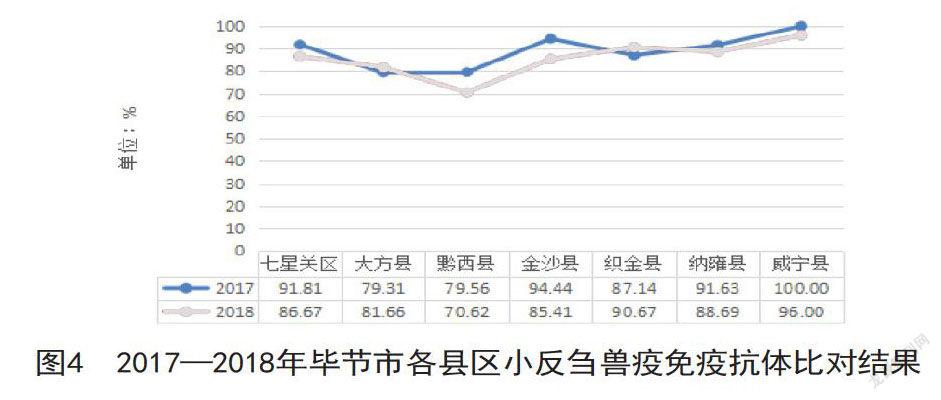
比较毕节市各个县区的免疫抗体阳性率,发现2017-2018年各个县区免疫抗体水平都在70%以上,七星关区PPR抗体水平略有下降,其中威宁县PPR抗体水平整体高于其他县,黔西县PPR抗体水平相对低于其他县区10%~26%。总体上小反刍兽疫免疫抗体水平达到农业部规定标准。见图4。
4讨论
研究对6例送检样品进行荧光定量PCR检测,其中3例呈现小反刍兽疫阳性,3例呈现阴性。通过对2年的血清学样品进行监测统计分析。结果显示毕节本地区2017年小反刍兽疫免疫抗体水平低于2018年,整体免疫抗体水平达到80%以上,呈现逐年上升趋势,商品代养殖场抗体水平整体高于散户抗体水平近10%。另外各县区免疫抗体水平参差不齐。
5结束语
PPR在毕节地区是一种新传入的动物疫病,近年由于混合感染疫病的不断出现,小反刍兽疫疫病已经不能简单的通过临床症状进行诊断,荧光定量PCR检测是一种准确、有效的诊断方法[8-9]。受于检测设备的限制,各县区实验室目前还不能进行实验室诊断,羊只发生不明原因死亡,采样送检,进行实验室检测,是确诊小反刍兽疫最直接的方式。随着小反刍兽疫免疫抗体水平逐年上升以及防疫人员免疫操作技能的不段加强,毕节地区爆发大规模的疫情的风险也随之降低。毕节坚持政府主导、社会参与、部门合作、区域协作的原则,强化省际间合作,对发现疫区运出的羊只,在采取扑杀等措施同时,及时通报相关省(区)兽医部门,防止动物疫病跨区域传播。
参考文献
[1]刘永宏,赵丽,曹胜波,等.小反刍兽疫在中国的流行趋势及应对措施[J].动物医学进展,2015,36(1):110-113.
[2]印春生,支海兵,王乐元,等.小反刍兽疫活疫苗临床试验研究[J].中国兽药杂志,2010,44(7):1-5.
[3]周子涛.国内小反刍兽疫流行现状及防控对策[J].现代农业科技,2017(10):246.
[4]次仁罗布,西藏阿里地区小反刍兽疫的流行情况与综合防控[J].山东畜牧兽医,2013(5):44-45.
[5]周海宁,宁夏羊小反芻兽疫疫情监测及防控研究[D].杨凌:西北农林科技大学,2017.
[6] Diallo A. Control of peste des petits ruminants: classical andnew generation vaccines[J]. Developmental Biology,2003,114: 113-119.
[7]贵州安顺和宁夏吴忠分别发生H5N1流感疫情和小反刍兽疫疫情[EB/OL].http://www.farmer.com.cn/jjpd/xm/slyfk/2014/3/t20140310-945250.
[8]陆则基,王志亮,刘雨田,等.西藏阿里地区小反刍兽疫流行病学调查研究[J].中国动物检疫,2008,25(12):4447.
[9]罗静,何宏轩.小反刍兽疫病毒的分子生物学特性及其在全球的流行[J].河北师范大学学报(自然科学版),2009,33(4):543-550.
