壮骨止痛胶囊调控OSX、OPN蛋白对去势 大鼠成骨细胞分化的影响
2019-09-10梁琼向旺邹佳何玲袁莉瑶刘平安张国民
梁琼 向旺 邹佳 何玲 袁莉瑶 刘平安 张国民



〔摘要〕 目的 探究壯骨止痛胶囊含药血清调控成骨相关转录因子抗体(osterix, OSX)、骨桥蛋白(osteopontin, OPN)对去势大鼠成骨细胞分化的机制。方法 50只3月龄雌性大鼠,随机分为空白组、假手术组、模型组、骨松宝组和壮骨止痛胶囊组,10只/组,除空白组及假手术组外,摘除双侧完整卵巢,然后各组分别予以相应干预,获取相应血清;10只新生SD乳鼠提取原代成骨细胞,培养至第三代后添加上述分组相应10%血清,银染及碱性磷酸酶(alkaline phosphatase, ALP)染色鉴定成骨细胞,免疫组化检测OSX、OPN蛋白的表达。结果 各组中的成骨细胞银染呈褐色、碱性磷酸酶染色呈蓝紫色;免疫组化结果表明,骨松宝组、壮骨止痛胶囊组中细胞质呈棕色;空白组和假手术组呈浅棕黄色;模型组几乎不见棕黄色。与假手术组比,模型组OSX、OPN蛋白的表达率降低(P<0.05);壮骨止痛方及骨松宝干预后OSX、OPN蛋白表达率较模型组显著升高,差异有统计学意义(P<0.05)。结论 壮骨止痛胶囊组含药血清能促进OSX、OPN蛋白分泌,从而促进成骨细胞增殖、分化,发挥抗绝经后骨质疏松作用。
〔关键词〕 壮骨止痛胶囊;骨质疏松症;含药血清;成骨相关转录因子抗体;骨桥蛋白
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.03.006
Effect of Zhuanggu Zhitong Capsule on Osteoblast Differentiation in Ovariectomized Rats by Regulating Osterix and Osteopontin
LIANG Qiong1, XIANG Wang1, ZOU Jia1, HE Ling2, YUAN Liyao1, LIU Pingan1*, ZHANG Guomin1*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated Hospital of University of South China, Hengyang, Hunan 421001, China)
〔Abstract〕 Objective To investigate the effect of Zhuanggu Zhitong Capsule-containing serum on osteoblast differentiation in ovariectomized rats by regulating osterix (OSX) and osteopontin (OPN). Methods Fifty three-month-old female rats were equally and randomly divided into blank group, sham-operation group, model group, Gusongbao group, and Zhuanggu Zhitong Capsule group. Both intact ovaries were taken for all rats except those in the blank group and the sham-operation group. And then each group was given the corresponding intervention to collect their serum. Ten neonatal Sprague-Dawley mice were used to isolate primary osteoblasts. When the primary osteoblasts were cultured to the third generation, the 10% serum from the above groups was added. Silver staining and alkaline phosphatase (ALP) staining were used to identify osteoblasts, and immunohistochemistry was used to determine the expression of OSX and OPN. Results The osteoblasts in each group were brown in silver staining assay and blue-violet in ALP staining assay. The immunohistochemical results showed that the cytoplasm was brown in the Gusongbao group and the Zhuanggu Zhitong Capsule group; the cytoplasm was light brownish yellow in the blank group and the sham-operation group; no brownish yellow was observed in the model group. Compared with the sham-operation group, the model group had significantly lower expression rates of OSX and OPN (P<0.05). The Zhuanggu Zhitong Capsule group and the Gusongbao group had significantly higher expression rates of OSX and OPN than the model group (P<0.05). Conclusion The Zhuanggu Zhitong Capsule-containing serum can promote the secretion of OSX and OPN to promote the proliferation and differentiation of osteoblasts, thus exerting anti-menopausal osteoporosis.
〔Keywords〕 Zhuanggu Zhitong Capsule; osteoporosis; serum drug containing; osterix; osteopontin
绝经后骨质疏松症(postmenopausal osteoporosis, POP)指由绝经引起的骨质疏松症(osteoporosis,OP),亦称Ⅰ型骨质疏松症[1]。POP是以单位体积内骨量绝对减少、骨组织显微结构退化、骨密度降低及骨强度减弱为特征,以致骨脆性增高及骨折危险性增加的一种全身代谢性骨病,严重威胁绝经后妇女的身体健康和生活质量[2]。POP主要发病原因为体内雌激素水平的降低,用雌激素替代疗法疗效显著,但长期使用雌激素存在副反应及停药后反跳现象[3]。目前研究认为Hedgehog信号通路可以通过上调下游靶基因成骨相关转录因子抗体(osterix,OSX)、骨桥蛋白(osteopontin,OPN)来促进成骨细胞增殖、分化,进而抗骨质疏松症[4]。本实验采用国内外公认的雌性大鼠去卵巢制备绝经后骨质疏松症病理模型,术后连续给药13周,提取含药血清100 mL。于新生SD乳鼠颅骨中提取原代成骨细胞,通过雌性大鼠去卵巢造模后制备含药血清干预调控新生SD乳鼠成骨细胞增殖分化,结合成骨细胞一般形态学、免疫组化染色及OSX、OPN蛋白的表达率等指标观察检测结果,初步探讨壮骨止痛胶囊治疗骨质疏松症的疗效及可能机制。
1 材料
1.1 动物
3月龄雌性SPF级SD大鼠50只,体质量(200±10)g;24 h内新生SD乳鼠10只,许可证号:SCXK(湘)2013-0004;均由湖南中医药大学实验动物中心提供。
1.2 药物制备
壮骨止痛胶囊(购自四川美大康药业有限责任公司,批号:201709113);骨松宝颗粒(购自贵州富华药业有限责任公司,批号:201711125)。药物用蒸馏水溶解后灌胃,2 mL/次,1次/d,药物于-20 ℃冷藏备用。
1.3 试剂
1%戊巴比妥钠;DMEM低糖培养液、胰蛋白酶、Ⅱ型胶原酶、抗青霉素抗体、抗链霉素抗体均由上海立菲生物科技公司提供,胎牛血清由浙江天杭生物科技有限公司提供;硝酸银溶液由progema生物科技公司提供;碱性磷酸酶染色试剂盒、SABC试剂盒、DAB显色试剂盒、OSX、OPN一抗试剂盒均购自武汉博士德生物有限公司。
1.4 仪器
RKI-100-BC0超净工作台(北京实验仪器厂)、2培养箱(日本池本理化工业株式会社)、OlympusCK40倒置相差显微镜(奥林巴斯有限公司)、JY3002电子天平(上海精密科学仪器有限公司)、超低温冰箱(美国REVCO公司)、LEICA DM LB2双目显微镜(德国LEICA公司)、MIAS医学图像分析系统(北航公司)、Motic B5显微摄像系统(麦克奥迪实业集团公司)。
2 方法
2.1 动物分组及造模
50只3月龄SD雌性大鼠,按随机数字表方法随机分为5组,分别为空白组、假手术组、模型组、骨松宝组、壮骨止痛胶囊组,每组10只,称质量并记录。造模方法:用1%戊巴比妥钠(0.4 mL/100 g)腹腔内注射麻醉后,将模型组、骨松宝组、壮骨止痛胶囊组摘除大鼠双侧完整卵巢;假手术组仅切除卵巢周围相应体积的脂肪组织,空白组不做任何处理。
2.2 含药血清的制备
按人-大鼠体表面积比值换算成人临床等效給药剂量,壮骨止痛胶囊:给药剂量为0.486 g/(kg·d),200 g的大鼠每只灌胃2 mL;骨松宝颗粒:给药剂量1.35 g/(kg·d),200 g大鼠每只灌胃2 mL;其他组给予相同体积的生理盐水;药物剂量每周按体质量校正1次。各组动物造模术后开始干预连续13周,1次/d,末次给药1 h后,腹主动脉取血2 mL/只;所取血液以3 000 r/min速度离心,取上层血清,56 ℃水浴灭活30 min,经0.22 μm一次性滤膜抽滤除菌,-20 ℃保存备用。
2.3 成骨细胞的分离和培养
24 h内新生SD乳鼠,放入75%的乙醇浸泡2 min,取其颅骨,刮除颅骨周围的结缔组织,用眼科剪将骨组织剪碎至1 mm×1 mm,0.25%胰酶37 ℃水浴30 min(中间振荡1次),1 000 r/min速度离心10 min,将骨片移入0.1%Ⅱ型胶原酶中,37 ℃水浴60 min(中间振荡1次);再以1 000 r/min速度离心10 min,弃上清液,加入适量DMEM培养基,接种于培养瓶;于37 ℃、5% CO2的培养箱培养,每2天换1次液,待细胞贴壁接近90%,用0.25%胰酶消化,从一个培养瓶以1∶2转移到另外2个培养瓶中传代培养,直至第3代[5]。
2.4 含药血清的添加
将培养至第三代的成骨细胞,经0.25%胰酶2 mL消化,以800 r/min速度离心10 min,弃上清液,加入适量DMEM培养基,制成细胞悬液;用细胞计数板将其调整为5×105/mL的浓度,接种至24孔板培养,24 h细胞贴壁后换成10%的含药血清培养基培养,每组12孔,继续培养24 h后备用。
2.5 细胞鉴定
2.5.1 成骨细胞一般形态学观察 将“2.3”细胞培养瓶放于倒置显微镜镜下观察,确定成骨细胞的形态及生长方式,拍照并记录[6]。
2.5.2 银染 取“2.3”细胞培养瓶中细胞在1%硝酸银溶液及紫外线照射下染色30 min,蒸馏水反复漂洗后用5%硫代硫酸钠还原,再用1%中性红复染;镜下观察成骨细胞是否有钙化结节的形成[6]。
2.5.3 碱性磷酸酶染色 取第3代细胞,6×103/L细胞浓度接种于24孔板上,细胞贴壁后开始试验,培养第7天弃培养液,按碱性磷酸酶试剂盒说明书进行偶氮偶联法对成骨细胞进行染色,测定其碱性磷酸酶活性。
2.6 免疫组化法检测OSX和OPN蛋白
将添加了含药血清的成骨细胞按通用型SABC试剂盒说明书操作,分别滴加OSX和OPN一抗抗体,37 ℃ 80 min,PBS冲洗3次,每次2 min;添加二抗,37 ℃ 20 min,PBS冲洗3次,每次2 min;滴加SABC,37 ℃ 20 min,PBS冲洗4次,每次5 min;添加DAB显色剂,显色后染成棕黄色为阳性结果。200倍光镜下用显微摄像系统随机选取5个不同视野,通过图像分析系统,选取阳性面积来评估阳性表达细胞面积占总细胞面积的百分比,最后取五个视野的平均值,即为OSX和OPN蛋白的阳性表达率。
2.7 统计学分析
用SPSS 20.0进行统计分析袁实验数据以“x±s”表示,各组数据进行方差齐性检验,如方差齐,组间差异采用单因素方差分析;如方差不齐,用秩和检验,P<0.05为差异具有统计学意义。
3 结果
3.1 成骨细胞的鉴定
3.1.1 成骨细胞的一般形态学观察 倒置显微镜下观察,细胞贴壁生长,呈梭形、有突起,单核呈卵圆形。生长状态好的细胞,由于细胞间相互促进作用,可呈铺路石状,形成不透光矿化结节。尚未传代细胞可见细胞从骨片爬出现象,而传代细胞多为梭形,较透亮。見图1。
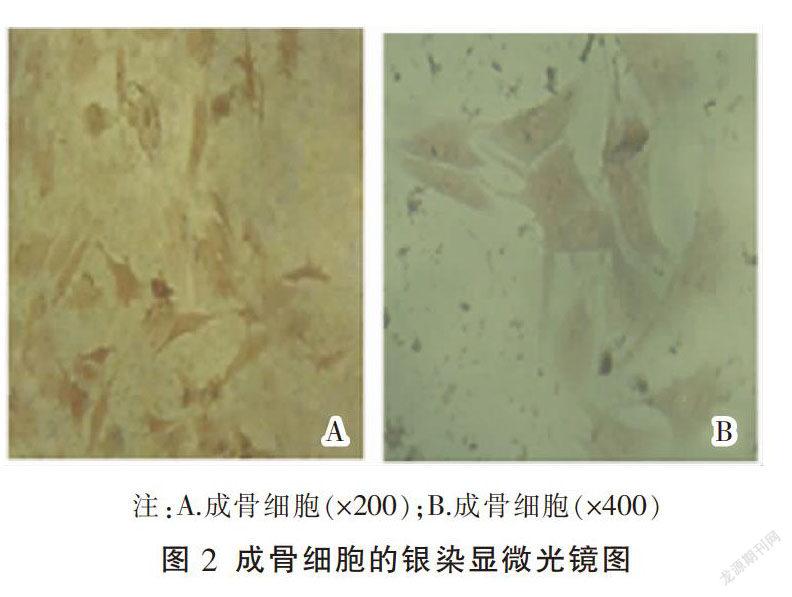
3.1.2 银染 镜下见细胞聚集,大量钙化结节形成,结节中央呈黑色,周边呈褐色,周围颜色逐渐变淡。见图2。
3.1.3 碱性磷酸酶染色 碱性磷酸酶染色镜下见细胞质染成蓝色,细胞核染成绿色,细胞呈阳性反应。见图3。
3.2 免疫组化
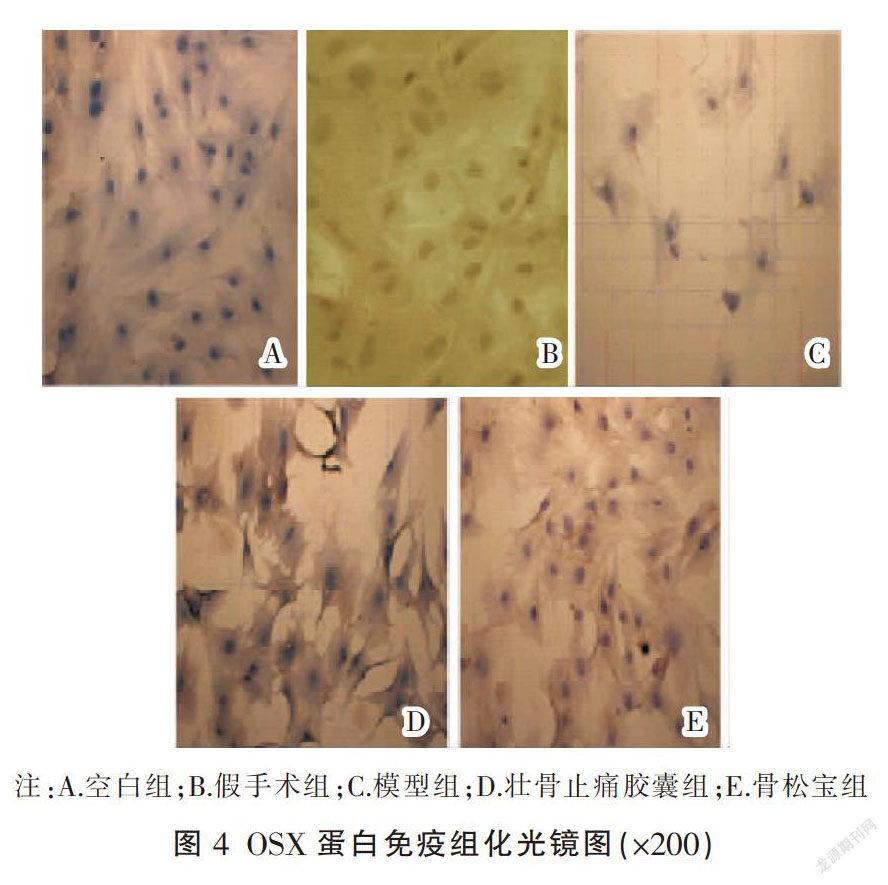
3.2.1 OSX蛋白表达 成骨细胞中蛋白的阳性表达,即为细胞膜和胞浆被染成棕黄色。模型组较空白组和假手术组的阳性细胞表达减少,而壮骨止痛胶囊组和骨松宝组较模型组明显增加,见图4。
3.2.2 OPN蛋白表达 成骨细胞中蛋白的阳性表达,即为细胞膜和胞浆被染成棕黄色,模型组较空白组和假手术组的阳性细胞表达减少,而壮骨止痛胶囊组和骨松宝组较模型组明显增加,见图5。
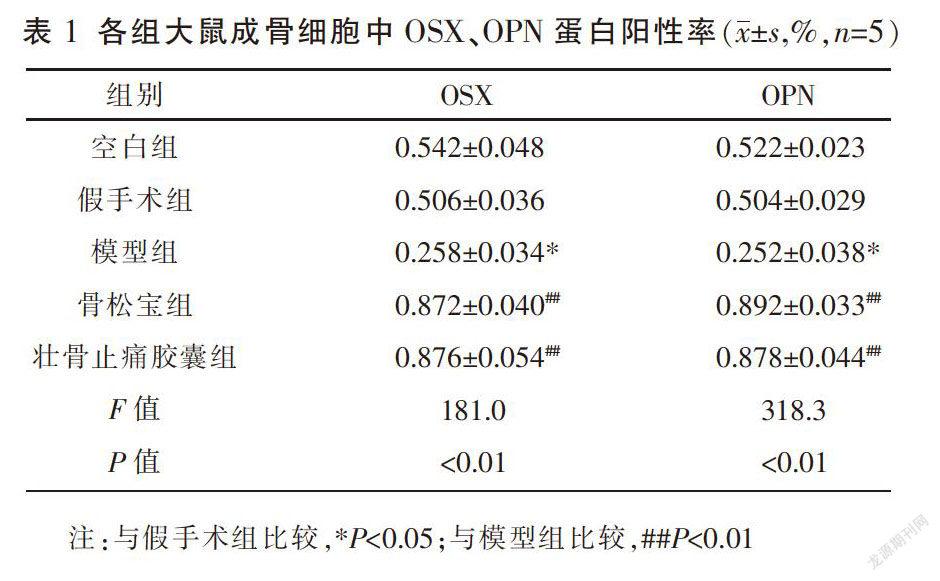
3.2.3 OSX、OPN蛋白表达率 与空白组比较,假手术组大鼠血清OSX、OPN蛋白阳性表达率差异无统计学意义(P>0.05),模型组大鼠血清OSX、OPN蛋白阳性表达率下降,差异具有统计学意义(P<0.05);与模型组比较,骨松宝组和壮骨止痛胶囊组大鼠血清OSX、OPN蛋白阳性表达率均明显升高,差异均具有统计学意义(P<0.01),见表1。
4 讨论
骨质疏松症的字义是“多孔的骨头”,是一种钙质由骨骼往血液净移动造成矿物质的流失,骨质量减少,骨骼内孔隙增大,呈现中空疏松的现象。绝经后骨质疏松症主要是由于体内雌激素下降,成骨细胞上相应雌激素受体减少,从而导致骨吸收明显加快,骨矿物质含量丢失的同时,也会出现骨小梁的退行性病变,即骨小梁变细、穿孔或消失,骨小梁数目减少,骨体积下降[7]。OP是多因素介导的复杂疾病,其流行病学研究表明老年妇女骨质疏松患病率相对较高,年龄、绝经年龄及体质量指数(body mass index, BMI)等是OP患病率的主要影响因素[8]。绝经后骨质疏松主要见于绝经后妇女,随着我国人口老龄化的进程,其发病率呈逐年上升趋势,研究绝经后骨质疏松症的防治和治疗显得尤其重要。
研究表明[9]Hedgehog信号通路参与了间充质干细胞的增殖分化、软骨细胞形成、成骨细胞形成及软骨骨化等一系列过程,此通路涉及RUNT相关的转录因子2(Runt-related transcription factor 2,Runx2)、OSX、OPN、Smads等转录因子;此外,Hedgehog通路可以通过上调Runx2来上调OSX、OPN的表达[10]。Runx2属于Runt结构域转录因子家族,是骨发育过程中骨髓基质干细胞向成骨细胞分化和成骨细胞成熟的重要转录和调控因子,Runx2过表达在成骨早起能促进成骨细胞分化,但在成骨晚期可能抑制成骨细胞的分化。在动脉粥样硬化的形成过程中,可能与血管平滑肌细胞表达Runx2的增加,使血管内皮细胞分化为成骨细胞从而导致血管的钙化有关[11]。OSX是一种具有锌指基序结构域的可促进成骨细胞增殖、分化的特异性转录因子,且为成骨前体细胞进一步分化为成熟的成骨细胞的作用靶点。OSX过表达后能增强ALP活性,提高成骨基因;若OSX表达缺失,细胞则向软骨细胞分化。另一方面,OSX位于Runx2的下游,避免了Runx2抑制成骨细胞的晚期分化的问题[12]。通过研究发现,在胚胎时期骨骺生长板中的成骨细胞存在OPN的表达[13]。成骨细胞可以分泌OPN,在骨基质的矿化过程中有重要作用。OPN分子中有富含天冬氨酸的区域,通过这区域OPN可以与组织中的轻磷灰石结合而发挥作用[14],组建骨矿质,在骨骼内含量丰富并且参与骨折愈合过程。因此通过上调OSX、OPN蛋白的表达,对成骨细胞增殖分化、软骨细胞成熟、骨基质蛋白的产生以及骨发育等方面发挥着重要作用,对防治骨质疏松症意义重大。
壮骨止痛方是湖南省中医药大学莫新民教授经验方,已获得国家新药证书(国药准字Z20050125),此方是在古方补骨脂丸的基础上结合临床用药经验研制而成,由补骨脂、淫羊藿、枸杞、骨碎补、丹参等组成,具有补益肝肾、壮骨止痛之功,经过长期的临床应用,已证实其对骨质疏松症有良好的疗效[15],但具体作用机制尚不清楚。本研究通过雌性大鼠去卵巢造模后制备含药血清干预调控新生SD乳鼠成骨细胞增殖分化,对成骨细胞进行原代培养后通过细胞形态学观察、细胞银染、碱性磷酸酶染色,确定了培养的细胞为成骨细胞。再进行免疫组化染色观察、成骨细胞OSX、OPN蛋白的表达率等检测,与模型组相比,假手术组和空白组OSX、OPN蛋白的表达率升高,壮骨止痛方及骨松宝干预后OSX、OPN蛋白表达率较模型组显著升高。依据本研究结果分析可得,壮骨止痛胶囊抗骨质疏松的作用可能与上调OSX、OPN蛋白促进成骨细胞的增殖、分化,从而促进骨形成、抑制骨吸收,使得骨量增加有关。
参考文献
[1] 刘平安,戴瑜娉,孟小莎,等.基于TGF-β-Smad通路探讨壮骨止痛方对绝经后骨质疏松症的治疗[J].湖南中医药大学学报,2016,36(7):31-34.
[2] 曾 英,李伟娟,章文娟,等.壮骨止痛胶囊对去卵巢骨质疏松大鼠骨组织Treg/Th17平衡的调节作用[J].北京中医药大学学报,2016,39(7):555-561.
[3] LEI WANG, WEI CUI, JEAN PIERRE KALALA, et a1. To investigate the effect of osteoporosis and intervertebral disc degeneration on the endplate cartilage injury in rats[J]. Asian Pacific Journal of Tropical Medicine, 2014,7(10):796-800.
[4] SHIMOYAMA A, WADA M, IKEDA F, et a1. I hh/Gli2 signaling promotes osteoblast differentiation by regulating Runx2 expression and function[J]. Molecular Biology of the Cell, 2007,18(7):2411-2418.
[5] 雷曉明.壮骨止痛胶囊对骨代谢调节因子及体外培养成骨细胞的影响[D].长沙:湖南中医学院,2004.
[6] 李晓峰,赵劲民,苏 伟,等.大鼠成骨细胞的原代培养和鉴定[J].中国组织工程研究与临床康复,2011,15(6):990-994.
[7] 甘国兴,莫新民,李劲平,等.壮骨止痛方无水乙醇提取A部位对去势雌鼠骨质疏松的疗效及机制研究[J].中国实验方剂学杂志,2011,17(17):147-150.
[8] 覃素娇,罗颖华,罗珍玉,等.广西南宁市区绝经后女性骨质疏松症流行情况及相关因素研究[J].中国骨质疏松杂志,2017,23(7):942-946.
[9] 罗 明,黄宏兴,黄 红,等.Hedgehog信号通路与骨质疏松症[J].中国骨伤,2014,27(2):169-172.
[10] AMIR L R, EVERTS V, BRONCKERS A L. Bone regeneration during distraction osteogenesis[J]. Odontology, 2009,97(2):63-75.
[11] 杨光正.Runx2、Osterix转录因子过表达驱动内皮细胞成骨分化的机制探讨[A].中华口腔医学会口腔修复学专业委员会.第十一次全国口腔修复学学术会议论文汇编[C].南京:中华口腔医学会口腔修复学专业委员会,2017:1.
[12] HONSAWEK S, TANAVALEE A, SAKDINAKIATTIKOON M.Correlation of plasma and synovial fluid osteopontin with disease severity in knee osteoarthritis[J]. Clinical Biochemistry, 2009,42(9):808-812.
[13] 张俊峰.TNF-α、IL-1α与OPN在骨关节炎滑膜中的表达及其临床意义[D].新乡:新乡医学院,2015.
[14] 王 度,戴 燚,范彦博,等.中药杜仲补骨脂对去势鼠成骨细胞增殖以及MMP3/OPN通路蛋白表达的作用[J].中国医院药学杂志,2016,36(8):620-624.
[15] 杨 军,莫新民.壮骨止痛方对骨质疏松大鼠Wnt/β-catenin、RANKL/RANK/OPG信号通路的影响[J].北京中医药,2017,36(7):611-613.
