肾透明细胞癌进展枢纽基因的WGCNA筛选
2019-09-10周忠涵赵文天官丰菊孙立江张桂铭
周忠涵 赵文天 官丰菊 孙立江 张桂铭


[摘要]目的 通过加权基因共表达网络分析(WGCNA)识别肾透明细胞癌发生及进展过程中的枢纽基因。方法从基因表达综合数据库下载GSE73731数据,通过WGCNA筛选枢纽基因,分析枢纽基因的表达水平及其与肿瘤分级、分期、预后的关系,使用GEPIA数据库和UALCAN数据库进行验证,并对枢纽模块基因进行GO和KEGG富集分析。结果通过构建共表达网络,确定green模块(包括355个基因)为枢纽模块,进一步筛选得到CEP55、CCNB1、NUF2、BUB1B、KIF14共5个枢纽基因。各枢纽基因与肾透明细胞癌组织学分级密切相关(t=17.53~25.18,P<0.01),且BUB1B基因对低级别与高级别肾透明细胞癌具有较高的诊断价值(AUC=0.706,P<0.01)。GEPIA和UALCAN数据库验证结果显示,各枢纽基因与肿瘤的分级及分期相关,且CEP55、BUB1B高表达与肿瘤的总生存期及无病生存期较差明显相关。基因功能富集分析结果显示,枢纽模块基因主要富集在细胞周期生物学过程及通路上。结论 本研究通过构建基因共表达网络筛选出5个枢纽基因,这5个基因与肿瘤的分期分级及预后密切相关;枢纽基因可能通过细胞周期相关通路来影响肾透明细胞癌的发生、进展及预后。
[关键词]癌,肾细胞;寡核苷酸序列分析;数据挖掘;枢纽基因
[中图分类号]R737.11[文献标志码]A[文章编号]2096-5532(2019)04-0392-07
[ABSTRACT]ObjectiveTo identify the hub genes associated with the development and progression of clear cell renal cell carcinoma (ccRCC) using weighted gene co-expression network analysis (WGCNA). MethodsThe dataset GSE73731 was downloaded from Gene Expression Omnibus database. Besides, the hub genes were identified using WGCNA. The correlations between the expression levels of the hub genes and tumor grade, stage, and prognosis were analyzed, and then were validated using GEPIA and UALCAN databases. Moreover, gene ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analyses were performed for the genes in hub module. ResultsThrough constructing the co-expression network, green module (involving 355 genes) was identified as the hub module. Afterwards, five hub genes (CEP55, CCNB1, NUF2, BUB1B, and KIF14) were further screened out. All the hub genes showed close correlations with the histological grade of ccRCC (t=17.53-25.18,P<0.01), and BUB1B exhibited high diagnostic values for low-grade and high-grade ccRCCs (AUC=0.706,P<0.01). The validation results of GEPIA and UALCAN databases showed that all the hub genes were associated with tumor grade and stage, and increased CEP55 and BUB1B were significantly related to poor overall survival and disease-free survival. Enrichment analysis showed that the genes in green module were mainly involved in the biological processes and pathways related to cell cycle. ConclusionFive hub genes were identified by WGCNA, which were associated with tumor grade, stage, and prognosis. These hub genes might affect the development, progression, and prognosis of ccRCC through cell cycle-associated pathways.
[KEY WORDS]carcinoma, renal cell; oligonucleotide array sequence analysis; data mining; hub genes
腎细胞癌(RCC)是泌尿系统常见肿瘤,在男性肿瘤中居第9位,在女性肿瘤中居第14位。2018年,RCC占全球新发肿瘤病例的2.2%,死亡率为1.8%,其中80%~90%为肾透明细胞癌(ccRCC)[1-2]。
尽管癌症的检测和治疗取得了很大进展,但ccRCC的总生存率仍然很低。超过1/3的病人在诊断时已经发生转移,Ⅳ期ccRCC的5年标准化相对生存率仅为6%,而Ⅰ期约为84%[3-4]。因此,研究ccRCC的发生发展机制,寻找新的生物标志物对ccRCC的早期诊断、治疗及预后判断具有重要意义。传统的“单疾病单基因”的研究模式不能从多基因协同角度了解疾病的发生与发展。本研究采用生物信息学的方法,通过加权基因共表达网络分析(WGCNA),将功能相似的基因归入同一基因模块,探究基因之间的相关性以及基因模块和临床特征之间的关联,筛选枢纽基因,以了解ccRCC发生进展过程中的关键基因及信号通路,为ccRCC治疗寻找新的靶点。
1材料与方法
1.1差异表达基因的筛选
从NCBI的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载编号GSE73731的ccRCC芯片数据集。该数据集基于GLP570平台,包括265例ccRCC组织,其中包括高分化(Furhman Ⅰ/Ⅱ)病例112例,中/低分化病例144例(Furhman Ⅲ/Ⅳ),未分级者9例。Ⅰ期病人41例,Ⅱ期病人12例,Ⅲ期病人28例,Ⅳ期病人44例,分析数据缺失140例。利用R软件中Bioconductor(http://www.bioconductor.org)内的Affy包[5]读取原始文件,使用RMA算法预处理得到标准化的基因表达谱数据。剔除离群样本,用R软件的limma包[6]对基因表达矩阵进行分析,设置校正后P值(FDR)<0.05和对数化表达变化倍数(|log2FC|)>2.0作为筛选表达差异基因的阈值,得到高分化与中/低分化ccRCC组织间的差异表达基因(DEGs),并绘制热图及火山图。
1.2基因共表达网络构建
使用R软件的WGCNA包[7],通过方差分析筛选方差前25%的基因用于WGCNA。计算各基因间的Pearson相关系数,选择适当的软阈值β使得构建的网络更符合无标度网络的标准。采用一步法构建基因网络,将邻接矩阵转化为拓扑重叠矩阵TOM,利用层次聚类产生一个基因的层次聚类树。计算基因显著性(GS)以及模块显著性(MS),用以衡量基因与临床信息的显著性,并分析模块及模型的显著关联。
1.3枢纽基因的筛选
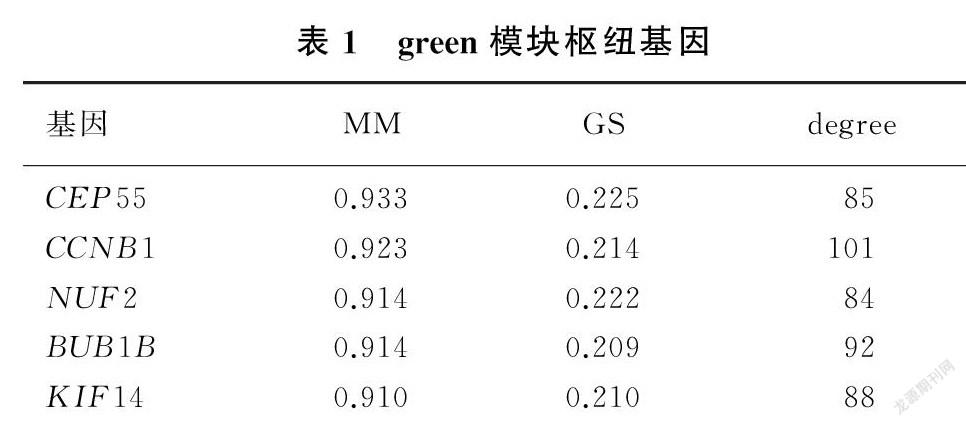
计算各基因模块身份(MM)以衡量基因在模块中的重要性。设置参数为|MM|>0.9和|GS|>0.2筛选基因。将枢纽模块中的基因上传至STRING数据库(https://string-db.org/)构建蛋白相互作用网络,选取点度中心性(degree)>80筛选基因,两者取交集即为枢纽基因。
1.4枢纽基因的表达与ccRCC分级、分期及预后的关系
使用GSE73731数据对枢纽基因进行线性回归分析,探究基因表达量与ccRCC分级之间的关系,并绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),当AUC>0.7时,认为该基因对诊断ccRCC进展具有较高的灵敏度和特异度。使用基于TCGA的GEPIA数据库(http://gepia.cancer-pku.cn/)和UALCAN数据库(http://ualcan.path.uab.edu/)分析枢纽基因在 ccRCC中的表达水平及其与肿瘤分级、分期、预后的关系。
1.5GO和KEGG富集分析
使用DAVID数据库(http://david.abcc.ncifcrf.gov/)对特定模块的基因进行GO和KEGG通路分析,以错误发现率(FDR)<0.05为差异具有统计学意义。
2结果
2.1差异表达基因筛选
使用R软件读取及预处理芯片数据后,共得到20 460个表达谱基因。以FDR<0.05和|log2FC|>5.0为阈值筛选后,得到 333个DEGs,其中上调基因152个,下调基因181个。DEGs热图及火山图见图1。
2.2基因共表达网络构建
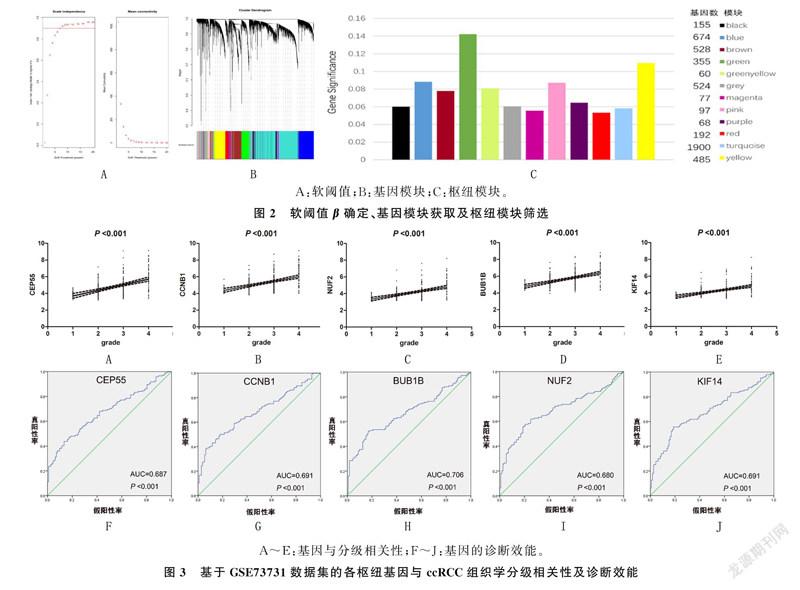
本研究通过方差分析筛选方差前25%的基因共5 115个用于WGCNA。以相关系数等于0.9作为标准,使用pickSoftThreshold函数,选择邻接矩阵权重参数(软阈值)β=6构建基因模块。使用一步法构建共表达矩阵,并利用动态混合剪切法,得到12个基因模块,其中green模块(包括355个基因)的GS高于其他模块(图2)。
因此,green模块与ccRCC病理分级的相关性最高,与肿瘤进展明显相关。
2.3枢纽基因的筛选
对green模块基因以|MM|>0.9和|GS|>0.2为参数筛选枢纽基因得到10个枢纽基因,将green模块基因上传至STRING数据库以degree>80为參数筛选枢纽基因得到23个枢纽基因,两者取交集得到CEP55、CCNB1、NUF2、BUB1B、KIF14共5个在共表达网络和蛋白相互作用网络皆重要的枢纽基因(表1)。
2.4枢纽基因的表达与ccRCC分级、分期及预后的关系
使用GSE73731数据集进行线性回归分析,结果显示各枢纽基因与ccRCC组织学分级呈正相关(t=17.53~25.18,P<0.01)。见图3A~E。ROC曲线分析,BUB1B基因对ccRCC组织学分级具有较高诊断效能(AUC=0.706,P<0.01),而CEP55、CCNB1、NUF2、KIF14对ccRCC组织学分级诊断效能较弱(AUC=0.680~0.691,P<0.01)。见图3F~J。基于TCGA的UALCAN和GEPIA数据库验证结果显示,5个枢纽基因的表达水平在肿瘤组织中均明显升高(FC=1.76~7.13,P<0.01),且与肿瘤的分级及分期明显相关。见图4。预后结果显示,CEP55、NUF2、BUB1B与肿瘤的总生存期(OS)明显相关(HR=1.5~1.9,P<0.01)。见图5A~E。CEP55、CCNB1、BUB1B、KIF14与肿瘤的无病生存期(DFS)明显相关(HR=1.6~1.7,P<0.01)。见图5F~J。
2.5GO和KEGG富集分析
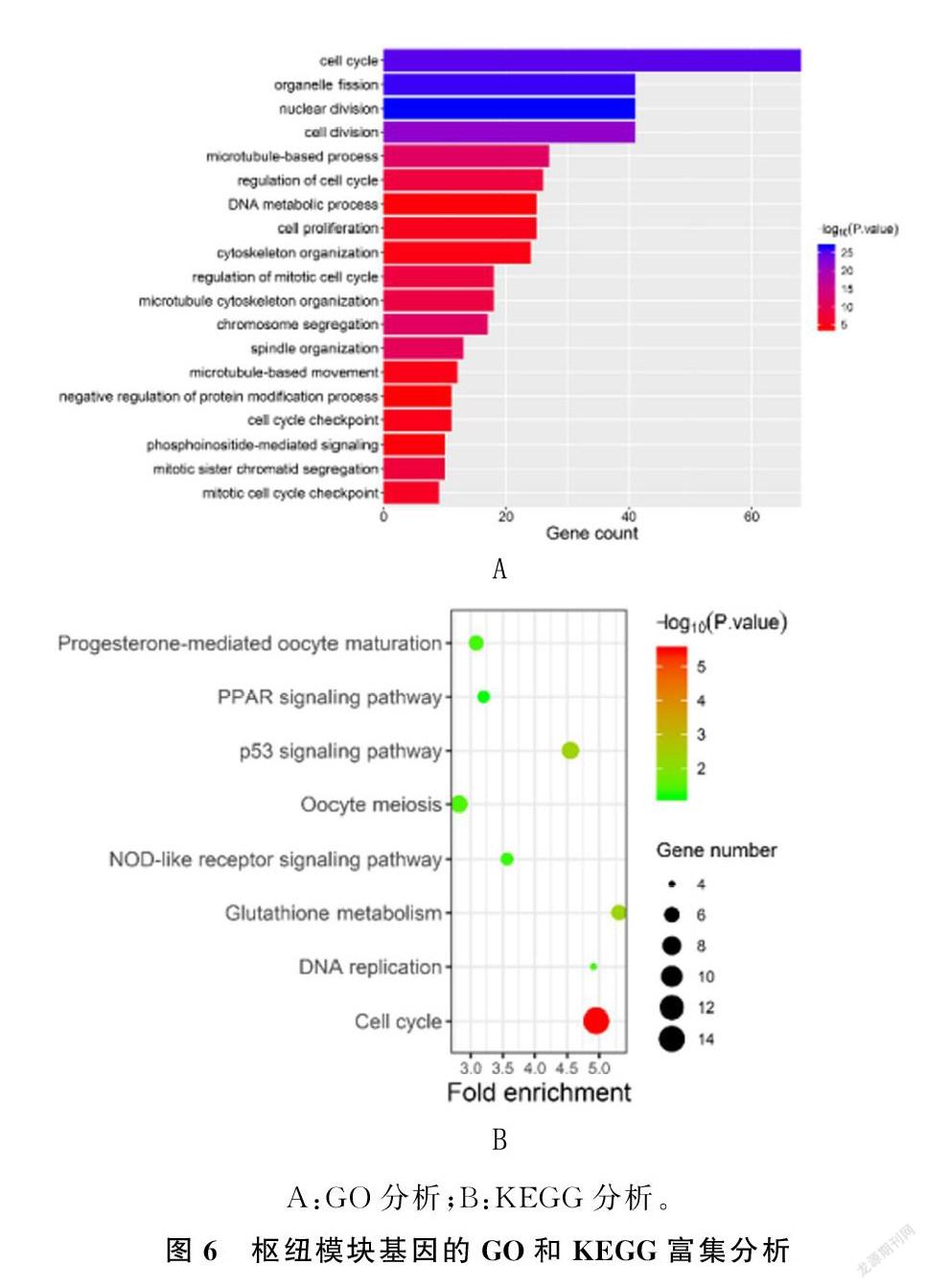
为了了解枢纽模块的可能功能,对green模块中的基因进行了GO和KEGG富集分析。GO富集分析显示,模块基因主要富集在细胞周期、细胞器分裂、核分裂等生物学过程;KEGG富集分析显示,模块基因主要富集在细胞周期通路上。见图6。
3讨论
本研究利用生物信息学方法,通过对ccRCC芯片数据集GSE73731进行分析,筛选得到表达上调基因152个,表达下调基因181个。通过WGCNA,将表达模式相似的基因进行聚类,并分析模块与特定性状或表型之间关联。结果显示,green模块与ccRCC病理分级的相关性最高,green模块内基因集与肿瘤的进展与预后密切相关。为进一步筛选在ccRCC进展过程中的关键基因,将green模块中进一步筛选出的基因与蛋白相互作用网络筛选出的基因交集,筛选出CEP55、CCNB1、NUF2、BUB1B、KIF14共5个枢纽基因。对GSE73731数据集进行线性回归分析,结果显示各枢纽基因与ccRCC组织学分级密切相关,且BUB1B基因具有较高的诊断价值,说明其能够区分不同病理分级的ccRCC。使用TCGA数据进行独立的外部验证,各枢纽基因的表达水平在肿瘤组织中均明显升高,且与肿瘤的分级及分期明显相关,说明其在ccRCC发生及进展过程中起关键作用。本文预后结果显示,CEP55、BUB1B基因与肿瘤的OS及DFS明显相关,提示CEP55和BUB1B基因对ccRCC病人的预后具有一定的预测价值。
CEP55基因编码一种中心体相关蛋白,在中间体依赖性的细胞功能如中心体复制、细胞周期及胞质分裂的调节中发挥重要作用[8]。有研究表明,在肝细胞肝癌、肺腺癌、卵巢癌、结肠癌、乳癌等肿瘤中,CEP55高表达与肿瘤的高恶性程度、高侵袭性以及不良预后相关[9-10]。CCNB1编码细胞周期蛋白B1,是细胞周期G2/M期的重要调控因子,在非小细胞肺癌、外阴鳞状细胞癌、结直肠癌中对肿瘤病人的抗药性、局部或远处转移、复发、生存等指标具有良好的预测价值[11-13]。细胞分裂相关基因NUF2编码的蛋白,作为NDC80复合体的重要组成部分之一,在动粒-微管黏附中扮演重要角色,在有丝分裂和肿瘤发生发展中起着重要作用[14-16]。BUB1B为纺锤体检测点蛋白,作为有丝分裂检测点的重要功能蛋白,调节细胞周期及有丝分裂。BUB1B在肾癌及乳癌等多种肿瘤中过表达,且其突变及过表达与染色体不稳定性、细胞分化和衰老相关,可促进肿瘤的发生及进展[17-18]。KIF4作为驱动蛋白超家族中的成员,可调节纺锤体的形成、染色体的分离和胞质分裂,其表达异常可引起染色体分离失败和胞质分裂不完全,从而引起细胞异常、增殖和分化,诱发肿瘤形成,其异常表达已经在多种恶性肿瘤中得到证实[19-21]。
本研究对枢纽模块基因进行GO和KEGG富集分析,结果显示,模块基因主要富集在细胞周期等相关生物学过程及通路上。在真核生物中,细胞周期主要受细胞周期蛋白(Cyclin)、细胞周期蛋白依赖激酶(CDK)以及细胞周期蛋白依赖激酶抑制剂(CKI)所构成的Cyclin-CDK-CKI信号网络精准调节。具有明显周期性表达的Cyclin可以与不同的CDK结合成复合物,并激活CDK的激酶活性,从而在不同时相对细胞周期进行调控。而CKI对CDK具有抑制作用。Cyclin-CDK-CKI信号网络对细胞周期的调控主要通过Rb途径和p53途径。在Rb途径中,生长因子与细胞表面受体如fos/jun/myc结合,可促进Cyclin表达并形成Cyclin-CDK复合物,磷酸化Rb蛋白后,Rb-E2F复合物释放E2F进入细胞核,促进下游DNA表达。而CKI可以抑制Cyclin-CDK活性,使得Rb去磷酸化,阻滞细胞周期进展。在p53通路中,DNA受损后,p53可结合到p21基因啟动子区,激活p21转录。P21作为重要的CKI,可抑制CDK活性,可阻滞细胞从G1期进入S期[11-12,22]。
CCNB1是细胞周期中G2/M转换的关键因子,可进入细胞核内,与CDK1结合形成CCNB1-CDK1复合物,通过Rb途径诱导细胞进入M期。当细胞退出M期时,CCNB1降解,CDK1激酶活性丧失,细胞进入下一周期[22]。一项针对骨肉瘤的研究表明,CEP55的表达水平与CCND1呈正相关,敲低CEP55表达导致CCND1表达水平降低。CCND1可与CDK4/CDK6形成复合物,调控G1期到S期的转换[23-24]。一项针对肝细胞肝癌的研究表明,敲低NUF2表达可导致CCNB1、Cdc25A、Cdc2等蛋白表达水平降低,诱导细胞周期停滞在G0/G1期,说明NUF2也可以通过Rb通路调控细胞周期[25]。一项针对多发性骨髓瘤的研究表明,BUB1B可通过介导CDC20/CCNB轴促进细胞增殖,在肿瘤进展中起重要作用[26]。有研究表明,KIF14敲低可下调Skp2和Cks1的表达,进而抑制蛋白酶体依赖性p27Kip1泛素化,p27Kip1的增加抑制细胞周期蛋白的表达,包括CCNB1、CCND1和CCNE1,从而抑制肿瘤发生及进展[25,27-28]。因此,CEP55、CCNB1、NUF2、BUB1B、KIF14等5个枢纽基因可能通过细胞周期相关通路,尤其是Rb通路,来影响ccRCC的发生、进展及预后。
综上所述,本研究通过构建基因共表达网络,筛选出与ccRCC进展相关的5个枢纽基因,这5个基因与肿瘤的分期、分级及预后密切相关;枢纽基因可能通过细胞周期相关通路来影响ccRCC的发生、进展及预后[1]。
[参考文献]
[1]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA-A Cancer Journal for Clinicians, 2018,68(6):394-424.
[2]ZNAOR A, LORTET-TIEULENT J, LAVERSANNE M A, et al. International variations and trends in renal cell carcinoma incidence and mortality[J]. European Urology, 2015,67(3):519-530.
[3]SCELO G, LAROSE T L. Epidemiology and risk factors for kidney cancer[J]. Journal of Clinical Oncology, 2018,36:3574-3581.
[4]LJUNGBERG B, BENSALAH K, CANFIELD S, et al. EAU guidelines on renal cell carcinoma:2014 update[J]. European Urology, 2015,67(5):913-924.
[5]GAUTIER L, COPE L, BOLSTAD B M, et al. Affy—analysis of affymetrix GeneChip data at the probe level[J]. Bioinformatics, 2004,20(3):307-315.
[6]RITCHIE M E, PHIPSON B, WU D, et al. Limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Research, 2015,43(7):e47.
[7]LANGFELDER P, HORVATH S. WGCNA:an R package for weighted correlation network analysis[J]. BMC Bioinforma-
tics, 2008,9:559.
[8]JEFFERY J, SINHA D, SRIHARI S, et al. Beyond cytokinesis:the emerging roles of CEP55 in tumorigenesis[J]. Oncogene, 2016,35(6):683-690.
[9]ZHANG Weijing, NIU Chunhao, HE Weiling, et al. Upregulation of centrosomal protein 55 is associated with unfavorable prognosis and tumor invasion in epithelial ovarian carcinoma[J]. Tumor Biology, 2016,37(5):6239-6254.
[10]CHENG W Y, YANG T H, ANASTASSIOU D. Biomolecular events in cancer revealed by attractor metagenes[J]. PLoS Computational Biology, 2013,9(2):e1002920.
[11]FANG Yifeng, YU Hong, LIANG Xiao, et al. Chk1-induced CCNB1 overexpression promotes cell proliferation and tumor growth in human colorectal cancer[J]. Cancer Biology & Therapy, 2014,15(9):1268-1279.
[12]PFAFF K L, KING R W. Determinants of human cyclin B1 association with mitotic chromosomes[J]. PLoS One, 2013,8(3):e59169.
[13]WANG Z, SLIPICEVIC A, FORSUND M, et al. Expression of CDK1(Tyr15), pCDK1(Thr161), cyclin B1(total)and pCyclin B1(Ser126)in vulvar squamous cell carcinoma and their relations with clinicopatological features and prognosis[J]. PLoS One, 2015,10(4):e0121398.
[14]郭云韜,喻超,陈礼闻,等. siRNA干扰沉默NUF2基因对肝癌HCCLM3细胞迁移和侵袭的影响[J]. 贵州医科大学学报, 2017,42(2):147-150.
[15]FU H L, SHAO L. Silencing of NUF2 inhibits proliferation of human osteosarcoma Saos-2 cells[J]. European Review for Medical and Pharmacological Sciences, 2016,20(6):1071-1079.
[16]HU Peng, SHANGGUAN Jianying, ZHANG Leida. Downregulation of NUF2 inhibits tumor growth and induces apoptosis by regulating lncRNA AF339813[J]. International Journal of Clinical and Experimental Pathology, 2015,8(3):2638-2648.
[17]MA Qing, LIU Yanmei, SHANG Liang, et al. The FOXM1/BUB1B signaling pathway is essential for the tumorigenicity and radioresistance of glioblastoma[J]. Oncology Reports, 2017,38(6):3367-3375.
[18]FU Xin, CHEN Guo, CAI Zhiduan, et al. Overexpression of BUB1B contributes to progression of prostate cancer and predicts poor outcome in patients with prostate cancer[J]. Onco Targets and Therapy, 2016,9(Issue 1):2211-2220.
[19]ZHANG Yixiang, YUAN Yeqing, LIANG Pei, et al. Overexpression of a novel candidate oncogene KIF14 correlates with tumor progression and poor prognosis in prostate cancer[J]. Oncotarget, 2017,8(28):45459-45469.
[20]LI K K, QI Y, XIA T, et al. The kinesin KIF14 is overexpressed in medulloblastoma and downregulation of KIF14 suppressed tumor proliferation and induced apoptosis[J]. Laboratory Investigation, 2017,97(8):946-961.
[21]QIU H L, DENG S Z, LI C, et al. High expression of KIF14 is associated with poor prognosis in patients with epithelial ovarian cancer[J]. European Review for Medical and Pharmacological Sciences, 2017,21(2):239-245.
[22]PAN Xiuwu, CHEN Lu, HONG Yi, et al. EIF3D silencing suppresses renal cell carcinoma tumorigenesis via inducing G2/M arrest through downregulation of Cyclin B1/CDK1 signaling[J]. International Journal of Oncology, 2016,48(6):2580-2590.
[23]XU Leilei, XIA Chao, SHENG Fei, et al. CEP55 promotes the proliferation and invasion of tumour cells via the AKT signalling pathway in osteosarcoma[J]. Carcinogenesis, 2018,39(4):623-631.
[24]ZHAO W M, SEKI A, FANG G W. Cep55, a microtubule-bundling protein, associates with centralspindlin to control the midbody integrity and cell abscission during cytokinesis[J]. Molecular Biology of the Cell, 2006,17(9):3881-3896.
[HJ2mm]
[25]LIU Qiang, DAI Shejiao, LI Hong, et al. Silencing of NUF2 inhibits tumor growth and induces apoptosis in human hepatocellular carcinomas[J]. Asian Pacific Journal of Cancer Prevention, 2014,15(20):8623-8629.
[26]YANG Ye, GU Chunyan, LUO Chen, et al. BUB1B promotes multiple myeloma cell proliferation through CDC20/CCNB axis[J]. Medical Oncology, 2015,32(3):81.
[27]XU H, CHOE C, SHIN S H, et al. Silencing of KIF14 interferes with cell cycle progression and cytokinesis by blocking the p27Kip1 ubiquitination pathway in hepatocellular carcinoma[J]. Experimental & Molecular Medicinee, 2014,46(5):e97.
[28]HUANG S K, QIAN J X, YUAN B Q, et al. SiRNA-mediated knockdown against NUF2 suppresses tumor growth and induces cell apoptosis in human glioma cells[J]. Cellular and Molecular Biology, 2014,60(4):30-36.
(本文編辑 马伟平)