百合鳞茎发育过程中淀粉合成相关酶基因的克隆及表达分析
2019-09-10张进忠孙嘉曼李朝生韦莉萍范燕萍
张进忠 孙嘉曼 李朝生 韦莉萍 范燕萍




摘 要:該研究通过同源克隆技术克隆腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、颗粒结合淀粉合酶(GBSS)和可溶性淀粉合酶(SSS)3类百合淀粉合成关键酶基因,分析这三类淀粉合成关键酶基因的表达变化,测定百合鳞茎膨大发育中淀粉含量变化。结果表明:(1)AGPase具有GlgC家族蛋白PLN02241蛋白结构特征及cl11394家族蛋白ADP_Glucose_PP与NTP_transferase结构域,获登录号KP751443;GBSS与SSS具有cl10013家族蛋白Glyco_transf_5,GT1_Glycogen_synthase_DULL1_like结构域,获登录号分别为KP751444、KP751445。(2)百合鳞茎形成与膨大发育过程中,淀粉含量呈现递增趋势,鳞茎盘开始分化茎杆时其淀粉含量最高,达到44.52%。鳞茎与叶片部位的三个淀粉合成相关酶基因表达量均逐渐增加;在鳞茎膨大后茎杆分化阶段,三个淀粉合成相关酶基因表达量达到最高,AGPase、GBSS、SSS在鳞片中的表达量分别为10.79,6.92和5.12,叶片中的表达量分别为6.79,5.22和4.41,鳞片中的表达量大幅度高于叶片;淀粉合成相关酶基因的表达量变化与淀粉含量、鳞茎的膨大发育成正相关。这为鳞茎的繁殖生产提供了可通过调节淀粉合成关键酶基因表达促进百合鳞茎膨大发育的思路。
关键词:百合, 淀粉合成, 鳞茎膨大, 腺苷二磷酸葡萄糖焦磷酸化酶, 荧光定量PCR
中图分类号:Q943.2, Q786
文献标识码:A
文章编号:1000-3142(2019)04-0446-07
Abstract:The key enzyme genes of lily starch synthesis, ADP glucose pyrophosphorylase (AGPase), granule binding starch synthase (GBSS) and soluble starch synthase (SSS), were cloned by homologous cloning, and the bioinformatics analysis was performed. The bulblets and leaves of lilyduring the four stages of bulblet swellingdevelopment were used todetermine the starch content in bulblets atdifferent stages, and the expression of the key genes encoding starch synthesis-related enzymes in the process of bulblet swellingdevelopment were analyzed using fluorescence quantitative PCR. The results were as follows:(1) AGPase had PLN02241 proteindomain belonging to GlgC family protein and ADP_Glucose_PP and NTP_transferasedomain belonging to cl11394 family protein. The accession number of AGPase gene was KP751443. GBSS and SSS had Glyco_transf_5, GT1_Glycogen_synthase_DULL1_like conserveddomain belonging to cl10013 family protein. The accession numbers of GBSS and SSS genes were KP751445 and KP751444, respectively. (2) The starch content showed an increasing trend in the process of the formation anddevelopment of lily bulblet swelling. The starch content was up to 44.52% at the stemdifferentiation stage after bulblet swelling, which was the highest. The three starch synthesis-related genes were up-regulated gradually in bulblets and leaves. The expression of these three starch synthesis-related genes were up to the peak at the stemdifferentiation stage after bulblet swelling. The expression of AGPase, GBSS and SSS were 10.79, 6.92 and 5.12 in bulblet, and were 6.79, 5.22 and 4.41 in leaves, respectively. The genes expression were much higher in bulblets than in leaves. There was a positive correlation between the starch synthesis-related gene expression and the content of starch and bulblet swelling. The finding provides a reference for propagation production of lily bulblet, by which the expression of key synthesis-related genes can be regulated to promote the swellingdevelopment of lily bulblet.
Key words:Lilium, starch synthesis, bulblet swelling, AGPase, fluorescence quantitative PCR
百合(Lilium)是以鳞茎繁殖的一类植物,按用途可分为观赏百合和药食用百合。我国是药食用百合的主产区,主要品种有兰州百合、龙牙百合和卷丹百合等。生产上百合主要以鳞茎鳞片、茎生小鳞茎、珠芽等方式繁殖,其缺点是繁育周期长,需要完成基叶苗和茎杆苗后才能形成商品种球(赵健等,2017)。兰州百合形成有茎苗需2~3 a,种植生产需3 a。因此,通过调控发育来诱导小鳞茎快速膨大,缩短生长周期,对于百合鳞茎种球生产具有重要意义。张进忠等(2016)研究表明,淀粉合成積累促进百合新生鳞茎膨大发育,而淀粉的合成代谢受多个基因调控,其中腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)是淀粉合成途径的限速酶,参与淀粉合成的第一步反应,而颗粒结合淀粉合酶(GBSS)和可溶性淀粉合酶(SSS)分别参与直链与支链淀粉的合成(王倩等,2017;安飞飞等,2018),影响作物品质。这三类淀粉合成酶对于淀粉的合成具有重要作用,在百合中关于AGPase、GBSS和SSS基因的克隆及表达分析研究尚未见报道。
本研究拟克隆百合鳞茎淀粉合成相关酶基因,并针对鳞茎形成膨大发育不同阶段,采用荧光定量PCR分析关键酶基因的表达变化,测定百合鳞茎膨大发育中淀粉含量变化,并结合淀粉含量的变化探索淀粉合成关键酶基因表达模式,分析鳞茎种球发育过程中促使其膨大发育的机理。研究结果将为开发鳞茎膨大培育技术提供理论基础,也为百合鳞茎种球生产提供了技术参考。
1 材料与方法
1.1 材料
植物材料:兰州百合(Liliumdavidii var. unicolor)组培苗。根据组培过程中鳞茎发育进程将其分为丛生芽阶段,鳞茎形成阶段,鳞茎膨大阶段,鳞茎膨大后茎杆分化阶段,分别标记为A、B、C、D四阶段。所取组织材料为各阶段的鳞茎片与叶片材料(图1),其中阶段A鳞茎片材料取自形成鳞茎片的愈伤化组织,取鲜样后液氮速冻置于-80 ℃冰箱保存。植物材料由广西农业科学院生物技术研究所提供。
主要试剂材料:RNA提取试剂Trizol购于Invitrogen;逆转录试剂RevertAid First Strand cDNA Synthesis Kit购于Fermentas;T载体pGEM-T购于Promega;DNA凝胶回收试剂盒AP-GX-50购于Axygen;质粒抽提试剂盒AP-MN-P-50购于Axygen;M13 F引物:TGTAAAACGACGGCCAGT,M13 R引物:CAGGAAACAGCTATGACC,南京金斯瑞合成。逆转录试剂盒PrimeScript RT Master Mix(Perfect Real Time)购于TAKARA;荧光定量PCR仪:Bio-Rad iQ5。
1.2 方法
1.2.1 淀粉含量测定 取各发育阶段鲜样品,参照刘襄河等(2013)比色法进行测定。
1.2.2 同源克隆淀粉合成关键酶基因cDNA序列 采用同源克隆的方法,根据已经报道的其他作物AGPase、GBSS和SSS基因cDNA序列,首先分别寻找这三个基因的近缘物种完整开放阅读框,然后在Blastn上根据此开放阅读框进行比对,将所有相关物种的开放阅读框序列录入, 使用MegAlign软件进行整体比对,选择相似性最接近的区域设计简并引物,最终设计可以扩增出百合AGPase、GBSS和SSS基因的简并引物(表1)。采用Trizol法提取各组织的RNA,用DNase I,
RNase-free去除RNA中的DNA,反转录生成cDNA链;利用简并引物进行PCR扩增,对扩增片段进行凝胶回收,将片段与pGEM-T载体连接,并转化大肠杆菌TOP10感受态进行阳性克隆筛选,再对阳性克隆进行菌液PCR鉴定,选取正确的克隆测序。
1.2.3 荧光定量PCR 利用软件primer premier 5.0 (Premier Biosoft Interpairs, Palo Alto, CA)设计基因特异性引物,所用引物序列见表1。取不同发育阶段(A、B、C和D)的鳞片与叶片组织,使用Trizol试剂盒抽提细胞RNA。使用PrimeScript RT Master Mix(Perfect Real Time)将mRNA逆转录合成cDNA,合成的cDNA用于目的基因表达分析,以18s rRNA作为内参,用SYBR Green荧光定量PCR试剂盒扩增cDNA中的各目的基因片段和18s rRNA,反应程序设置如下:95 ℃变性7 min,95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,40个循环。每个样品设3次重复,计算每个样品目的基因和内参的△Ct,并采用2-△△Ct法(Rajeevan et al., 2001)计算各样品中目的基因表达情况。
1.2.4 统计学分析 采用SPSS17.0软件进行统计
2 结果与分析
2.1 百合鳞茎不同发育阶段淀粉含量
百合组培鳞茎形成与膨大发育过程中,各阶段淀粉含量呈现递增规律,如表2所示,随着鳞茎的膨大发育,其淀粉含量逐渐增加;鳞茎膨大后,鳞茎盘开始分化茎杆(D)时其淀粉含量最高,达到44.52%,表明鳞茎的膨大与其淀粉含量成正相关,其结果与张进忠等(2016)的研究结果一致。
2.2 百合淀粉合成关键酶基因AGPase、SSS和GBSS的cDNA克隆
通过对近缘物种相关氨基酸序列Blast比对,寻找合适保守区域设计简并引物,分别扩增AGPase、SSS和GBSS 百合淀粉合成相关酶基因的cDNA序列(图2),分别测序得到918、567和1 257 bp的基因片段长度。经过序列分析及比对,三条序列分别与淀粉合成关键酶基因AGP small subunit、SSSⅢ、GBSSⅠ同源性最高,分别达到100%、99%和 99%。将以上克隆序列上传NCBI获得基因登录号:KP751443、KP751445、KP751444。将核苷酸序列翻译成氨基酸序列进行Blast比对分析保守结构域,由图3可知,AGPase具有cl28238(GlgC)超级家族中PLN02241家族蛋白结构特征及cl11394家族蛋白ADP_Glucose_PP与NTP_transferase结构域;由图4和图5可知,GBSS与SSS具有cl10013家族蛋白Glyco_transf_5,GT1_Glycogen_synthase_DULL1_like结构域。
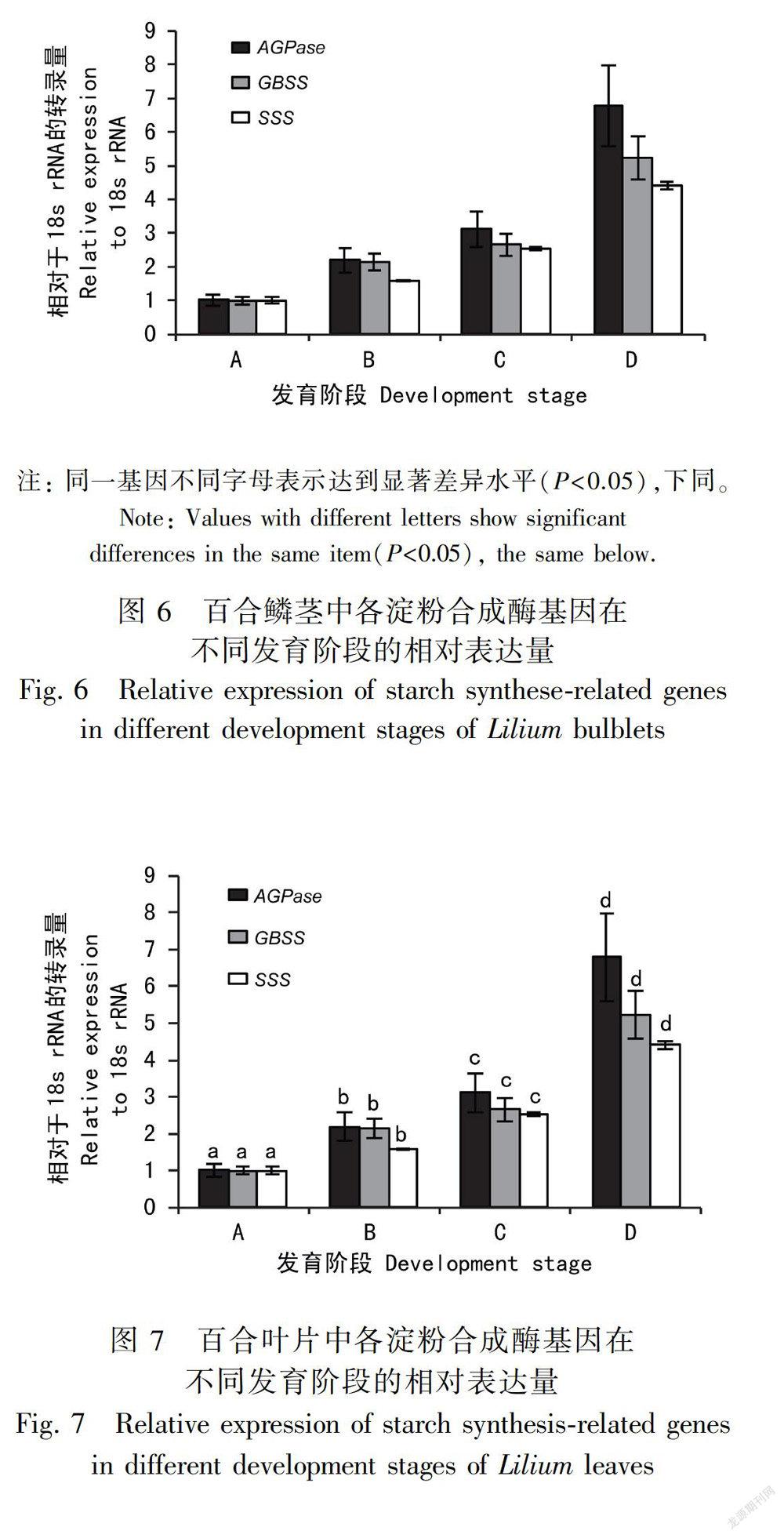
2.3 淀粉合成酶关键基因在百合鳞茎不同发育阶段的表达
最低,随着鳞茎的膨大发育,各淀粉合成酶基因表达量逐渐增加,均在发育阶段D达到最高。且此三基因在四个发育阶段之间的表达量差异均达显著水平(P<0.05),表达量最大的为阶段D中编码淀粉合成限速酶的AGPase基因,其表达量为10.79;分别为阶段A、B、C的10.75、6.95、2.69倍;GBSS在阶段D的表达量为6.92,分别为阶段A、B、C的6.81、4.03、1.75倍;D阶段的SSS表达量为5.12,分别为阶段A、B、C的5.09、1.51、1.09倍。三基因的表达量变化与此四个阶段鳞茎淀粉粒形成增多、淀粉含量逐渐递增的表现相关。
图7为鳞茎组培膨大发育过程中,叶片中各淀粉合成酶基因的表达情况。叶片中三淀粉合成酶基因表达量随发育进程而逐渐增加,并均于发育阶段D达到最高。三基因在四个发育阶段之间的表达量差异均达显著水平(P<0.05),表达量最大的为阶段D中AGPase基因,其表达量为6.79;同时,阶段D中GBSS和SSS表达量分别达到5.22和4.41。阶段D中AGPase的表达量为阶段C、B、A的2.18、3.10、6.73倍;GBSS表达量为阶段C、B、A的1.97、2.45、5.21倍;SSS表达量为阶段C、B、A的1.74、2.77、4.40倍;这表明叶片中淀粉合成酶基因表达与鳞茎中表达变化一致。
3 讨论与结论
百合是高淀粉作物,本研究观察到,组培鳞茎的膨大发育涉及到其淀粉含量的急剧变化,鳞茎的膨大发育过程显示了也是淀粉含量增加积累的过程(张进忠等,2016),表明淀粉的合成代谢对于鳞茎种球膨大发育具有积极意义。对于百合鳞茎膨大研究已有相关报道,研究龙牙百合鳞茎膨大发育中,通过适当浓度的外源调节剂芸苔素内酯处理可以提高鳞茎鲜重(仇硕等,2017);毛百合组培中蔗糖、NAA、IBA、活性炭及多效唑对试管鳞茎形成和膨大都有影响,水杨酸对鳞茎膨大效果不明显(张彦妮等,2016);在兰州百合组培效鳞茎膨大研究中,活性炭、蔗糖及多效唑对鳞茎的膨大具有促进作用(秦新惠等,2015);珠芽是百合的一种繁育方式,为茎生小鳞茎,对百合腋生珠芽形成研究发现淀粉和糖代谢及植物激素信号转导通路在珠芽形成中发挥了重要作用,淀粉的合成和积累可促进卷丹珠芽的启动(Yang et al., 2017),可见淀粉合成代谢对鳞茎的形成具有积极意义。
在百合组培鳞茎发育过程中,通过外因诱导(蔗糖、植物生长调节剂)使鳞茎膨大发育,电镜观察发现组培鳞茎膨大与淀粉粒的形成与淀粉含量增加存在正相关(Zhang et al.,2014);利用实时荧光定量PCR对其主要淀粉合成关键酶基因进行表达分析,以期了解在鳞茎组培发育过程中淀粉合成关键酶基因的表达情况,探索调控基因表达的机理。在AGPase的时空表达中,结果显示鳞茎种球形成、膨大发育与AGPase表达正相关,也与淀粉含量正相关(张进忠,2016),在表达部位上其鳞茎与叶片都有表达,鳞茎高于叶片表达,且随发育阶段的时间变化,各表达量变化一致。GBSS、SSS对直链和支链淀粉合成起主要催化作用(苗红霞等,2016),其表达模式与AGPase类似,它们以AGPase催化合成的产物为底物延长糖苷链;对AGPase基因的调控研究通常认为其受激活因子3-PGA与抑制因子Pi调节(高振宇和黄大年,1998),本研究中所采用的不同发育阶段材料分别为使用了不同浓度蔗糖、植物生长调节剂等外源因子后形成的,此促进鳞茎膨大发育的过程与AGPase表达增强变化一致,可能存在所采用的外源因子正调控AGPase基因的表达模式,这对于百合的种球膨大生产具有积极意义,相关研究还需要进一步开展。
参考文献:
AN FF,LENG QY,LI KM,et al.,2018. Analysis of gene expression associated with starch metabolism on cassava cv. SC8 tuberous roots and its tetraploid [J]. J Southern Agric,49(8):1484-1489. [安飞飞,冷青云,李开绵,陈松笔,等, 2018. 木薯华南8号及其四倍体块根淀粉代谢相关基因表达分析 [J]. 南方农业学报, 49(8):1484-1489.]
GAO ZY, HUANGdN, 1998. A key enzyme for the synthesis of sucrose and starch in plants Ⅰ. Adenosinediphosphoglucose pyrophosphprylase [J]. Chem Life, (3):28-31. [高振宇, 黄大年, 1998. 植物中合成蔗糖和淀粉的关键酶Ⅰ. 腺苷二磷酸-葡萄糖焦磷酸化酶 [J]. 生命的化学, (3):28-31.]
GUO Y,dONG L, LIU C, 2012. The relationship betweendevelopment of bulblet and changes of carbohydrates of pot lily [J]. Henan Agric Sci, 41(5):117-120. [郭燕, 董丽, 刘春, 2012. 盆栽百合鳞茎发育与碳水化合物变化的关系 [J]. 河南农业科学, 41(5):117-120.]
LIU XH, ZHENG LX, ZHENG LM, et al., 2013.determination of amylose and amylopectin in the commonly used starch materials bydual-wavelength spectrophotometry [J]. Guangdong Agric Sci, 40(18):97-100. [劉襄河, 郑丽璇, 郑丽勉, 等, 2013. 双波长法测定常用淀粉原料中直链淀粉、支链淀粉及总淀粉含量 [J]. 广东农业科学, 40(18):97-100.]
MIAO HX, SUN PG, ZHANG KX, et al., 2016. Research progress on expression regulation mechanism of genes encoding granule-bound starch synthase in plants [J]. Biotechnol Bull, 32(3):18-23. [苗红霞, 孙佩光, 张凯星, 等, 2016. 植物颗粒结合淀粉合成酶(GBSS)基因的表达调控机制研究进展 [J]. 生物技术通报, 32(3):18-23.]
QIN XH, CUI XL, CHEN XH, et al., 2015. Effect ofdifferent factors on bulblet swelling in tissue culture of Lanzhou lily [J]. For Sci Technol, (12):44-47. [秦新惠, 崔兴林, 陈学红, 等, 2015. 不同因子对兰州百合组培小鳞茎膨大的影响研究 [J]. 林业科技通讯, (12):44-47.]
QIU S, TANG FL, XIA K, et al., 2017. Propagation culture and bulbsdevelopment of Lilium brownii var. viridulum [J]. Guangdong Agric Sci, 44(4):61-66. [仇硕, 唐鳳鸾, 夏科, 等, 2017. 龙牙百合增殖培养及鳞茎生长发育研究 [J]. 广东农业科学, 44(4):61-66.]
RAJEEVAN MS, RANAMUKHAARACHCHIdG, VERNON SD, et al., 2001. Use of real-time quantitative PCR to validate the results of cDNA array anddifferentialdisplay PCR technologies [J]. Methods, 25(4):443-451.
WANG Q, SUN WJ, BAO Y, 2017. Evolutionary pattern of the GBSS gene family in plants [J]. Acta Bot Sin, 52(2):179-187. [王倩, 孙文静, 包颖, 2017. 植物颗粒结合淀粉合酶GBSS基因家族的进化 [J]. 植物学报, 52(2):179-187.]
YANG PP, XU LF, XU H, et al., 2017. Histological and transcriptomic analysisduring bulbil formation in Lilium lancifolium [J]. Front Plant Sci, 8:1508.
ZHANG JZ, FAN YP, YU RC, et al., 2014. Regeneration of bulblets from bulb scale explants of Lanzhou lily (Liliumdavidii var.unicolor) and enhancement of bulblet growth [J]. Propag Ornam Plants, 14(3):112-116.
ZHANG JZ, WEI SL, SUN JM, et al., 2016. Bulblet formation anddevelopment of Lanzhou lily (Liliumdavidii var.unicolor) by tissue culture [J]. Guihaia, 36(3):297-302. [张进忠, 韦绍龙, 孙嘉曼, 等, 2016. 兰州百合组培鳞茎发育研究 [J]. 广西植物, 36(3):297-302.]
ZHANG YN, LI ZT, ZHANG YB, et al., 2016. Culture optimization of bulb formation and swelling in vitro of Liliumdauricum [J]. Jiangsu Agric Sci, 44(4):74-78. [张彦妮, 李兆婷, 张艳波, 等, 2016. 毛百合试管鳞茎形成和膨大的培养优化 [J]. 江苏农业科学, 44(4):74-78.]
ZHAO J, ZHAO ZG, TANG FL, et al., 2017. Progress in Lilium brownie var. viridulum [J]. Guizhou Agric Sci, 45(7):78-81. [赵健, 赵志国, 唐凤鸾, 等, 2017. 龙牙百合的研究进展 [J]. 贵州农业科学, 45(7):78-81.]
