健脾清化方对单侧输尿管梗阻模型大鼠P38MAPK信号通路的影响
2019-09-10余弘吉何立群
余弘吉 何立群




摘要 目的:观察健脾清化方对单侧输尿管梗阻模型大鼠P38MAPK的影响,并探讨其作用机制。方法:SD雄性大鼠90只,随机分为假手术组,模型组,西药组和中药组,行UUO术制备单侧输尿管模型,并于术后7、14、21 d处死大鼠。生化法检测大鼠血肌酐、尿素氮;HE、Masson染色观察肾脏病理形态;WB测肾组织p38、p-p38、TGF-β1蛋白表达;免疫组化法观察肾组织p38蛋白阳性面积率。结果:与正常组比较,模型组SCr、BUN含量、p38、p-p38、TGF-β1表达、p38阳性面积率均升高(P<0.01,P<0.05);与模型组比较:氯沙坦钾组和健脾清化方组SCr、BUN含量、p38、p-p38、TGF-β1蛋白表达、p38阳性面积率均降低(P<0.01,P<0.05)。HE、Masson示模型组肾小管明显扩张,肾盂肾盏明显扩张。结论:健脾清化方能改善单侧输尿管梗阻模型大鼠的肾脏病理改变,对肾脏损害有一定的保护作用,其机制可能与其能下调SCr、BUN的含量、p38、p-p38、TGF-β1的蛋白表达有关。
关键词 健脾清化方;单侧输尿管梗阻模型;p38 MAPK信号通路;大鼠;实验;影响
Abstract Objective:To observe the effects of Jianpi Qinghua decoction on P38MAPK in rats with unilateral ureteral obstruction and explore its mechanism.Methods:A total of 90 male SD rats were randomly divided into a sham operation group,a model group,a western medicine group and a traditional Chinese medicine group,and the unilateral ureteral model was made by UUO surgery,and the rats were sacrificed at 7,14 and 21 days after surgery.The serum creatinine and urea nitrogen were detected by biochemical method; the pathological morphology of kidney was observed by HE and Masson staining; the expression of p38,p-p38 and TGF-β1 in renal tissue was measured by WB; the positive area ratio of p38 protein in renal tissue was observed by immunohistochemistry.Results:Compared with the normal group,the content of SCr,BUN,the expression of p38,p-p38,TGF-β1 and the positive area ratio of p38 protein in the model group were all increased(P<0.01,P<0.05); Compared with the model group,the content of SCr,BUN,the protein expression of p38,p-p38,TGF-β1 and the positive area rate of p38 in both the western medicine group and the Jianpi Qinghua decoction group were all decreased(P<0.01,P<0.05).HE and Masson showed that the renal tubules and the renal pelvis in the model group were significantly expanded.Conclusion:Jianpi Qinghua decoction can improve the renal pathological changes in the model rats with unilateral ureteral obstruction,which has a certain protective effect on kidney damage,and the mechanism may be related to down-regulate the protein expression of SCr,BUN,p38,p-p38 and TGF-β1.
Key Words Jianpi Qinghua decoction; Unilateral ureteral obstruction model; P38 MAPK signaling pathway; Rats; Experiment; Effect
中圖分类号:R256.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.05.001
肾小管间质纤维化是多种病因所致慢性肾脏病(Chronic Kidney Disease,CKD)进展至终末期肾病的最后共同通路。肾功能的恶化,很大程度上取决于肾小管间质纤维化的程度[1]。单侧输尿管梗阻(Uni-lateral Ureteral Obstruction,UUO)模型是经典的肾小管间质纤维化的动物模型,为目前常用的肾间质纤维化模型[2]。p38MAPK属于MAPK(Mitogen-activated Protein Kinase,MAPK)家族中的一个亚族,是广泛存在于细胞浆内的含有丝氨酸/苏氨酸残基的蛋白质激酶。有研究表明[3],p38MAPK在各种急慢性的炎性反应过程中均能被被活化并参与炎性反应的形成与持续发生。其活化与炎性反应过程中的热、痛、敏有着紧密的联系[4],p38MAPK介导了多种细胞内信息的传递过程,能对许多细胞外刺激产生相应的反应,能从胞质移位至细胞核,进而调节转录因子的表达活性来改变相关基因的表达水平,从而介导了细胞生长、发育、分化及死亡的全过程[5]。
健脾清化方治疗肾衰的主要病机在于“中气式微、阴火乘土、正虚与湿热浊毒胶着对垒、三焦壅塞”,其以益气健脾、清热利湿为组方原则,本课题组已有研究[6]证实其不仅能改善慢性肾衰病程中胃肠道不适症状,且能有效降低血肌酐、血脂等腎功能指标,具有切实可信的临床价值。本研究从p38MAPK信号通路观察健脾清化方对单侧输尿管梗阻肾病模型大鼠的治疗及其作用机制。为研究健脾清化方对p38MAPK介导单侧输尿管梗阻肾病模型大鼠的具体影响,本研究检测大鼠血肌酐、尿素氮,肾脏p38、p-p38、TGF-β1的蛋白表达量,HE染色观察大鼠肾脏形态学改变,免疫组化法观察大鼠肾脏p38MAPK的阳性面积,以期探讨健脾清化方对单侧输尿管梗阻肾病模型大鼠肾衰的影响及其作用机制,为健脾清化方治疗单侧输尿管梗阻、改善肾脏血流动力学提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级雄性SD大鼠90只,体质量(200±20)g,购自上海西普尔-必凯实验动物有限公司,合格证号SCXK(沪)2013-0016,专用标准颗粒饲料、水喂养,大鼠均分笼喂养,每笼5只,人工光循环,一天内光照与黑暗时间均为12 h,湿度为(55±2)%,温度为(21±2)℃。实验在上海中医药大学实验动物中心设施内进行[SYCK(沪)2013-0016]。所有的操作均按照上海中医药大学动物实验伦理委员会要求进行,本实验研究实验伦理委员会批准编号:SZY201710012。
1.1.2 药物 中药由党参15 g、生黄芪15 g、黄连3 g、制大黄9 g、草果仁6 g、苍术10 g组成,购自上海中医药大学附属曙光医院(上海同济堂药业有限公司)。上述中药加水浸泡1 h,武火煮沸转文火继续煎煮30 min,将药液滤出;再次加水煮沸后文火煎煮30 min,滤出药液,2次药液混合后煎煮浓缩至600 mL,保证浓缩液中生药浓度为1.93 g/mL,高压灭菌后放入4 ℃冰箱保存备用。氯沙坦钾片(杭州默沙东制药有限公司,批号J20130048)。
1.1.3 试剂与仪器 兔多克隆p38MAPK、p-p38MAPK抗体;鼠多克隆抗体TGF-β1(Abcam,美国);无水乙醇、石蜡(国药集团化学试剂有限公司);PVDF膜(Millipore公司);ECL化学发光液、BCA蛋白浓度测定试剂盒(江苏海门市碧云天研究所);5417R型离心机3K15(Eppendorf,德国);Synergy2型多功能酶标仪(Bio-Tek,美国);mini-protein tetra cell 1658004型小型垂直电泳槽(Bio-Rad,美国);FluorChem M型自动成像分析仪(ProteinSimple,美国);Hitachi7080型全自动生化仪(Tokyo,日本);TP1020型生物组织自动脱水机、2255型全自动切片机(莱卡,德国)。
1.2 方法
1.2.1 分组与模型制备 将90只大鼠随机分为假手术组(n=18)、UUO模型组(n=72)。1)假手术组:大鼠腹腔注射戊巴比妥钠,麻醉后切开左侧腹腔,钝性分离输尿管后,将肾脏回纳,逐层缝合关闭腹腔。2)UUO模型组:大鼠麻醉及其他手术操作同前,分离输尿管后,于近肾脏侧1/3处用4~0号手术线结扎,再于远离肾脏侧1/3处结扎,防止尿液返流,生理盐水冲洗血液后消毒,将肾脏回纳,逐层缝合关闭腹腔。造模结束后将模型组大鼠随机分为模型组、中药组(健脾清化方)、西药组(氯沙坦钾片),每组24只。
1.2.2 干预方法 造模后健脾清化方组灌胃量为生药19.3 g/(kg·d),氯沙坦钾组为33.3 g/(kg·d),假手术组和模型组分别予等体积的生理盐水每天灌胃。4组大鼠分别于灌胃7、14、21 d后分批(n=6)处死。大鼠在第7、14、21天时,腹腔注射戊巴比妥钠溶液麻醉后打开腹腔,进行腹主动脉取血,将血液置于碎冰上暂存,夹闭动脉摘取左侧肾脏,去除肾包膜后纵向剖开肾脏,生理盐水洗净血液和潴留的尿液后,将其中1/2肾脏置于4%多聚甲醛溶液中室温保存,另外1/2肾脏放入冻存管,置液氮中暂存,后转置于-80 ℃冰箱保存备用。
1.2.3 检测指标与方法
1.2.3.1 血肌酐(Serum Creatinine,Scr)、尿素氮(Blood Urea Nitrogen,BUN)的测定 血液采集后离心取上清,用常规生化方法检测血肌酐、尿素氮。
1.2.3.2 肾小管间质纤维化指数 肾脏组织病理,手术侧肾脏置入4%多聚甲醛,浸泡24 h后,常规脱水,石蜡包埋,将包埋后的肾脏制成3 μm厚度的切片,脱蜡制水后,1)常规HE染色,每组大鼠制片6张,随机选取6个互不重叠视野,光镜下观察大鼠肾小管和肾间质病理改变;2)Masson染色,每组8张切片在200倍镜视野下观察6个互不重叠间质视野,采用Image Pro Plus6.0图像分析软件,对染色结果进行图像采集和半定量分析。评分标准:0分:正常;1分:阳性面积<1/4;2分:阳性面积在1/4~1/2之间;3分:阳性面积>1/2。
1.2.3.3 Western Blot法检测P38、P-P38、TGF-β1在肾脏组织的表达 从冰箱中取出肾脏,称取各组同等重量肾脏组织,放入提前配置后的裂解液中,将组织匀浆后离心取上清液,即为肾脏组织蛋白,采用BCA法测定蛋白浓度,酶标仪读取蛋白浓度。根据蛋白浓度定量结果,取各组蛋白样品,加入适量的RIPA、上样缓冲液,使蛋白样品为均一浓度。蛋白样品经10%SDS-PAGE电泳后,取出凝胶进行转膜,100 V恒压转膜90 min,加封闭液摇床10 min,4 ℃过夜孵育一抗,TBST洗膜后分别加入稀释的二抗室温孵育1 h,TBST洗涤后,使用凝胶图像分析系统进行显色分析。利用Image J软件分析灰度值,进行半定量分析,计算出目的条带与内参条带灰度值的比值,作为样品蛋白水平的相对表达量。
1.2.3.4 免疫组化法观察肺组织p38MAPK蛋白表达 石蜡切片常规脱蜡至水,PBS洗涤3次;用pH 6.0柠檬酸缓冲液(CB)热诱导修复,室温自然冷却后洗涤3次;0.3%H2O2抑制内源性过氧化物酶室温20 min;PBS洗滌3次;20%正常羊血清室温孵育30 min;滴加p38MAPK一抗(1∶200)37 ℃孵育2 h;PBS洗涤3次;EnVision试剂(HRP/R)37 ℃ 30 min;PBS洗涤3次;DAB显色8~12 min;苏木素衬染色,热水蓝化;吹干后,树脂封片;镜下观察,背景呈紫蓝色,阳性产物呈棕黄色或黄色。采用Image Pro Plus6.0图像分析软件,对免疫组化结果进行图像采集和定量分析。高倍镜下每张切片随机选择不相重叠的6个视野,计算每例样本蛋白染色阳性面积率(阳性细胞面积÷总面积)作为比较参数。
1.5 统计学方法 采用SPSS 21.0统计软件进行数据分析。实验结果以均数±标准差(±s)表示,组与组之间采用单因素方差分析。任意2组患者之间若满足正态分布且方差齐,采用独立样本t检验;若方差不齐,需校正方差分析;若不符合正态分布,则用非参数检验Kruskal-Wallis H方法,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察 假手术组大鼠术后精神状况良好,活动自如,被毛光泽,进食良好,体质量随时间缓慢增长,实验过程中未死亡。模型组、西药组、中药组大鼠均出现不同程度精神不振,喜静懒动,被毛蓬乱无光泽,体质量不随时间均匀增长;与模型组、西药组比较,中药组大鼠饮食稍增多,体质量略重;实验过程中,由于操作不当及造模的病理损害,模型组死亡3只,西药组死亡2只,中药组死亡2只。
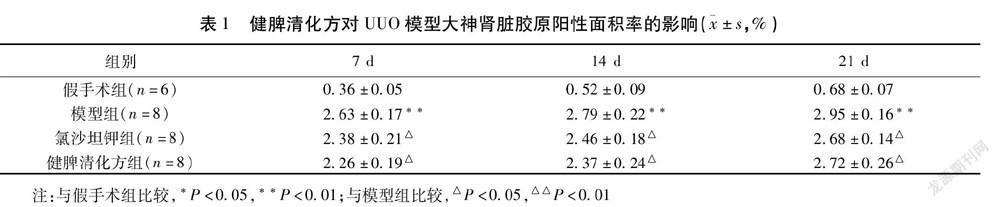
2.2 观察大鼠肾脏组织形态学表现 取材时可见,手术侧大鼠肾脏表面有囊状隆起,颜色深红,体积增大,触摸有波动感,剖开肾脏可见大量血性脓性积液,肾盂肾盏破坏消失,仅残留少量肾皮质。1)HE染色结果显示:假手术组肾小球、肾小管结构基本正常,无明显炎性反应细胞浸润。与假手术组比较,模型组肾小管明显扩张,呈不规则状,甚至融合成空洞,肾小管刷状缘完整性被破坏;肾盂肾盏明显扩张,集合管、远曲小管扩张呈囊状甚至消失;肾间质有大量炎性反应细胞浸润,纤维组织增生;肾小球数量减少,形状不规则,在造模后21 d大鼠肾脏切片中,高倍视野下仅见少量残余肾小球,且有硬化和球管融合。与模型组比较,氯沙坦钾组、健脾清化方组肾小管扩张程度减轻,炎性反应细胞浸润程度减轻。见图1。2)Masson染色结果显示:假手术组肾小管间质无明显纤维化改变,肾小球无异常。模型组肾小管扩张,管腔内有脱落坏死的上皮细胞,间质内炎性细胞侵润,主要为淋巴细胞和单核巨噬细胞;肾小球体积增大,形状不规则;氯沙坦钾组和健脾清化方组肾小管扩张及萎缩减轻,间质内纤维化组织和炎性细胞减少,残余肾小球形态完整规则。见图2。胶原阳性染色面积可见:与假手术组比较,7 d、14 d、21 d模型组阳性面积率均显著增高(P<0.01);与模型组比较:氯沙坦钾组和健脾清化方组阳性面积率均降低(P<0.01,P<0.05)。见表1。
2.3 检测大鼠血肌酐、尿素氮水平 与假手术组比较,造模后7 d、14 d、21 d模型组血肌酐升高(P<0.01,P<0.05);与模型组比较,造模后14 d、21 d健脾清化方组与氯沙坦钾组血肌酐降低(P<0.05),造模后7 d健脾清化方组无差异,氯沙坦钾组降低,差异有统计学意义(P<0.05)。与假手术组比较,造模后7 d、14 d、21 d模型组血尿素氮显著升高(P<0.01);与模型组比较,造模后造模后7 d、14 d、21 d健脾清化方组和氯沙坦钾组血尿素氮均降低,差异有统计学意义(P<0.01,P<0.05)。见表2。
2.4 Western Blot法检测P38、P-P38、TGF-β1在肾脏组织的表达 与假手术组比较,模型组p38、p-p38、TGF-β1表达均升高(P<0.05,P<0.01),且随着时间增加表达逐渐升高;与模型组比较,氯沙坦钾组、健脾清化方组p38、p-p38、TGF-β1表达均降低,差异有统计学意义(P<0.05,P<0.01)。见图3。
2.5 免疫组化法观察肺组织p38MAPK蛋白表达免疫组化染色结果显示,p38MAPK阳性表达呈棕黄色或棕褐色,主要位于细胞浆、带有一些核着色。p38MAPK在假手术组切片中,表达较少,呈阴性表达(-)。而在单侧输尿管梗阻模型组切片中,其表达明显增多,呈弱阳性表达(+),弥漫或散在分布;主要分布在小管及间质等部位。西药组和中药组P38MAPK的表达较模型组少。见图4。阳性面积率可见:与假手术组比较,模型组阳性面积率明显升高(P<0.05,P<0.01),且随着时间增加,阳性面积率亦升高;与模型组比较,氯沙坦钾组和健脾清化方组阳性面积率均降低(P<0.05,P<0.01)。见表3。
3 讨论
肾脏纤维化是所有形式的终末期肾病(ESRD)最终方向,也是多种肾脏疾病最终导致终末期肾病的主要途径和共同的病理改变[7]。而肾脏纤维化的产生是由于多种原因导致细胞外基质过度沉积,超过了肾脏自身代偿的清除能力,最终造成肾病终末期不可逆的病理改变[8]。单侧输尿管梗阻模型是经典的肾小管间质纤维化的大鼠模型,以肾小管的损伤变性和间质内成纤维细胞的增生为主要病理基础,其具有造模时间短,造模严重程度可控性好的特点,能够较好地模拟慢性肾衰竭的肾脏纤维化的病理过程[9]。邹朝霞[10]等认为,在间质纤维化进展过程中,肾纤维化程度与肾小管上皮细胞凋亡数量息息相关,上皮细胞凋亡的数量越多,纤维化程度就越重,而在纤维化进程中,肾小管的扩张及后期的萎缩也会进一步导致肾小管上皮细胞的凋亡。本研究中,HE染色结果显示:模型组肾小管明显扩张,呈不规则状,甚至融合成空洞,肾小管刷状缘完整性被破坏;肾盂肾盏明显扩张,集合管、远曲小管扩张呈囊状甚至消失;肾间质有大量炎性反应细胞浸润,纤维组织增生;肾小球数量减少,形状不规则,在造模后21 d大鼠肾脏切片中,高倍视野下仅见少量残余肾小球,且有硬化和球管融合。Masson染色结果显示:假手术组肾小管间质无明显纤维化改变,肾小球无异常。模型组肾小管扩张,管腔内有脱落坏死的上皮细胞,间质内炎性细胞侵润,主要为淋巴细胞和单核巨噬细胞;肾小球体积增大,形状不规则;氯沙坦钾组和健脾清化方组肾小管扩张及萎缩减轻,间质内纤维化组织和炎性细胞减少,残余肾小球形态完整规则。
健脾清化方是上海曙光医院蔡淦教授根据多年临床实践精心组方而成的治疗慢性肾衰病程中脾肾同病症状的复方,体现了“从脾论治”的中医治则治法,其具有斡旋中土以利下焦开合,刚柔并济以救枢机乖戾之临床价值。马晓红等[11]观察健脾清化方对5/6肾切除大鼠模型的影响,结果表明健脾清化方可明显降低5/6肾切除大鼠24 h尿蛋白量、降低尿素氮、肌酐水平,表明该方具有改善肾切除大鼠肾功能的作用。徐蝶衣等[12]认为,健脾清化方能够延缓慢性肾衰的机制主要在于其能改善肾衰患者临床症状及肾脏功能,调节细胞免疫,减慢肾脏纤维化的进展速度,改善肾脏微炎性反应状态以及纠正肾性贫血等方面,且中药制剂具有不良反应较小的优势,显示出良好的前景。本研究也表明健脾清化方与单侧输尿管梗阻模型组大鼠在肌酐、尿素氮水平差异有统计学意义(P<0.05,P<0.01),但随着梗阻时间的延长,肌酐、尿素氮的水平仍有增长。
促丝裂原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)是细胞内广泛存在的丝氨酸/苏氨酸蛋白激酶超家族,是传递细胞信号的重要物质。近年来研究发现,在天然免疫和特异性免疫应答中MAPK信号转导通路均起着重要的调节作用。p38MAPK是MAPK超家族中重要的一员,与机体炎性反应的发生、细胞生长周期的长短、细胞分化的速率、凋亡及肿瘤的发生有着密切的关系。激素、G蛋白偶联受体、氧化应激反应等许多因素均能激活p38MAPK信号通路[13-14]。同时作为p38MAPK下游的转化生长因子(TGF-β)也参与了单侧输尿管梗阻模型大鼠肾纤维化的病理过程,其主要介导和调节免疫、炎性反应,其中TGF-β1是被认为是促进肾小球和肾间质纤维化的最重要的细胞因子之一[15]。娄强等[16]认为,顺铂诱导急性肾损伤模型中,p38MAPK的磷酸化促使机体产生酸性的外部环境,并增加凋亡相关蛋白的剪切和表达,而p38MAPK抑制剂可降低细胞凋亡,减少凋亡相关蛋白的激活并减轻细胞外环境的酸度,提示p38MAPK在顺铂诱导的急性肾损伤中发挥重要作用,并可作为潜在的治疗药物性肾损伤的药物靶标。本研究表明,行单侧输尿管梗阻术后大鼠p38、p-p38、TGF-β1的蛋白表达量均升高,而健脾清化方组大鼠p38、p-p38、TGF-β1的蛋白表达量相对降低,表明健脾清化方可以通过降低p38MAPK信号通路的活化表达减轻肾脏炎性反应,从而改善肾脏病理状态,达到治疗目的。本研究中,健脾清化方无不同剂量分组,其量效关系有待进一步研究。
可见,单侧输尿管梗阻刺激可活化p38MAPK,并促使其磷酸化,同时可激活下游TGF-β1,促使机体发生了一系列炎性反应和病理形态改变,进一步导致肾脏纤维化的发生发展,引起机体的疾病状态。综合各项实验结果,我们发现健脾清化方可调控该通路的关键蛋白以及相关转化生长因子的表达,而这也可能正是健脾清化方防治单侧输尿管梗阻肾病的机制之一,为本病的临床辨治与靶标判定提供方向。
参考文献
[1]Nangaku M.Mechanisms of tubulointerstitial injury in the kidney:final common pathways to end-stage renal failure[J].Intern Med,2004,43(1):9-17.
[2]Klahr S,Morrissey J.Obstructive nephropathy and renal fibrosis[J].Am J Physiol Renal Physiol,2002,283(5):F861-F875.
[3]Svensson CI,Marsala M,Westerlund A,et al.Activation of p38 mitogen-activated protein kinase in spinal microglia is a critical link in inflammation-induced spinal pain processing[J].J Neurochem,2003,86(6):1534-1544.
[4]杜俊英,方剑乔,梁宜,等.p38MAPK通路参与炎性痛及电针干预的可能性[J].医学信息(上旬刊),2011,24(6):3612-3613.
[5]杨晓溪,崔建美,喇孝瑾,等.针刺对哮喘大鼠肺组织p38蛋白激酶及c-fos蛋白表达的影响[J].时珍国医国药,2013,24(4):1004-1006.
[6]陈刚,何立群.健脾清化方治疗慢性肾衰竭53例临床观察[J].中国中西医结合肾病杂志,2006,7(10):591-593.
[7]Ahmed H,Mohamed Y,Tawfek A,et al.Renal fibrosis[J].Menoufia Med J,2015,28(2):540-546.
[8]袁媛.大鼠單侧输尿管结扎模型和饥饿模型尿液蛋白质组研究[D].北京:北京协和医学院,2015.
[9]张盟.CHOP基因敲除后抑制UUO诱导的小鼠肾脏纤维化的机制研究[D].武汉:华中科技大学,2016.
[10]邹朝霞,李均.内质网应激与肾脏纤维化[J].海南医学,2017,28(4):615-617.
[11]马晓红,王东,王云满,等.健脾清化方对慢性肾衰大鼠肾组织TGF-β1 mRNA及CTGFmRNA表达的影响[J].中国中医药科技,2013,20(2):122-123,128.
[12]徐蝶衣,王骞,张长明.健脾清化法治疗慢性肾衰的研究进展[J].环球中医药,2018,11(2):312-315.
[13]Zheng SY,Fu XB,Xu JG,et al.Inhibition of p38 mitogen-activated protein kinase may decrease intestinal epithelial cell apoptosis and improve intestinal epithelial barrier function after ischemia-reperfusion injury[J].World J Gastroenterol,2005,11(5):656-660.
[14]Liu HS,Pan CE,Liu QG,et al.Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis[J].World J Gastroenterol,2003,9(11):2513-2518.
[15]宋小乐.TGF-β1/Smad信号转导通路对肾间质纤维化的影响[J].南昌大学学报:医学版,2011,51(6):92-95,98.
[16]娄强,张芳,李淑莲.p38 MAPK在顺铂诱导肾小管上皮细胞凋亡中的作用[J].中国病理生理杂志,2018,34(9):1678-1683.
