高效拮抗链孢霉和绿色木霉海洋细菌的筛选及鉴定
2019-09-10李欢曹雪梅陈茹吴海霞王军强马桂珍暴增海彭海
李欢 曹雪梅 陈茹 吴海霞 王军强 马桂珍 暴增海 彭海




摘要:【目的】筛选用于防治食用菌污染菌链孢霉(Neurosporacrasa sp.)和绿色木霉(Trichoderma viride)的拮抗菌株,为食用菌病害的生物防治提供优良生防资源。【方法】以分离自江苏连云港海域的92株海洋细菌菌株为研究对象,采用平板对峙法和打孔法测定供试菌株及其发酵液对链孢霉和绿色木霉的抑菌作用,测定抑菌作用较强菌株与杏鲍菇(Pleurotus eryngii)菌丝生长的相容性,筛选抑菌作用强且与杏鲍菇菌丝相容性好的优良拮抗菌株;通过形态特征观察、生理生化试验和16S rDNA、gyrB序列分析对优良拮抗菌株进行种类鉴定。【结果】从92株供试海洋细菌菌株中筛选出一株高效拮抗污染菌的BMY-2菌株,其对链孢霉的抑菌圈直径达25.33 mm,对绿色木霉的抑菌带宽度达30.00 mm,且与杏鲍菇的相容性好;分类鉴定结果表明,BMY-2菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。【结论】解淀粉芽孢杆菌BMY-2菌株对食用菌污染菌链孢霉和绿色木霉均具有较强的抑制作用,且与杏鲍菇生物相容性好,在食用菌生物防治上具有良好的潜在應用前景。
关键词: 食用菌;链孢霉;绿色木霉;海洋细菌;解淀粉芽孢杆菌;生物防治
0 引言
【研究意义】链孢霉(Neurosporacrasa sp.)和绿色木霉(Trichoderma viride)是食用菌栽培过程中常见且危害严重的污染菌。链孢霉对香菇、杏鲍菇等多种食用菌的培养料、母种、原种、栽培种、栽培袋和子实体均能造成危害,其繁殖速度快,可在1~3 d内覆盖食用菌培养料;其孢子可在菇房地面、墙壁和菇架上存活多年,且一旦污染很难彻底清除,常引起整批菌种或菌袋报废,给食用菌生产造成较大的经济损失(朱富春,2013;辛颖,2016)。绿色木霉主要存在于朽木、枯枝落叶、植物残体和空气中,几乎所有的食用菌在不同生长阶段均会遭受绿色木霉的侵染(吴晓金,2008;熊小龙,2011;边银丙,2013)。目前,食用菌生产过程中对污染菌的防治主要依靠化学农药,如使用多菌灵、克霉灵、来苏水、苯酚和巴斯消毒液等(江英成,2001;陈小丽,2009;张柳莲等,2017),但化学防治容易导致环境污染、子实体农药残留、病原菌产生抗药性等问题,且食用菌生长周期短,用药后短期内采收上市易导致食用者急性中毒,因此,寻找替代化学防治食用菌污染菌的安全有效方法具有重要现实意义。【前人研究进展】生物防治可弥补化学防治的不足,在植物病害防治中已得到高度重视。生防细菌可产生细菌素、抗菌蛋白、脂肽类抗生素等产物,为细菌应用于食用菌的生物防治提供了理论依据(连燕萍,2016;杨胜清等,2017;张同睿,2018)。近年来,利用生防细菌防治食用菌病害的研究取得一定进展,有学者筛选出一些对食用菌污染菌具有明显拮抗作用的优良菌株。吴小平等(2009)、孟文文等(2015)分别筛选出对链孢霉和3种木霉菌丝生长、产孢量及孢子萌发具有较强抑制作用,但对平菇菌丝生长抑制作用较弱的拮抗菌株——枯草芽孢杆菌(Bacillus subtilis)BS-2和B4;林娓娓等(2011)筛选获得5株对链孢霉有较强抑制作用的菌株;马林等(2016)筛选出的假单胞菌(Pseudomonas sp.)MS82对绿色木霉具有明显抑制作用,并发现该菌株产生抑菌物质的相关基因。现有的生防制剂菌株主要来源于陆源微生物,但也有学者从海洋中筛选出多株具有强抑菌作用的优良海洋细菌,为海洋细菌应用于食用菌污染菌的控制提供了可能。本课题组从连云港海域分离得到放线菌(Actinomyces)BM-2(暴增海等,2013)、解淀粉芽孢杆菌GM-1-1(葛平华,2013)、多粘类芽孢杆菌(Paenibacillus polymyxa)L1-9(马桂珍等,2013)和贝莱斯芽孢杆菌(B. velezensis)BMF 03(陈茹等,2018)等多株对植物病原菌具有广谱抗菌作用的菌株;曲均革等(2018)、杨定祥等(2018)从海洋中筛选获得的MB133和SH-27等菌株对辣椒疫霉(Phytophthera capsici)、水稻纹枯(Rhizoctonia solani)、稻瘟(Magnaporthe grisea)等多种植物病原菌具有较强的抑制作用,表现出良好的开发应用前景。【本研究切入点】目前报道拮抗食用菌污染菌的优良菌株较少,而从海洋中获得食用菌污染菌拮抗细菌的相关研究尚未见报道。【拟解决的关键问题】采用平板对峙法和打孔法对保藏于淮海工学院海洋抗菌微生物研究室(以下简称本实验室)的分离自江苏连云港海域的海洋细菌进行筛选,以期获得对链孢霉和绿色木霉有较强抑制作用且与食用菌相容性好的海洋细菌优良菌株;结合菌株形态特征、生理生化试验、16S rDNA和gyrB序列分析结果对优良拮抗菌株进行鉴定,明确菌株的分类地位,为食用菌污染菌的生物防治提供新型优良菌株。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 92株海洋细菌菌株由本实验室从连云港海域分离获得并保藏,链孢霉和绿色木霉由本实验室从连云港恒润食用菌有限公司菇房污染菌袋中分离纯化获得,生理生化试验对照菌大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)由本实验室保藏提供。
1. 1. 2 培养基 海洋细菌和供试真菌的活化、平板对峙试验及细菌菌落特征观察培养基为PDA培养基,金黄色葡萄球菌和大肠杆菌的培养基为牛肉膏蛋白胨培养基。
1. 2 链孢霉和绿色木霉拮抗菌株筛选
1. 2. 1 海洋细菌不同菌株对链孢霉和绿色木霉菌丝生长的抑制作用 采用平板对峙法测定92株海洋细菌菌株对链孢霉和绿色木霉的抑制作用。在PDA培养基平板中央接种链孢霉或绿色木霉,将链孢霉于28 ℃培养14 h或绿色木霉在28 ℃培养48 h,用打孔器取直径5 mm的链孢霉或绿色木霉菌菌苔接种于新的PDA培养基平板中央,在距离菌苔15 mm处等距离接种不同细菌菌株,以不接种细菌为对照,28 ℃恒温倒置培养1~3 d,测量不同海洋细菌菌株对链孢霉的抑菌圈直径和对绿色木霉的抑菌带宽度,每个菌株3次重复。比较不同海洋细菌菌株的抑菌作用。
1. 2. 2 海洋细菌不同菌株发酵液对链孢霉和绿色木霉菌丝生长的抑制作用 将抑菌作用较强的不同海洋细菌菌株分别接种到装有60 mL PD培养基的250 mL三角瓶中,28 ℃下180 r/min振荡培养52 h。发酵液于4 ℃下8000 r/min离心15 min,上清液用0.22 μm的细菌过滤器过滤得到无菌发酵液。采用打孔法测定不同菌株发酵液对链孢霉和绿色木霉的抑制作用。在PDA培养基平板中央接种直径5 mm已培养14 h的链孢霉或培养48 h的绿色木霉菌菌苔,在距病原菌15 mm处等距离用直径8 mm的打孔器打孔,每孔分别加入150 μL不同菌株的无菌发酵液,以等量PDA培养基为对照,28 ℃恒温培养,测量不同菌株无菌发酵液对链孢霉的抑菌圈直径和对绿色木霉的抑菌带宽度,每个菌株3次重复。
1. 2. 3 海洋细菌不同拮抗菌株与杏鲍菇的相容性测定 选取对链孢霉和绿色木霉有较强抑制作用的海洋细菌菌株,采用平板对峙法测定海洋细菌菌株与杏鲍菇菌丝的相容性。方法同1.2.1,28 ℃恒温持续培养10 d,觀察杏鲍菇菌丝生长状况。
1. 3 优良拮抗菌株种类鉴定
1. 3. 1 形态特征观察 将优良拮抗菌株接种至PDA培养基上培养48 h,观察优良拮抗菌株菌落形态、大小和颜色,菌落表面隆起程度、边缘的生长状况、光泽度及透明度;在光学显微镜下观察菌株细胞形态,对菌株进行革兰氏染色、荚膜染色、芽孢染色和鞭毛染色,观察结果。
1. 3. 2 生理生化试验 生理生化试验以大肠杆菌和金黄色葡萄球菌为对照,参照《伯杰氏细菌鉴定手册》(布坎南和吉本斯,1984)和《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)中的方法,测定优良菌株M.R.试验、V-P试验、硫化氢试验等21项生理生化指标。
1. 3. 3 优良拮抗菌株的16S rDNA和gyrB序列分析 细菌基因组DNA用生工生物工程(上海)股份有限公司的细菌基因组DNA快速抽提试剂盒按步骤提取。采用细菌16S rDNA序列通用引物进行扩增。PCR扩增条件:95 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行30个循环;72 ℃延伸7 min。采用1%琼脂糖对PCR扩增产物进行检测。将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,将测序结果提交NCBI数据库,采用BLAST程序与数据库中菌株序列进行比对,采用MEGA 7.0构建系统发育进化树。
若通过16S rDNA序列分析不能准确进行种类鉴定,则继续采用gyrB序列分析。gyrB序列扩增引物序列为UP1:5'-GAAGTCATCATGACCGTTCTG CAYGCNGGNGGNAARTTYGA-3';UP2r:5'-AGCA GGGTACGGATGTGCGAGCCRTCNACRTCNGC RTC NGTCAT-3'(刘国红,2009)。PCR扩增条件:94 ℃预变性5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,进行35个循环;72 ℃延伸10 min。采用1%琼脂糖对PCR扩增产物进行检测。扩增产物测序及比对同16S rDNA序列分析。
2 结果与分析
2. 1 链孢霉和绿色木霉拮抗菌株的筛选结果
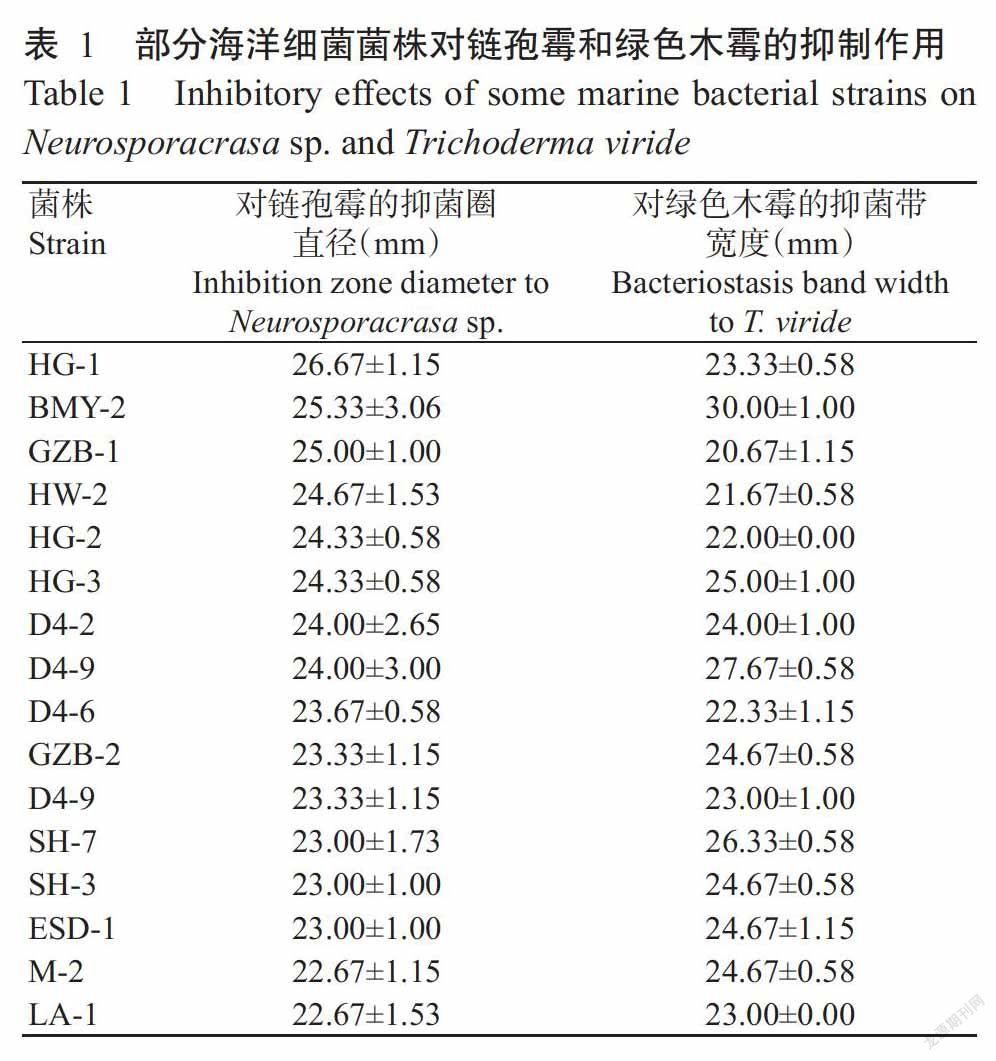
2. 1. 1 海洋细菌不同菌株对链孢霉和绿色木霉菌丝生长的抑制作用 平板对峙试验结果显示,92株供试海洋细菌菌株中有79株菌株对链孢霉有抑制作用,其中27株菌株的抑菌圈直径在20.00 mm以上,以HG-1菌株的抑制作用最强,抑菌圈直径为26.67 mm;73株菌株对绿色木霉有抑制作用,其中70株菌株的抑菌带宽度在20.00 mm以上,以BMY-2菌株的抑制作用最强,抑菌带宽度为30.00 mm。69株菌株对2种病原菌均具有一定的抑制作用,其中,HG-1菌株对链孢霉的抑制作用最强,但对绿色木霉的抑制作用较弱;BMY-2菌株对链孢霉和绿色木霉均具有较强的抑制作用,抑菌圈直径和抑菌带宽度分别为25.33和30.00 mm(表1)。
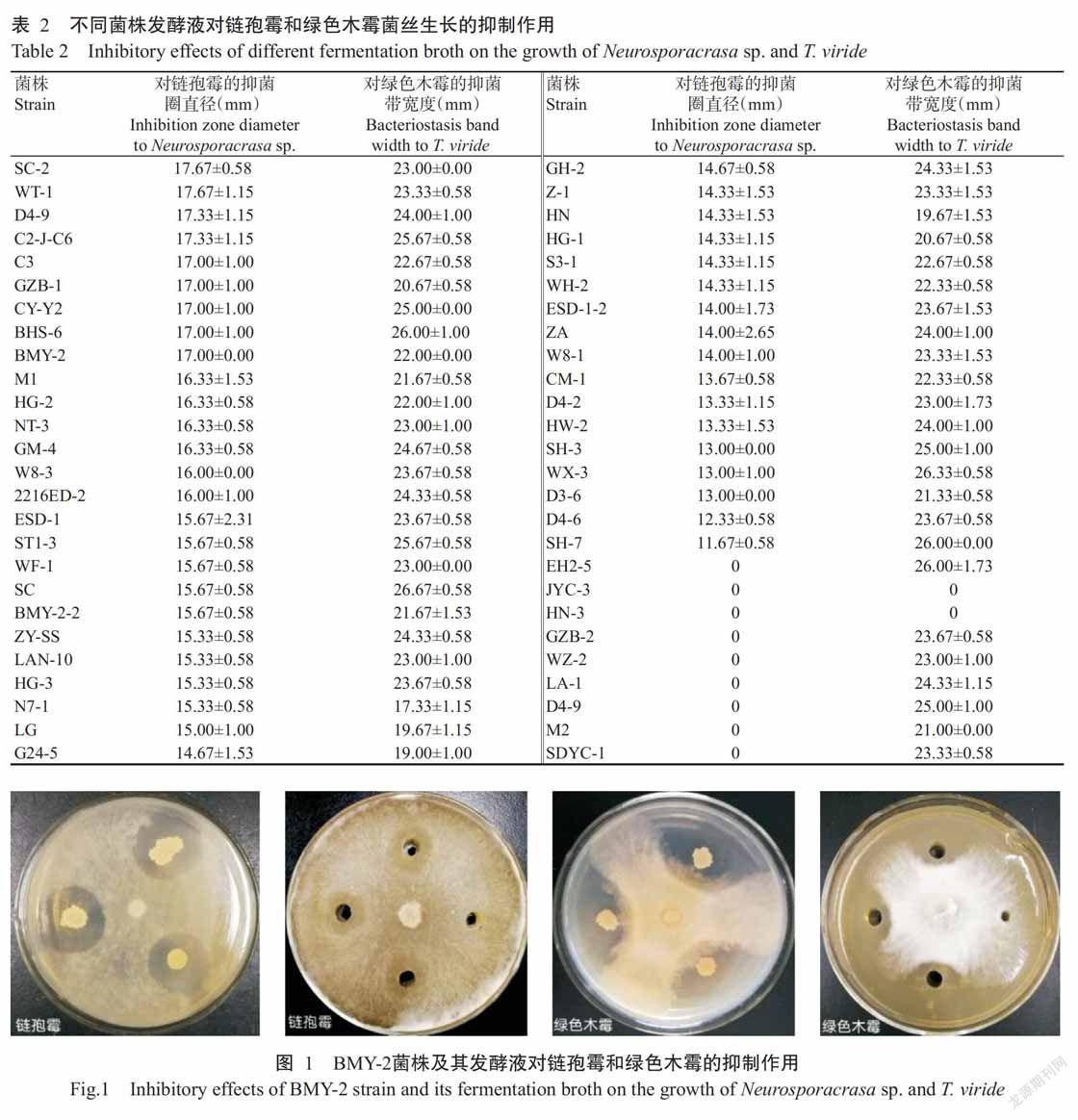
2. 1. 2 海洋细菌不同菌株发酵液对链孢霉和绿色木霉菌丝生长的抑制作用 选取52株对链孢霉和绿色木霉具有抑制作用的海洋细菌进行菌株发酵液抑菌作用测定,其中有43株菌株发酵液对链孢霉和绿色木霉均具有抑制作用。由表2可知,52株菌株中有15株菌株发酵液对链孢霉的抑菌圈直径在16.00 mm以上;有46株菌株发酵液对绿色木霉的抑菌带宽度在20.00 mm以上;BMY-2菌株发酵液对链孢霉和绿色木霉的菌丝生长均具有较强抑制作用,对应的抑菌圈直径和抑菌带宽度分别为17.00和22.00 mm(图1)。
2. 1. 3 拮抗菌株与杏鲍菇的相容性测定结果 选取15株对链孢霉和绿色木霉均具有较强抑制作用的菌株与杏鲍菇进行相容性测定,结果显示,BMY-2、ZA-1和SH-7等10株菌株与杏鲍菇对峙培养6 d时,杏鲍菇菌丝生长缓慢,有轻微抑制现象;培养第8 d后,杏鲍菇菌丝生长恢复正常,逐渐覆盖细菌菌落,表明对杏鲍菇的生长无明显影响(图2);NT-3、WF-1、HG-3、W8-3和SC-2菌株培养10 d对杏鲍菇的菌丝生长有一定抑制作用,抑菌带宽度大于8.00 mm(表3,图3)。
结合抑菌试验结果,BMY-2菌株及其发酵液对链孢霉和绿色木霉均具有较强的抑制作用,且对杏鲍菇菌丝生长无明显影响,可作为防治食用菌污染菌链孢霉和绿色木霉的优良菌株。
2. 2 优良拮抗菌株的种类鉴定
2. 2. 1 形态特征观察 BMY-2菌株在PDA培养基上培养24 h,其菌落呈圆形、隆起、乳白色,边缘不整齐、表面湿润,培养48 h后菌落颜色加深,菌落表面出现褶皱。细胞呈杆状,G+,有芽孢,芽孢中生,无鞭毛,有荚膜(图4)。
2. 2. 2 生理生化试验 BMY-2菌株可利用葡萄糖、蔗糖和果糖,不利用麦芽糖、半乳糖、阿拉伯糖、鼠李糖、山梨醇、甘露醇和肌醇;淀粉水解試验、苯丙氨酸脱氨酶试验、V-P试验、明胶液化试验、氧化酶试纸试验均呈阳性,半固体琼脂和M.R.试验呈阴性(表4)。
根据形态特征观察和生理生化试验结果,查阅《伯杰氏细菌鉴定手册》(布坎南和吉本斯,1984),并参考刘国红(2009)芽孢杆菌的分类鉴定文献,BMY-2菌株的特性与芽孢杆菌属(Bacillus)一致,初步判断BMY-2菌株为芽孢杆菌属。
2. 2. 3 BMY-2菌株16S rDNA序列分析 以菌株基因组DNA为模板,利用16S rDNA扩增的通用引物进行扩增,扩增产物用1%琼脂糖凝胶电泳检测,结果表明,扩增产物约1500 bp,符合16S rDNA序列大小,测序结果为1454 bp。
菌株16S rDNA序列在GenBank中进行比对分析,结果显示BMY-2菌株与解淀粉芽孢杆菌(B. amyloliquefaciens)和贝莱斯芽孢杆菌(B. velezensis)的相似性均在98%以上,采用MEGA 7.0构建系统发育进化树,结果(图5)发现BMY-2菌株与Bacillus subtilis C11-5、B. amyloliquefaciens ZW05和Bacillus velezensis Tr02M等菌株在同一分支上,但同源性较低,说明通过16S rDNA序列分析未能准确将菌株鉴定到种的水平。
2. 2. 4 BMY-2菌株gyrB序列分析 以BMY-2菌株基因组DNA为模板,利用gyrB扩增引物进行扩增,扩增产物用1%琼脂糖凝胶电泳检测,得到约1300 bp的PCR扩增产物,符合gyrB序列大小,测序结果为1203 bp。BMY-2菌株的gyrB序列在GenBank中进行比对分析,发现BMY-2菌株gyrB序列与B. amyloliquefaciens的相似性达99%。
采用MEGA 7.0构建系统发育进化树,结果(图6)显示,BMY-2菌株与B. amyloliquefaciens chenj-1菌株在同一分支上,且同源性达99%。
根据细菌形态特征观察、生理生化试验结果、16S rDNA序列分析和gyrB序列分析结果,可确定BMY-2菌株为解淀粉芽孢杆菌。
3 讨论
本研究发现92株供试海洋细菌菌株中有69株菌株对食用菌污染菌链孢霉和绿色木霉均具有一定的抑制作用,可能因为供试菌株为本实验室筛选出的可用于防治植物病害的生防细菌,植物病原真菌与链孢霉和绿色木霉同为真菌,大多数供试菌株对真菌具有广谱抗性。优良拮抗菌株与杏鲍菇的相容性试验结果表明,部分抑菌效果较好的菌株对杏鲍菇菌丝生长也有一定抑制作用,但抑制作用较小,与吴小平等(2009)、孟文文等(2015)的研究结果一致,其原因主要是链孢霉、绿色木霉和食用菌均为真菌,生防细菌产生的抑菌物质对病原菌和食用菌的生长均具有抑制作用。因此,需进一步从生防菌中筛选对食用菌影响小而对病原菌靶标性强的优良菌株,或采用生物技术改造优良生防细菌,使其对污染菌的抑制作用强而对食用菌无影响。
解淀粉芽孢杆菌是生防细菌的重要一员,连燕萍(2016)、陈嘉敏等(2018)、段海明等(2018)、王雪等(2019)、张莹等(2019)研究发现解淀粉芽孢杆菌能产生抗菌蛋白和脂肽类抗菌物质,可在黄瓜和人参等植物中定殖,并在一定程度上诱导植株产生抗病性。本研究筛选出的海洋解淀粉芽孢杆菌BMY-2菌株生长环境不同于陆源解淀粉芽孢杆菌,海洋环境温度较低,盐分高,其不仅能在普通土壤中生长,还能适应寡营养、高盐分的盐碱地区,因此该菌株的应用范围更加广阔,且定殖能力较强。但该菌株的抑菌作用机理尚不明确,推测其通过产生抑菌物质抑制病原菌孢子萌发、破坏病原菌菌丝而防治食用菌病害。此外,由于海洋环境的特殊性,可能该海洋细菌产生抑菌物质中存在不同于陆源解淀粉芽孢杆菌的抑菌物质。在本研究基础上,还应进一步研究BMY-2菌株的生长特性及发酵工艺,以提高BMY-2菌株的发酵水平,为该菌株应用于食用菌病害生物防治提供理论依据;同时,该海洋解淀粉芽孢杆菌用于食用菌病原菌的抑菌防病机理也有待进一步探究。
4 结论
筛选获得的海洋细菌BMY-2菌株为解淀粉芽孢杆菌(B. amyloliquefaciens),该菌株对链孢霉和绿色木霉均具有较好的抑制效果,且对杏鲍菇菌丝生长无明显影响,是一株优良的生防细菌,在杏鲍菇等食用菌链孢霉和绿色木霉污染的生物防治上具有较好的应用前景。
参考文献:
暴增海,马桂珍,王淑芳,葛平华,付泓润,周向红. 2013. 海洋放线菌BM-2菌株对黄瓜的促生作用和诱导抗性研究[J]. 作物杂志,(5):94-98. [Bao Z H,Ma G Z,Wang S F,Ge P H,Fu H R,Zhou X H. 2013. Growth-promoting and induced resistance of marine Paenibacillus polymyxa BM-2 in cucumber[J]. Crops,(5): 94-98.]
边银丙. 2013. 食用菌菌丝体侵染性病害与竞争性病害研究进展[J]. 食用菌学报,20(2):1-7. [Bian Y B. 2013. Research progresson infectious and competitive mycelial diaeases of edible mushrooms[J]. Acta Edulis Fungi Acta Edulis Fungi,20(2):1-7.]
布坎南 R E,吉本斯 N E. 1984. 伯杰氏细菌鉴定手册[M]. 第8版. 北京: 科学出版社. [Buchanan R E,Gibbons N E. 1984. Bergey’s manual of determinative bacteriology[M]. The 8th Edition. Beijing: Science Press.]
陈嘉敏,郭茂超,朱志强,傅本重,李国元,魏蜜. 2018. 解淀粉芽孢杆菌(Bacillus amyloliquefaciens)D2WM發酵培养基优化及对蔬菜种子萌发的影响[J]. 河南农业大学学报,52(6):903-910. [Chen J M,Guo M C,Zhu Z Q,Fu B Z,Li G Y,Wei M. 2018. Optimization of fermentation medium and effects of Bacillus amyloliquefaciens D2WM on seed germination of vegetables[J]. Journal of Henan Agricultural University,52(6):903-910.]
陈茹,吴海霞,曹雪梅,李欢,陈新元,马桂珍,暴增海. 2018. 海洋细菌BMF 03菌株对多种植物病原真菌和细菌的抑制作用[C]//中国植物病理学会.中国植物病理学会2018年学术年会论文集. 北京:中国农业科学技术出版社.[Chen R,Wu H X,Cao X M,Li H,Chen X Y,Ma G Z,Bao Z H. 2018. Inhibitory effects of marine bacterial strain BMF 03 on various plant pathogenic fungi and bacteria[C]//Chinese Society for Plant Pathology. Proceedings of the 2018 Annual Meeting of Chinese Society for Plant Pathology. Beijing: China Agricultural Science and Technology Press.]
陈小丽. 2009. 双孢蘑菇病害无害化化学防治技术研究[D]. 兰州:甘肃农业大学. [Chen X L. 2009. Study of harmless chemical management techniques on Agaricus bisporus diseases[D]. Lanzhou:Gansu Agricultural University.]
东秀珠,蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社. [Dong X Z,Cai M Y. 2001. Manual for syste-matic identification of common bacteria[M]. Beijing: Scien-ce Press.]
段海明,程红,余利,黄伟东,余海兵. 2018. 解淀粉芽孢杆菌gfj-4发酵上清液及其混剂对玉米纹枯病菌的抑制活性[J]. 江苏农业学报,33(6):1249-1256. [Duan H M,Cheng H,Yu L,Huang W D,Yu H B. 2018. Inhibitory activity of Bacillus amyloliquefaciens gfj-4 fermentation supernatant and its association with chemical fungicides against Rhizoctonia solani[J]. Jiangsu Journal of Agricultural Sciences,33(6):1249-1256.]
葛平华. 2013. 海洋颉颃菌的筛选及其对核盘菌抑制作用的研究[D]. 南京:南京农业大学. [Ge P H. 2013. Scree-ning of marine antagonistic bacteria and its inhibition of Sclertinia sclerotiorum[D]. Nanjing:Nanjing Agricultural University.]
江英成. 2001. 香菇杂菌绿色木霉室内抑制试验初探[J]. 河北林果研究,16(1):59-62. [Jiang Y C. 2001. Preliminary study on laboratory control of xianggu mushroom competed mould(Trichoderma viride)[J]. Hebei Journal of Forestry and Orchard Research,16(1): 59-62.]
连燕萍. 2016. 解淀粉芽孢杆菌MG-3抗菌物质的分离纯化及其应用[D]. 福州:福州大学. [Lian Y P. 2016. Purification and application of antibacterial material of Bacillus amyloliquefaciens MG-3[D]. Fuzhou:Fuzhou University.]
林娓娓,赵明文,于海龙,王瑞娟,郭倩. 2011. 5株拮抗细菌对链孢霉的拮抗作用[J]. 上海农业学报,27(2): 106-110.[Lin W W,Zhao M W,Yu H L,Wang R J,Guo Q. 2011. Antagonistic action of 5 strains of antagonistic bacteria on Neurospora sp.[J]. Acta Agriculturae Shanghai,27(2): 106-110.]
刘国红. 2009. 芽孢杆菌的分类鉴定及其相关属的分类系统演变研究[D]. 福州:福建农林大学. [Liu G H. 2009. The studies on classification and identification of Baci-llus and systematic evolution in the genera related with Bacillus[D]. Fuzhou:Fujian Agriculture and Forestry University.]
马桂珍,付泓润,王淑芳,暴增海,吴少杰,钱俊晖. 2013. 海洋多粘类芽孢杆菌L1-9菌株发酵液抗菌谱及稳定性测定[J]. 海洋通报,32(3): 316-320. [Ma G Z,Fu H R,Wang S F,Bao Z H,Wu S J,Qian J H. 2013. Fermentation conditions for production of antibacterial substances by marine Paenibacillus polymyxa strain L1-9 and antibacterial spectrum of produced active substances[J]. Marine Science Bulletin,32(3): 316-320.]
马林,曲绍轩,王晓强,邓鹏,林金盛,李辉平,侯立娟,蒋宁,宋金俤,LU Shi-en. 2016. 食用菌木霉的生防细菌鉴定及相关基因功能预测[J]. 江苏农业学报,32(3): 528-533. [Ma L,Qu S X,Wang X Q,Deng P,Lin J S,Li H P,Hou L J,Jiang N,Song J D,Lu S E. 2016. Identification of an antifungal bacterium against mushroom pathogen Trichoderma viride and characterization of genes asso-ciated with antifungal activity[J]. Jiangsu Journal of Agri-cultural Sciences,32(3): 528-533.]
孟文文,徐正银,黎金锋,姚晓华,刘斌. 2015. 拮抗细菌B44对食用菌致病木霉的抑制作用[J]. 广东农业科学,42(19): 73-76. [Meng W W,Xu Z Y,Li J F,Yao X H,Liu B. 2015. Antifungal activity of B44 against Trichoderma in mushroom[J]. Guangdong Agricultural Sciences,42(19): 73-76.]
曲均革,吴慧梅,陈雄剑. 2018. 抑制农业病害真菌的海洋微生物筛选及发酵工艺优化[J]. 安徽农业科学,46(15): 7-9. [Qu J G,Wu H M,Chen X J. 2018. Screening of marine microorganisms and optimization of fermentation technology for inhibiting the agricultural disease fungi[J]. Journal of Anhui Agricultural Sciences,46(15):7-9.]
王雪,張丹妮,王春伟,陈欣,杨丽娜,卢宝慧,高洁. 2019. 解淀粉芽孢杆菌FS6在人参体内的定殖特性及对人参诱导抗病性[J]. 西北农林科技大学学报(自然科学版),47(7):1-6. [Wang X,Zhang D N,Wang C W,Chen X,Yang L N,Lu B H,Gao J. 2019. Colonization and induced resistance of Bacillus amyloliquefaciens FS6 in ginseng[J]. Journal of Northwest A & F University(Na-tural Science Edition),47(7):1-6.]
吴小平,彭建升,谢宝贵,柯斌榕,胡方平. 2009. 食用菌污染菌脉孢菌的生物防治[J]. 中国食用菌,28(2): 51-53. [Wu X P,Peng J S,Xie B G,Ke B R,Hu F P. 2009. Bio-logical control of Neurospora species from edible fungi[J]. Edible Fungi of China,28(2): 51-53.]
吴晓金. 2008. 食用菌栽培相关木霉的调查和分析[D]. 福州:福建农林大学. [Wu X J. 2008. Research and analysis of Trichoderma spp. related mushroom cultivation[D]. Fuzhou:Fujian Agriculture and Forestry University.]
辛颖. 2016. 食用菌链孢霉发生与防治[J]. 西北园艺:蔬菜,14(2): 36-37. [Xiu Y. 2016. The occurrence and control of Streptomyces edible fungi[J]. Northwest Horticulture:Vegetables,14(2): 36-37.]
熊小龙. 2011. 四川金针菇木霉病害的研究及金针菇菌株抗性分析[D]. 雅安:四川农业大学. [Xiong X L. 2011. A research of pathogenic trichoderma of Flammulina velutipes in Sichuan and the analysis of resistantce for Flammulina velutipes strains[D]. Ya’an:Sichuan Agricultral University.]
杨定祥,林巧玲,卢乃会,何红,黄银燕,黄勤知,曹永军. 2018. 拮抗辣椒疫霉菌海洋细菌菌株SH-27的筛选鉴定及其防病促生作用[J]. 微生物学通报,45(1): 54-63.[Yang D X,Lin Q L,Lu N H,He H,Huang Y Y,Huang Q Z,Cao Y J. 2018. Screening and identification of a marine bacterium strain SH-27 against Phytophthora capsici causing pepper phytophthora blight[J]. Microbiology Chi-na,45(1): 54-63.]
杨胜清,张帆,马贵龙. 2017. 贝莱斯芽孢杆菌S6拮抗物质分离纯化及抑菌机理[J]. 农药,56(9): 645-648.[Yang S Q,Zhang F,Ma G L. 2017. Purification and inhibitive mechanism of antagonist substances from Bacillus velezensis S6 strain[J]. Agrochemicals,56(9): 645-648.]
张柳莲,王庆福,黄清铧,张伟伟,陈盈盈,梁磊. 2017. 几种杀菌剂对秀珍菇及链孢霉抑菌效果分析[J]. 食用菌,39(2): 65-66. [Zhang L L,Wang Q F,Huang Q H,Zhang W W,Chen Y Y,Liang L. 2017. Antimicrobial effect of several fungicides on Pleurotus ostreatus and Streptomyces sp.[J]. Edible Fungi,39(2): 65-66.]
張同睿. 2018. 多粘类芽孢杆菌SC2发酵条件优化及抑菌物质的分离纯化[D]. 泰安:山东农业大学. [Zhang T R. 2018. Optimization of fermentation conditions and puification of antimicrobial lipopeptides produced by Paenibacillus polymyxa SC2[D]. Tai’an:Shandong Agricultural University.]
张莹,秦宇轩,尚庆茂,张一凡,李昌辉,李平兰. 2019. 解淀粉芽孢杆菌L-S60与黄瓜互作特性研究[J]. 农业机械学报,1(14): 1-9. [Zhang Y,Qin Y X,Shang Q M,Zhang Y F,Li C H,Li P L. 2019. Characterization of interaction between Bacillus amyloliquefaciens L-S60 and Cucumbers[J]. Transactions of the Chinese Society for Agricultural Machinery,1(14):1-9.]
朱富春. 2013. 食用菌链孢霉的发生特点与综合防治技术[J]. 食用菌,35(1): 55-56. [Zhu F C. 2013. Occurrence chara-cteristics and comprehensive control techniques on Neurospora sp. edible fungi[J]. Edible Fungi,35(1):55-56.]
(责任编辑 麻小燕)
