浒苔腐烂液的生物毒性及其对太平洋牡蛎胚胎发育的影响
2019-09-10付萍何健龙张秀珍姜会超刘爱英程玲于广磊宋秀凯
付萍 何健龙 张秀珍 姜会超 刘爱英 程玲 于广磊 宋秀凯



摘要:为防范浒苔绿潮次生灾害和降低海水养殖风险,文章采用人工授精的太平洋牡蛎胚胎、不同相对浓度的浒苔腐烂液以及基于发光细菌的生物毒性检测法,通过实验分析浒苔腐烂液的生物毒性及其对太平洋牡蛎胚胎发育的影响。研究结果表明:随着浒苔腐烂液相对浓度的提高,太平洋牡蛎D形幼虫相对孵化率逐渐降低至0,滞育和畸形等非正常胚胎增多,囊胚-原肠期和担轮幼虫期占比降至极低,易发生卵膜破裂和卵裂球分散,这些与太平洋牡蛎胚胎发育的阶段特点和浒苔腐烂液生物毒性的作用机制等有关;浒苔腐烂液相对浓度(0.25~10 g/L)与生物毒性呈显著正相关,生物毒性(10%~97%)与相对孵化率呈显著负相关,且生物毒性达重毒水平时(由56%至70%)相对孵化率大幅下降(由66%至18%);建议在太平洋牡蛎胚胎发育的相对孵化率为50%时发出浒苔绿潮的渔业高风险预警,对应的浒苔腐烂液相对浓度为4.6 g/L、生物毒性为55%。
关键词:绿潮;生物毒性;相对孵化率;海洋贝类;海水养殖
Abstract:To prevent the secondary toxic hazard of Ulva prolifera Green tide and reduce the risk of mariculture,the biotoxicity of U.prolifera decomposing solution and its effect on the embryonic development of Crassostrea gigas were studied.The fertilized eggs within 1 h after fertilization were taken as the experiment subjects while determining the biotoxicity by luminous bacteria method.The results showed that the biotoxicity was obviously increased with increasing decomposing solution concentration.At the same time,diapauses and deformities were more serious and the relative hatching rate was decreased gradually.The higher the concentration of decomposing solution was,the higher risk of egg membrance ruptured and blastomere scattered.They were related to the characteristics of embryonic development of C.gigas and the effect of secondary toxicity caused by decomposing solution.There was a significant positive correlation between the relative concentration of U.prolifera decomposing solution (0.25 to 10 g/L) and the biotoxicity,and a strong negative correlation between the biotoxicity (10% to 97%) and the relative hatching rate.When the biotoxicity increased from 56% to 70%,the relative hatching rate decreased from 66% to 18%.In order to effectively prevent the secondary toxicity caused by U.prolifera decay,it is suggested to take the 50% relative hatching rate of C.gigas as the warning value,when the corresponding concentration was 4.6 g/L and the biotoxicity was 55%.
Key words:Green tide,Biotoxicity,Relative hatching rate,Marine bivalve,Mariculture
0 引言
綠潮是有害的藻华现象,通常发生在富营养化程度较高的水域环境,其中黄海绿潮的主要藻种为浒苔(Ulva prolifera)[1]。浒苔腐烂分解可产生毒性,严重影响海洋生物的生长发育,给海水养殖业带来较大风险[2]。太平洋牡蛎(Crassostrea gigas)是全球牡蛎养殖规模最大和产量最高的品种,具有较高的经济价值和营养价值,同时是良好的海水环境指示生物[3]。
目前鲜有浒苔次生毒性对太平洋牡蛎胚胎发育影响的研究,其危害尚不明确。由于浒苔湿重计量的误差较大及其腐烂程度不易掌控,本研究采用灵敏度较高的基于发光细菌的生物毒性检测法[4],可表征浒苔腐烂液的生物毒性,并初步分析其与太平洋牡蛎胚胎发育的相关性,为科学规避海水养殖风险和评估绿潮灾害风险提供技术支持。
1 实验设计
于2018年7月13日自山东省威海市乳山市近岸海域挑选性腺成熟度好的太平洋牡蛎亲贝雌贝和雄贝各2个,以人工授精的方式获得其受精卵:将雌贝和雄贝的性腺分别解剖置于装有自然海水的烧杯中,以200目筛绢过滤杂质,取2 mL精液加入卵子悬浮液,经玻璃棒搅拌后用显微镜计数,将加入精液的时间视为受精时间。于乳山市近岸海域采集浒苔并冰冻备用,实验时取出,按50 g/L的浓度比例放入装有自然海水的5 L锥形瓶,置于黑暗环境,在腐烂发酵5 d后经JP80筛绢过滤,制成浒苔腐烂液母液。其他主要仪器和试剂包括Delta Tox Ⅱ便携式生物毒性分析仪(SDI公司)、显微镜(Olympus DP80)、发光细菌冻干粉-费氏弧菌(Vibrio fischeri,NRRL B-11177)和Microtox稀释剂。
采用250 mL样品瓶,分别独立暴露不同浓度的浒苔腐烂液:实验组按两端等比和中间等差倍数添加浒苔腐烂液,每组试液容量为200 mL,并换算相对浓度,共设置10个浓度梯度和1个对照组,每组3个平行。采用便携式生物毒性分析仪检测每个实验组浒苔腐烂液的生物毒性[5],并采用发光强度衰减量表征(表1)。
在各实验组放入等量(约800粒)太平洋牡蛎受精卵,采用半静水生物实验方法,每1 h通过一次性吸管手动吹气30 s,实验用海水温度为(23±1)℃、盐度为31.5。在实验进行22 h后用卢戈氏碘液固定胚胎,采用显微镜观察和记录其发育阶段的数量。太平洋牡蛎胚胎发育分为细胞期、囊胚期、原肠期、担轮幼虫期和D形幼虫期,由于囊胚期和原肠期的胚胎固定后于显微镜下难以区分,二者合并计数。
采用相对孵化率计算太平洋牡蛎胚胎发育至D形幼虫的占比,即实验组与对照组太平洋牡蛎胚胎发育至D形幼虫的占比之比。采用Excel和SPSS软件统计D形幼虫相对孵化率和胚胎各发育阶段占比等数据,采用Origin 7.5软件进行浒苔腐烂液相对浓度、生物毒性和相对孵化率的线性拟合。
2 实验结果和分析
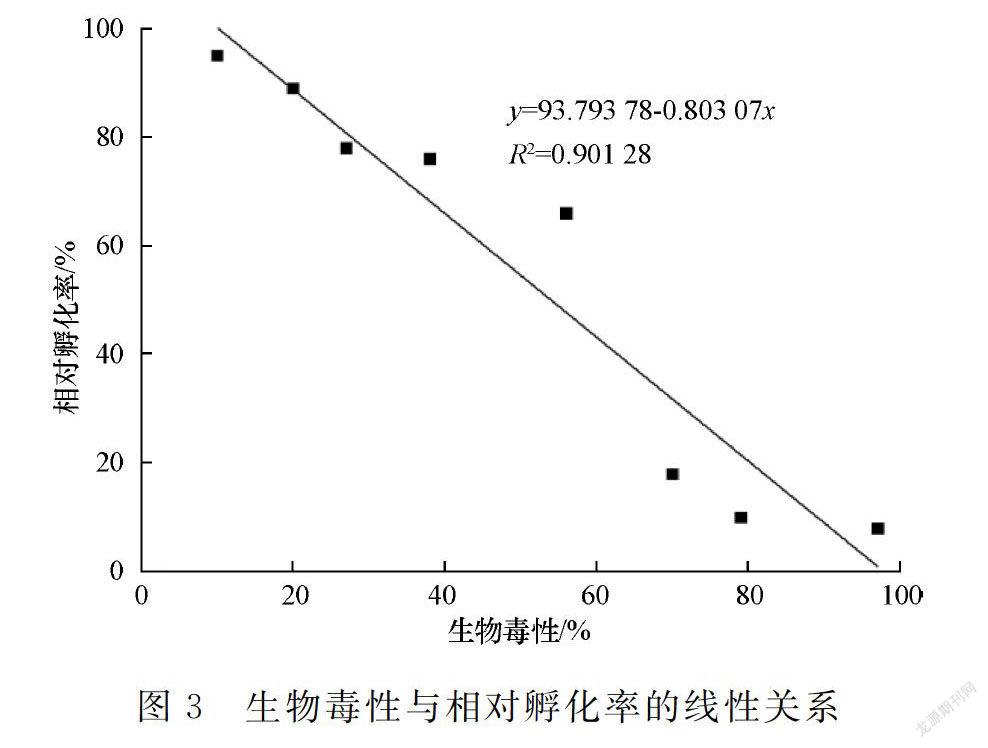
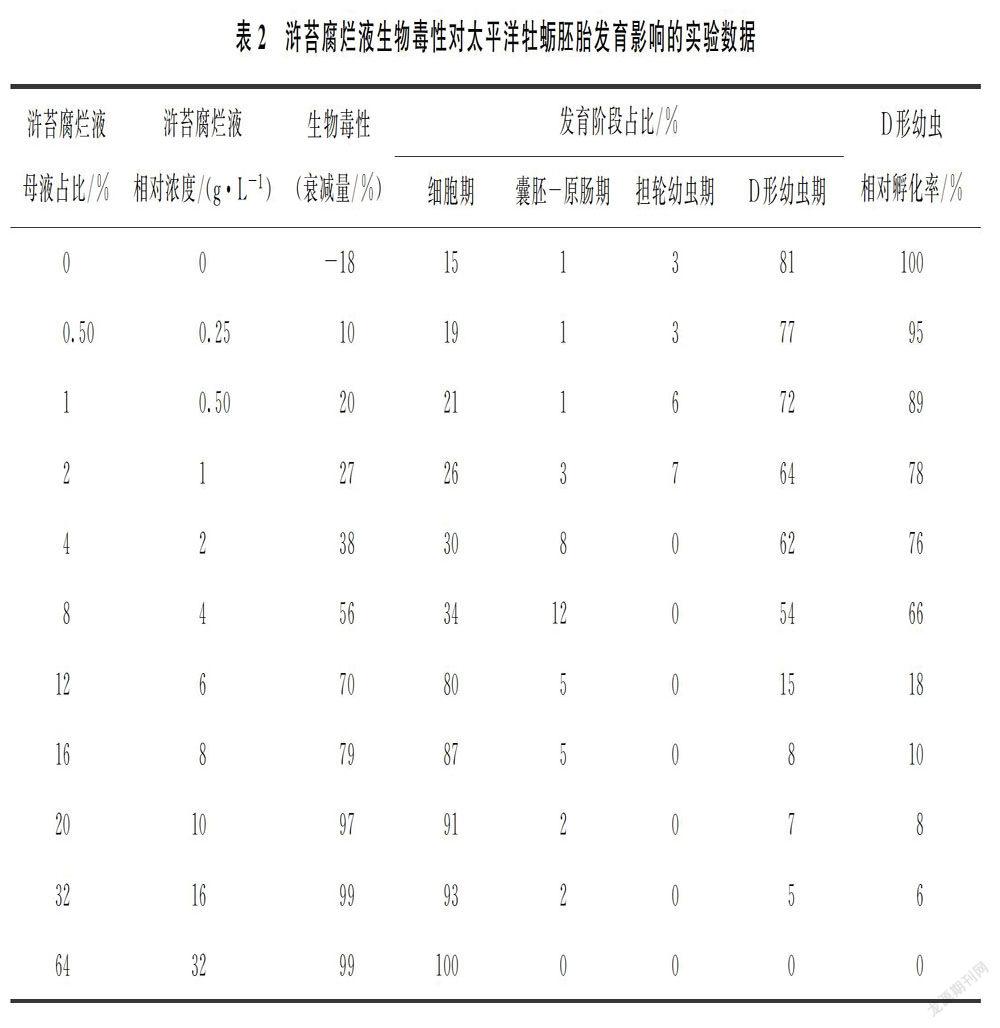
太平洋牡蛎受精卵在自然海水中孵化22 h后可发育至D形幼虫。浒苔腐烂液生物毒性对其胚胎发育影响的实验结果如表2和图1所示。
2.1 主要影响
太平洋牡蛎的卵子在组织中被挤压呈梨形,在海水中悬浮后逐渐呈圆形,受精后表面更加光滑圆润,直径约为50 μm(图1(a))。随着浒苔腐烂液相对浓度(母液占比)的提高,太平洋牡蛎胚胎发育受到不同程度的影响,主要包括4个方面。
(1)D形幼虫相对孵化率逐渐降低,且浒苔腐烂液相对浓度为32%时,已观察不到D形幼虫。
(2)滞育和畸形等非正常胚胎增多(图1(b)~(h)),而正常D形幼虫减少(图1(i))。
(3)细胞期占比显著提高,而D形幼虫期占比显著降低:相对浓度为0~4 g/L时,D形幼虫期占比最高,其次是细胞期,中间阶段占比较低;相对浓度自6 g/L开始,细胞期占比极高,其次是D形幼虫期,中间阶段占比极低;相对浓度达到2 g/L时,已观察不到担轮幼虫。
(4)低浓度浒苔腐烂液易造成胚胎滞育和畸形,但细胞间隙较紧密(图1(b)~(d));而高浓度浒苔腐烂液易造成卵膜破裂和卵裂球分散(图1(e)~(g)),出现较多胚胎残渣。
本研究人工授精的太平洋牡蛎胚胎在自然海水中发育成D形幼虫的占比为81%,有研究表明自然受精的太平洋牡蛎胚胎孵化率更高[7-8]。高浓度浒苔腐烂液中囊胚-原肠期和担轮幼虫期占比极低,可能是由于卵膜破裂发生在囊胚-原肠期[9]:在囊胚-原肠期前,卵膜对胚胎抵抗不利的外界环境起到重要的保护作用;在担轮幼虫期后,D形幼虫开始从外界摄食,机体免疫力增强,适应外界环境的能力也逐渐提高;而囊胚-原肠期和担轮幼虫期的胚胎既没有卵膜保护,又无法摄食(有研究表明担轮幼虫期胚胎的防御相关酶活性较低[10])。因此,太平洋牡蛎胚胎在囊胚-原肠期和担轮幼虫期对外界环境的敏感度较高,度过该敏感期即可较顺利地发育成D形幼虫。此外,高浓度浒苔腐烂液中胚胎除滞育和畸形程度更高外,卵裂球分散和卵膜破裂现象较明显,可能是生物毒性越强,越易破坏卵膜和分解细胞组织间隙物质。
浒苔腐烂液相对浓度越高,壳缘和绞合线内凹以及外壳不完整的非正常D形幼虫(图1(h))越多,可能是由于浒苔腐烂分解产生的大量CO2溶于水,影响贝壳的形成。Kurihara等[11-12]研究CO2酸化海水对太平洋牡蛎胚胎发育的影响,发现海水pH值的降低严重影响贝壳钙化,这种损害可能同时存在合成和分解,还会影响其他海洋生物的钙化;海水pH值的降低还会加强H2S气体的毒性,藻类腐烂分解过程中产生的H2S气体[13]在酸性水体中的毒性甚至强于氨氮[14]。此外,大型藻类腐烂分解还易造成海水缺氧,导致海洋生物受损甚至死亡。
目前浒苔腐烂液中的有毒成分尚不明确[15]。Quinlan等[16]提出腐烂的褐藻会释放大量有毒物质,并认为波罗的海鲱鱼卵的大量死亡可能与褐藻腐烂分解过程中释放的毒性水溶溢出液有关;王超[17]发现浒苔腐烂液对海洋浮游生物和贝类均有明顯的毒性作用。
2.2 线性相关
自然海水为无毒。随着相对浓度的提高,浒苔腐烂液的生物毒性逐渐加强:相对浓度为0.25 g/L和0.5 g/L时为微毒,相对浓度为1 g/L和2 g/L时为中毒,相对浓度为4 g/L和6 g/L时为重毒,相对浓度为8 g/L及以上时为剧毒;相对浓度为10 g/L时迅速升至97%,相对浓度为16 g/L及以上时达最大值99%。经线性拟合,浒苔腐烂液相对浓度为0.25~10 g/L时,与生物毒性呈显著正相关,表明生物毒性可较好地表征相对浓度(图2)。
随着浒苔腐烂液生物毒性的加强,相对孵化率逐渐降低,表明胚胎发育受到明显抑制和损害。当生物毒性达重毒水平时(由56%至70%),相对孵化率大幅下降(由66%至18%),毒害效应显著。经线性拟合,浒苔腐烂液生物毒性为10%~97%时,其与相对孵化率呈显著负相关(图3)。
3 结语
浒苔腐烂液生物毒性对太平洋牡蛎胚胎发育的影响存在阈值,即浒苔腐烂液超过一定的相对浓度时,其生物毒性对太平洋牡蛎胚胎发育的影响极为显著。为更好地防范浒苔绿潮次生灾害,建议在太平洋牡蛎胚胎发育的相对孵化率为50%时发出浒苔绿潮的渔业高风险预警,对应的浒苔腐烂液相对浓度为4.6 g/L、生物毒性为55%。
参考文献
[1] WANG J F,JIANG P,CUI Y L,et al.Molecular analysis of green-tide-forming macroalgae in the Yellow Sea[J].Aquatic Botany,2010,93(1):25-31.
[2] NELSON T A,LEE D J,SMITH B C.Are“Green tides”harmful algal blooms?Toxic properties of water-soluble extracts from two bloom-forming macroalgae,Ulva fenestrata and Ulva riaobscura (Ulvophyceae) [J].Journal of Phycology,2003,39(5):874-879.
[3] ZHOU Q F,ZHANG J B,FU J J,et al.Biomonitoring:an appealing tool for assessment of metal pollution in the aquatic ecosystem[J].Analytica Chimica Acta,2008,606(2):135-150.
[4] 朱麗娜,刘瑞志,夏建新.基于发光细菌法的水体重金属标准限值毒性评价[J].环境与健康杂志,2013,30(1):52-55.
[5] 付萍,何健龙,张秀珍,等.发光细菌法在浒苔绿潮次生毒性快速检测中的应用[J].科学技术与工程,2019,19(1):288-292.
[6] BULICH A A.Practical and reliable for monitoring the toxcity of aquatic sample[J].Process Biochemistry,1982,17(2):45-47.
[7] HIS E,SEAMAN M N L,BEIRAS R.A simplification of the bivalve embryogenesis and larval development bioassay method for water quality assessment[J].Water Research,1997,31(2):351-355.
[8] THAIN J E.Biological effects of contaminants:oyster(Crassostrea gigas)embryo bioassay[J].Techniques in Marine Environmental Science,1991,11:3-12.
[9] 孙虎山,王宜艳,韩强,等.长牡蛎胚胎和早期幼虫非特异性酯酶和过氧化物酶的组织化学研究[J].中国水产科学,2006,13(6):897-901.
[10] 梁建光,白雪峰,巩淇,等.汞对太平洋牡蛎早期发育阶段三种防御相关酶活力的影响[J].水产科学,2014,33(1):35-39.
[11] KURIHARA H,KATO S,ISHIMATSU A.Effects of increased seawater CO2 on early development of the oyster Crassostrea gigas[J].Aquatic Biology,2007,1:91-98.
[12] KURIHARA H,SHIRAYAMA Y.Effects of increased atmospheric CO2 on sea urchin early development[J].Marine Ecology Progress Series,2004,274:161-169.
[13] EKLUND B,SVENSSON A P,JONSSON C,et al.Toxic effects of decomposing red algae on littoral organisms.Estuarine[J].Coastal and Shelf Science,2005,62(4):621-626.
[14] 李达.不同环境条件对双齿围沙蚕(Perinereis aibuhitensis)幼体发育的影响[D].青岛:中国海洋大学,2014.
[15] NORKKO A,BONSDORFF E.Altered benthic prey-availability due to episodic oxygen deficiency caused by drifting algal mats[J].Marine Ecology,1996,17:355-372.
[16] QUINLAN A V,LEWIS T,HOYT J K,et al.Fouling of the Sandy Beaches of Nahant Bay (Massachusetts,USA)by an abnormal free-living form of the Macroalga Pilayella littoralis (Phaeophyta).I.Habitat characteristics[J].Sandy Beaches as Ecosystems,1983,19:271-278.
[17] 王超.浒苔(Ulva prolifera)绿潮危害效应与机制的基础研究[D].青岛:中国科学院海洋研究所,2010.
