光照对血橙果实内外着色调控的影响
2019-09-10杨海健周心智张云贵杨蕾丁志祥
杨海健 周心智 张云贵 杨蕾 丁志祥


摘要:【目的】分析血橙在不同光照條件下果皮、果肉中花色苷和类胡萝卜素含量动态变化,获得光照对血橙内外着色的调控功能信息,为后期改善血橙外观品质提供科学依据。【方法】在塔罗科血橙果实转色前期采用不同透光率的果袋对果实进行梯度遮光处理,测定分析梯度遮光处理下血橙转色过程中果皮和果肉中花色苷及类胡萝卜素含量的动态变化规律,利用LC-MS法对黑袋处理和对照血橙果皮中花色苷类物质进行定性和定量分析。【结果】对照血橙果皮和果肉中的花色苷在花后215 d开始缓慢合成,花后245 d快速合成。套袋延缓果皮中花色苷的合成时间,降低其含量,但不影响果肉中花色苷的合成;在影响程度上,白袋处理对血橙果皮花色苷合成影响较小,棕袋和黑袋处理后基本不着色。血橙果皮和果肉中的类胡萝卜素合成规律不同,各种处理下的血橙果皮类胡萝卜素含量均在花后135~275 d呈U形变化特点,以花后185 d为分界点,先降后升,而果肉类胡萝卜素含量一直呈直线上升趋势。套袋影响血橙果皮类胡萝卜素的合成,但并不影响果肉中类胡萝卜素的合成;在影响程度上,白袋处理影响最小,基本与对照相近,棕袋和黑袋处理影响较大,两种果袋均使血橙果皮类胡萝卜素含量下降32%。在塔罗科血橙果皮中检测到矢车菊素-3-葡萄糖苷、矢车菊素-3(6''一丙二酰)葡萄糖苷和飞燕草素-3-芸香糖苷等主要花色苷类型。【结论】光照是调控塔罗科血橙果面着色的重要环境因子,但不参与调控果肉中色素的积累。光照影响血橙外观品质主要是通过调控果皮花色苷和类胡萝卜素的合成积累,且花色苷是最主要因子。血橙提质增效需从建园、技术上着重考虑光照因素,套袋虽对果面洁净有利,但不利于血橙外观色泽品质提升。
关键词: 血橙;花色苷;类胡萝卜素;着色;遮光
中图分类号: S666.4 文献标志码: A 文章编号:2095-1191(2019)09-2015-07
Abstract:【Objective】Dynamic analysis of the changes of anthocyanins and carotenoids in the peel and pulp of blood orange under different light conditions was conducted to obtain information on the regulation of light coloring inside and outside blood orange, and provide a scientific basis for improving the appearance quality of blood orange in the later stage.【Method】Bags with different light transmittances were used to conduct gradient shadings on Tarocco blood orange fruits in the early stage of colour-changed period. The total anthocyanin and carotenoid content dynamics in blood orange peel and flesh during color change period under the gradient shading treatment were determined. Qualitative analysis and quantitative analysis of anthocyanins in black bag treated and control blood orange peels were carried out by LC-MS. 【Result】The anthocyanin in the peel and pulp of the control Tarocco blood orange began to slowly synthesize at 215 d after flowering, and rapid synthesis began 245 d after flowering. The bagging delayed the synthesis time of anthocyanins in the peel and reduced the content, but did not affect the synthesis of anthocyanins in the pulp. In terms of the degree of influence, the white bag treatment had little effect on the anthocyanin synthesis of the blood orange peel, and the oranges in brown bag and the black bag were basically not colored after being treated. The synthesis of carotenoids in blood orange peel and pulp was different. The carotenoid content of blood orange peel under various treatments showed U type synthetic dynamics during 135-275 d after flowering, and with day 185 as the turning point, the carotenoids decreased first then increased. And the carotenoids of the flesh have been rising straight. Bagging affected the synthesis of carotenoids in the blood orange peel without affecting the pulp. In terms of the degree of influence, the white bag had the lowest impact and was basically close to the control. Brown bags and black bags had a higher impact, and the both reduced the carotenoid content of the blood orange peel by 32%. Tarocco blood orange contained three major anthocyanin types:cyanidin-3-glucoside, cyanidin-3-(6''-malonyl)-glucoside and delphinidin-3-rutinoside. 【Conclusion】Illumination is an important environmental factor regulating the coloration of the fruit of Tarocco blood orange, but it does not participate in regulating the accumulation of pigment in the flesh. The effect of light on the appearance quality of blood orange is mainly through the regulation of the synthesis and accumulation of anthocyanins and carotenoids in fruit, while anthocyanins are the main aspect. To improve the quality of blood oranges, it is necessary to focus on the lighting factors from the construction of orchards and technical improvements. Although bagging is beneficial to the cleansing of fruit, it is not conducive to the improvement of the color quality of blood oranges.
Key words: blood orange; anthocyanin; carotenoids; coloring; shading
0 引言
【研究意义】塔罗科血橙原产于地中海地区,目前在我国四川和重庆广泛栽培。血橙是由花色苷着色的特殊柑橘品种,外观颜色是评价其商品价值的一项重要指标。生产中发现塔罗科血橙在重庆不同区域和不同立地条件果园中的着色表现差异明显,血橙在日照时数较短的江津着色普遍比日照时数较长的万州浅。果品着色浅,其经济价值必将受到影响。因此,研究光照对血橙果实内外主要色素的合成调控作用,有利于后期通过技术创新人为改善外界条件以达到提高血橙质量的目的,对当前我国柑橘提质增效具有重要意义。【前人研究进展】柑橘类水果中红色色素主要分为两种,一类是番茄红素等脂溶性的类胡萝卜素,另一类是水溶性的花青素(曹少谦和潘思轶,2006)。血橙是典型的花青素着色柑橘品种(徐娟和邓秀新,2002)。花青素是植物体内重要的次生代谢物质,除遗传因素外,外界环境对其合成积累也具有重要调节作用。Jeong等(2004)研究发现葡萄对光照的响应因品种而异,葡萄品种赤霞珠在遮阴条件下果实花色苷含量降低,而Shiraz品种果实花色苷的积累不受遮阴影响;王中华等(2006)通过外施5-氨基乙酰丙酸和金雀异黄素促进了苹果果皮花青素的形成;Takos等(2006)发现光照能提高苹果中MdMYB1转录因子的表达水平,进而促進果皮中花青素的积累;Azuma等(2012)研究认为葡萄果皮花青素合成需要光和低温,相关合成基因表达同时受光照和温度的影响较大。血橙作为柑橘中的特殊品种,其花色苷合成积累受外界环境的调控鲜有研究。塔罗科是我国主栽的血橙品种,由于花色苷的积累(Angela,2015;陈嘉景等,2016),该品种成熟后果皮和果肉呈现诱人的紫红色。花色苷类物质不仅给血橙带来艳丽的外观,还具有重要的营养和药理作用。Kang等(2003)发现花青素可降低小鼠患结肠癌的风险;Chang等(2010)通过体内和体外试验认为黑米中的花青素提取物对乳腺癌细胞有抗性作用;Wallace(2011)研究表明,花青素在降低心血管疾病上发挥作用流行病学;Hanbali等(2013)开展提取酸樱桃花青素研究时发现其具有较强的抗氧化作用。因此,花青素着色代表着血橙最重要的经济性状和品质性状。【本研究切入点】由于柑橘中花青素着色品种非常少,以致于一直以来对柑橘色素的研究重点集中在类胡萝卜素上。近年来关于柑橘花青素的研究不断加强,但主要集中在花色苷的调控基因、物质稳定性和功能特性上,而外界环境对血橙花色苷合成积累的影响研究鲜见报道。【拟解决的关键问题】获得不同光照条件下血橙在转色期间果实花色苷和类胡萝卜素积累规律,明确光照对血橙果皮和果肉中主要色素合成积累的调控作用,为进一步创新农艺措施、改善生长条件、提高血橙品质提供科学依据。
1 材料与方法
1. 1 试验材料
试验地位于重庆市万州区甘宁镇西部农业开发有限责任公司塔罗科新系血橙园,该园为平地果园,海拔高度265 m;土壤为紫色土,土壤pH 6.7~7.2,土层厚度35~45 cm,土壤全氮、速效磷、有效钾和有机质含量分别为1.05%、27.8 mg/kg、497.6 mg/kg、1.41%;年平均气温17.7 ℃,年平均日照时数1484.4 h。于2017年选择园内光照条件较好位置的10株塔罗科血橙健康树摘取果实。3种不同透光率的果袋,分别为透光率65%的白色单层袋、透光率25%的棕色单层袋和透光率1%的外黄内黑双层黑色袋。
1. 2 试验方法
花后115 d对树冠外围朝南向的果实进行套袋处理,以不套袋果实作为对照。在花后135 d(绿皮期)、155 d(绿皮期)、185 d(转黄期)、215 d(转红初期)、245 d(转红中期)和275 d(转红后期)分别采集各处理果实进行果皮、果肉着色观察和花色苷、类胡萝卜素的分析测定。每处理采集5个果实,带回实验室将果皮油胞层和果肉分离、切碎,液氮研磨成粉后充分混匀,-80 ℃保存备用。
1. 3 样品测定
采用KONICA MINOLTA便携式色差计对成熟期各处理果实果面进行色泽分析,每处理测定3个果实,每个果实沿赤道均匀采集5个点进行测定。采用分光光度计法对不同时期各处理果皮和果肉粉末中类胡萝卜素含量进行测定。采用pH示差法(Rapisarda et al.,2000;曹少谦,2009)对不同时期各处理果皮和果肉粉末中总花色苷含量进行测定。采用LC-MS法对着色差别最大的两组果皮粉末样品(对照和黑袋遮光)进行花色苷定性和相对定量检测(青岛科创质量检测有限公司提供检测方法)。
1. 4 统计分析
试验数据采用Excel 2007进行整理分析及绘图,利用SAS 8.0的SAS ANOVE多重分析比较法进行差异显著性分析。
2 结果与分析
2. 1 不同发育期各处理血橙果皮和果肉颜色动态变化
如图1所示,血橙果实遮光后,其果皮叶绿素水平立刻下降(图1-A),下降程度与果袋透光率成反比,花后185 d对照果实叶绿素开始下降(图1-B);花后215 d,所有果实完成褪绿转黄,不同的是,对照果面开始呈现橙红色,而遮光处理果面仍为浅黄色,此时各处理果实的果肉颜色均为黄色(图1-C);花后245 d,对照果皮出现肉眼可见的花青素着色,白袋处理果实的果面出现花青素着色的时间较对照晚10 d,而棕袋和黑袋处理果实的果面未出现花青素着色,此时,各处理果实的果肉均已开始出现花青素着色的红紫色,且各处理间着色程度无规律性差异(图1-D);花后275 d,对照和白袋处理果皮颜色进一步加深,红色面积也进一步扩大,对照果面的红色面积达60%~90%,白袋处理可达40%~60%,而棕袋和黑袋处理的果实果面转为橙黄色,无花青素着色迹象,此时,对照和其他处理果实的果肉呈深紫红色,着色仍无规律性差异(图1-E)。
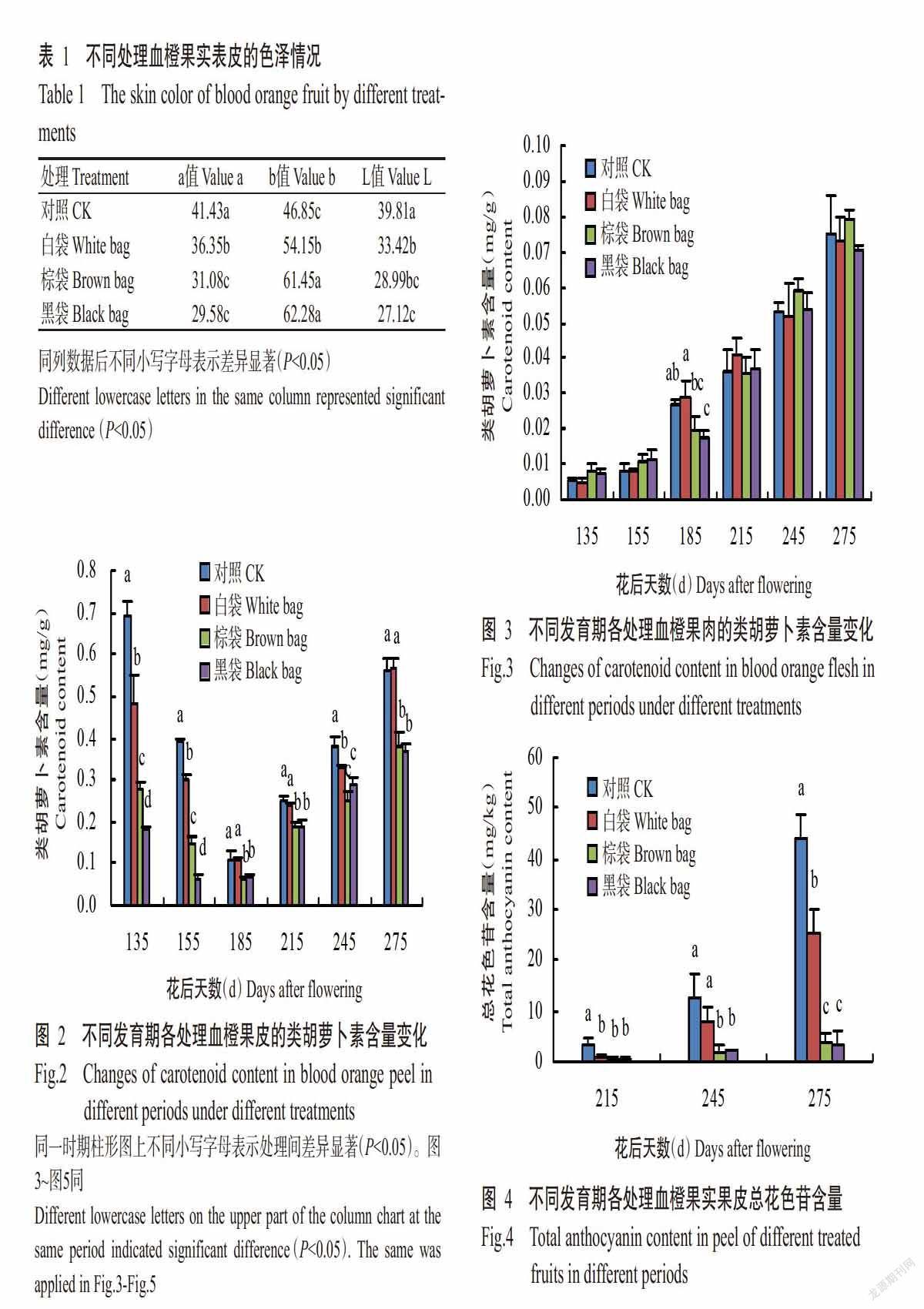
利用色差计对转红后期各处理果实表皮进行色差分析,结果(表1)显示,各处理间代表红色的a值依次为对照>白袋>棕袋>黑袋,代表黄色的b值则恰好相反;在a值和b值上,对照与其他处理间存在显著差异(P<0.05,下同),白袋与棕袋、黑袋处理间存在显著差异,棕袋与黑袋处理间无显著差异(P>0.05,下同)。果面亮度(L值)以不套袋的对照最高,黑袋处理最低。说明塔罗科血橙果面红色着色程度依果袋透光率的大小而不同,透光率越高果面着色越深,血橙果皮花色苷的积累量及果面亮度均与光照强度成正比。
2. 2 不同发育期各处理血橙果皮和果肉类胡萝卜素含量变化
如图2所示,遮光后血橙果皮类胡萝卜素含量立刻下降;花后135 d,套袋血橙果皮类胡萝卜素含量下降程度与果袋透光率呈反比,透光率越低下降越快;花后135~275 d对照和遮光血橙果皮的类胡萝卜素含量均呈U形变化特点,以花后185 d为分界点,先降后升。在上升过程中白袋处理与对照果皮的类胡萝卜素含量非常接近;棕袋和黑袋处理果皮的类胡萝卜素含量稍低,转红后期两处理果皮的类胡萝卜素含量为对照或白袋处理的68%左右。
与果皮不同,对照和各遮光处理血橙果肉的类胡萝卜素含量一直呈增长态势,未出现类似果皮中类胡萝卜素先降后升的变化趋势,且各处理血橙除花后185 d外在同一时期果肉中类胡萝卜素含量基本一致(图3)。
2. 3 不同发育期各处理血橙果皮和果肉总花色苷含量变化
如图4所示,不同处理果实在果皮总花色苷含量上差异明显。对照果皮在花后215 d已经有部分花色苷合成,而此时遮光处理果实的果皮花色苷合成很少,对照与各遮光处理间存在显著差异。花后245 d,对照和白袋处理果皮的总花色苷明显提升,而棕袋和黑袋处理果皮的总花色苷仅有少量增加,此时黑袋、棕袋和白袋处理果皮总花色苷含量分别是对照的18.3%、15.3%和63.2%。至花后275 d,对照和白袋处理果皮的总花色苷含量进一步大幅提升,且两者间的含量差距也逐渐拉大,此时棕袋和黑袋遮光处理果皮的总花色苷含量仍然是少量增加,黑袋、棕袋和白袋处理果皮总花色苷含量分别是对照的7.7%、8.9%和57.4%,差异更加明显。在花后215 d之前的各处理血橙果皮中未检测到花色苷。
如图5所示,血橙果肉花色苷合成规律与果皮有相似之处,花后215 d(11月下旬)血橙果肉花色苷已有少量合成,至花后245 d(12月下旬)达到一定量,之后(1月)是果肉花色苷快速合成和大量积累的重要时期。与果皮花色苷合成不同的是,在不同遮光处理下血橙果肉的总花色苷含量在各时期均无显著差异。同样,在花后215 d之前的各处理血橙果肉中未检测到花色苷。
2. 4 血橙果皮花色苷定性和定量分析结果
利用液相色谱—质谱联用技术对着色差异最大的两个样品果皮粉末进行花色苷检测,依据Metlin数据库鉴定出血橙果皮中存在4-酮叶黄素、紫黄素和岩藻黄质等类胡萝卜素及橙皮素、川皮苷、柑橘黄酮和花青素等物质。特征离子显示花青素分为矢车菊素和飞燕草色素两种。初步分辨出血橙果皮中含有矢车菊素-3-葡萄糖苷、矢车菊素-3(6''一丙二酰)葡萄糖苷和飞燕草素-3-芸香糖苷3种主要花色苷物质(图6)。
由表2可知,对照血橙果皮中的矢车菊素-3-葡萄糖苷在花后215~245 d有一个快速合成期,随后有所下降;矢车菊素-3 (6''一丙二酰)葡萄糖苷合成一直呈上升趋势,花后245~275 d是大量合成期;飞燕草素-3-芸香糖苷相对于前两类花色苷合成较早,在215 d之前已开始合成,花后215~245 d大量合成,之后合成平缓。而经黑袋遮光处理后,血橙果皮中3种花色苷合成明顯受到抑制,与对照相比合成均极大降低。
3 讨论
橙红色类胡萝卜素与紫红的花色苷叠加共同形成血橙果皮颜色。遮光处理抑制了血橙果皮花色苷和类胡萝卜素的合成积累,其中对花色苷抑制作用更为显著。在塔罗科血橙转色期间,遮光对其果实外观着色产生直接影响,影响程度与遮光率成正比,遮光率越高,血橙果实外观着色越浅,棕袋和黑袋遮光最终导致血橙果面不转红。而遮光对血橙果皮类胡萝卜素的合成影响不如对花色苷合成的影响大,白袋遮光对果皮类胡萝卜素的合成积累影响不明显,棕袋和黑袋处理仅使果皮类胡萝卜素减少32%左右。因此,光照作为塔罗科血橙果皮着色的重要环境因子,其影响方式主要通过调控果皮花色苷和类胡萝卜素的合成积累,而花色苷是主要受调控因子。通常认为花色苷的积累与糖分的积累有关,刘荣直(2010)在研究低氮条件下诱导拟南芥花青素积累时认为光和糖是必要条件,因此,光照强弱可能影响血橙果皮糖分含量的高低,进而上调或下调果面花色苷的合成。但陶俊等(2003)研究柑橘品种红柿柑套袋的结果发现遮光并不影响柑橘果皮糖分的积累,据此,光照调控血橙果皮花色苷合成的具体途径仍有待进一步明确。另外,尽管棕袋与黑袋的透光率不同,但两种遮光影响花色苷合成的结果仍非常接近,据此推断塔罗科血橙果皮花色苷积累的前提是要保持一定的光照强度,一旦低于这个光强,血橙果面将不会积累花色苷。因此,重庆一些地区或果园的塔罗科血橙果面着色较差可能与当地光照条件不足、果园立地条件较差、果面不净或树体郁闭有关。今后在提高血橙经济价值上,应充分考虑果实受光特性,选择受光较好的果园种植,通过补光、修剪等技术改善果面光照条件。尽管套袋提高了血橙果面的洁净度,避免了病虫侵害,但在很大程度上阻碍了果面花色苷的合成,且降低了果皮亮度,不利于血橙外观品质的提升。
在整个转色期间,不同遮光处理的塔罗科血橙果肉花色苷着色始终无显著差异。因此,可确定塔罗科血橙果肉花色苷合成不受果皮光照调控,也说明种植在重庆不同地区的塔罗科血橙所表现出的果肉着色差异与果实获得的光照条件并无直接关联,而进一步佐证温度(何礼等,2015)、营养元素(刘荣直,2010)等其他因素与血橙果肉着色的联系。李文彬等(2014)认为较高的温度对猕猴桃果肉花青素含量有抑制作用。Martin等(2002)研究认为氮素影响植物体中碳素在次生代谢产物中的分布,即氮缺乏时会导致碳水化合物的积累,从而含碳骨架的次生代谢产物如花青素等黄酮类化合物会大量积累。
血橙果皮与果肉在花色苷种类上存在差异,曹少谦等(2009)在血橙果汁中检测出8种以上花色苷,本研究在塔罗科血橙果皮中仅检测到其中3种花色苷类型。花色苷种类差异和光照影响差异,说明花色苷在血橙果皮和果肉组织中的合成积累可能是两个独立的过程,受外界条件的调控也不完全一致。因此,血橙生产上常出现的皮红肉不红或肉红皮不红的现象可能源于血橙果皮和果肉花色苷合成分属不同外界环境因子的调控,但具体原理有待进一步研究。
4 结论
光照是调控塔罗科血橙果皮着色的重要环境因子,但不参与调控果肉中色素的积累。光照影响血橙外观品质主要是通过调控果皮花色苷和类胡萝卜素的合成积累,而花色苷是最主要因子。血橙提质增效需从建园、技术上着重考虑光照因素,套袋虽对果面洁净有利,但不利于血橙外观色泽品质提升。
参考文献:
曹少谦. 2009. 血橙花色苷结构及其在加工过程中的降解机制研究[D]. 武汉:华中农业大学. [Cao S Q. 2009. Stu-dies on structure of anthocyanins from blood orange and related degradation mechanism during processing[J]. Wuhan:Huazhong Agricultural University.]
曹少谦,潘思轶. 2006. 血橙花色苷研究进展[J]. 食品科学,27(9):278-281. [Cao S Q,Pan S Y. 2006. Review of anthocyanins from blood orange[J]. Food Science,27(9):278-281.]
陈嘉景,彭昭欣,石梅艳,徐娟. 2016. 柑橘中类黄酮的组成与代谢研究进展[J]. 园艺学报,43(2):384-400. [Chen J J,Peng Z X,Shi M Y,Xu J. 2016. Advances in on flavonoid composition and metabolism in citrus[J]. Acta Horticulturae Sinica,43(2):384-400.]
何礼,陈克玲,何建,关斌,李洪雯,王建辉,刘建军. 2015. 低温贮藏下塔罗科血橙抗氧化性能研究[J]. 西南农业学报,28(6):2666-2671. [He L,Chen K L,He J,Guan B,Li H W,Wang J H,Liu J J. 2015. Antioxidant properties of blood orange tarocco during cold temperature storage[J]. Southwest China Journal of Agricultural Sciences,28(6):2666-2671.]
李文彬,刘义飞,彭明. 2014. 温度对猕猴桃花青素含量及其合成基因AdANS的影响[J]. 湖北农业科学,53(9):2070-2074. [Li W B,Liu Y F,Peng M. 2014. Effects of temperature on anthocyanin content and anthocyanin synthase(AdANS) of ‘Hongyang’ kiwifruit[J]. Hubei Agricultu-ral Sciences,53(9):2070-2074.]
刘荣直. 2010. 光信号和GAs在低氮诱导的拟南芥花青素积累中的作用[D]. 兰州:兰州大学. [Liu R Z. 2010. The influence of light signal and GAs on anthocyanins accumulation induced by low nitrogen in Arabidopsis[J]. Lanzhou:Lanzhou University.]
陶俊,張上隆,安新民,赵智中. 2003. 光照对柑橘果皮类胡萝卜素和色泽形成的影响[J]. 应用生态学报,14(11):1833-1836. [Tao J,Zhang S L,An X M,Zhao Z Z. 2003. Effects of light on carotenoid biosynthesis and color formation of citrus fruit peel[J]. Chinese Journal of Applied Ecology,14(11):1833-1836.]
王中华,汤国辉,李志强,汪良驹. 2006. 5-氨基乙酰丙酸和金雀异黄素促进苹果果皮花青素形成的效应[J]. 园艺学报,33(5):1055-1058. [Wang Z H,Tang G H,Li Z Q,Wang L J. 2006. Promotion of 5-aminolevulinic acid and geniste in on anthocyan in accumulation in apples[J]. Acta Horticulturae Sinica,33(5):1055-1058.]
徐娟,邓秀新. 2002. 柑橘类果实汁胞的红色现象及其呈色色素[J]. 果树学报,19(5):307-313. [Xu J,Deng X X. 2002. Red juice sac of citursand its main pigments[J]. Joumal of Fruit Science,19(5):307-313.]
Angela R L P. 2015. The state of the art in biosynthesis of anthocyanins and its regulation in pigmented sweet oranges[(Citrus sinensis) L. Osbeck][J]. Journal of Agricultural and Food Chemistry,63(16):4031-4041.
Azuma A,Yakushiji H,Koshita Y,Kobayashi S. 2012. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta,236(4):1067-1080.
Chang H,Yu B,Yu X P,Yi L,Chen,C Y,Mi M T,Ling W H. 2010. Anticancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J]. Nutrition and Cancer,62(8):1128-1136.
Hanbali J J,Ghadieh R M,Hasan H A,Nakhal Y K,Hanbali L B. 2013. Measurement of antioxidant activity and antioxidant compounds under versatile extraction conditions:The immuno-biochemical antioxidant properties of sweet cherry(Prunus avium) extracts[J]. Anti-inflammatory & Anti-allergy Agents in Medicinal Chemistry,12(3):173-187.
Jeong S T,Goto-Yamamotob N,Kobayashic S,Esaka M. 2004. Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of antho-cyanin biosynthetic genes in grape berry skins[J]. Plant Science,167(2):247-252.
Kang S Y,Seeram N P,Nair M G,Bourquin L D. 2003. Tart cherry anthocyanins inhibit tumor development in Apc(Min) mice and reduce proliferation of human colon cancer cells[J]. Cancer Letters,194(1):13-19.
Martin T,Oswald O,Graham I A. 2002. Arabidopsis seeding growth,storage lipid mobilization,and photosynthetic gene expression are regulated by carbon:Nitrogen availability[J]. Plant Physiology,128(2):472-481.
Rapisarda P,Fanella F,Maccarone E. 2000. Reliability of analytical methods for determining anthocyanins in blood oran-ge juice[J]. Journal of Agricultural and Food Chemistry,48(6):2249-2252.
Takos A M,Jaffé F W,Lacob S R,Bogs J,Robinson S P,Walker A R. 2006. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology,142(3):1216-1232.
Wallace T C. 2011. Anthocyanins in cardiovascular disease prevention[J]. Advances in Nutrition,2(1):1-7.
(責任编辑 邓慧灵)
