茶多酚对脊髓损伤大鼠急性期氧自由基与炎症因子的影响
2019-09-10邓凤君曾娅玲龚勇珍廖端芳
邓凤君 曾娅玲 龚勇珍 廖端芳

〔摘要〕 目的 研究茶多酚(tea polyphenols, TP)对大鼠脊髓损伤(spinal cord injury, SCI)急性期抗氧化与抗炎的作用。方法SD雌性大鼠随机分为6组,每组6只,建立大鼠脊髓半切SCI模型,分为假手术组、模型组、阳性药组(甲基强的松龙100 mg/kg)、TP高剂量组(100 mg/kg)、TP中剂量组(50 mg/kg)、TP低剂量组(25 mg/kg)。术后5 min,假手术组和模型组灌胃生理盐水(10 mL/kg),其他组别灌胃相应药物。24 h后取受损脊髓局部组织,HE染色观察脊髓组织形态学变化,测定脊髓组织中·O2-、NO水平及诱导型-化氮合酶(iNOS)蛋白含量、抗氧化酶系统SOD与MDA活性以及血清中炎症因子IL-1β、IL-6与IL-8的含量。结果 HE染色图像显示,TP各剂量组脊髓形态好于模型组;同时,与模型组比较,TP降低了SCI大鼠脊髓组织中活性氧(ROS)的水平、增加了SOD活性、降低了MDA含量(P<0.05),亦減少了血清炎症因子IL-1β、IL-6、IL-8的含量(P<0.05)。结论 茶多酚能减少SCI大鼠急性期氧自由基与炎症因子的表达。
〔关键词〕 脊髓损伤;茶多酚;活性氧簇;白细胞介素-1β;白细胞介素-6;白细胞介素-8
〔中图分类号〕R285.5;R651.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.09.006
Effects of Tea Polyphenols on Oxygen Free Radicals and Inflammatory Factors in
Acute Phase of Rats with Spinal Cord Injury
DENG Fengjun1,2, ZENG Yaling2, GONG Yongzhen2*, LIAO Duanfang2
(1. Yiyang Medical College, Yiyang, Hunan 413000, China; 2. Hunan University of Chinese Medicine,
Changsha, Hunan 410208, China)
〔Abstract〕 Objective To study the anti-oxidation and anti-inflammatory effect of tea polyphenols (TP) in acute phase of rats with spinal cord injury (SCI). Methods SD female rats were randomly divided into 6 groups, with 6 rats in each group. SCI rat model was established by hemisection at spinal cord. SCI rats were divided into a sham operation group, a model group, a positive drug group (methylprednisolone 100 mg/kg), a TP high dose group (100 mg/kg), a TP middle dose group (50 mg/kg) and a TP low dose group (25 mg/kg). After 5 min of finishing the operation, the sham operation group and the model group were given normal saline (10 mL/kg) by gavage, and the other groups were given corresponding drugs by gavage. After 24 h, local tissue of damaged spinal cord was taken. Morphological changes of spinal cord tissue were observed by HE staining. Contents of O·2-, NO, and iNOS protein in spinal cord tissue, the activity of SOD and MDA in antioxidase system, and contents of inflammatory factors IL-1β, IL-6 and IL-8 in serum were determined. Results HE staining showed that the morphology of spinal cord in the TP groups was better than that in the model group. Compared with the model group, TP decreased the level of reactive oxygen species (ROS) in spinal cord tissue, increased the SOD activity, decreased the MDA content (P<0.05), and also decreased the contents of inflammatory factors IL-1β, IL-6 and IL-8 in serum of SCI rats (P<0.05). Conclusion TP can reduce the expressions of oxygen free radicals and inflammatory factors in acute phase of SCI rats.
〔Keywords〕 spinal cord injury (SCI); tea polyphenols (TP); reactive oxygen species (ROS); interleukin-1β (IL-1β); interleukin-6 (IL-6); interleukin-8 (IL-8)
脊髓损伤(spinal cord injury, SCI)作为目前最严重的灾难性损伤给患者家庭与社会造成了沉重负担。SCI病理病机复杂,迄今为止尚无特别有效的治疗方法。SCI包括不可逆难治疗的原发性损伤和可逆性治疗手段可介入的继发性损伤[1]。药物治疗是预防继发性损伤的有效方式。研究表明,抗氧化剂白藜芦醇等通过抑制氧自由基、激活抗氧化酶系统,在SCI后修复受损脊髓组织,促进脊髓功能恢复[2]。茶多酚(tea polyphenols,TP)亦是高效天然抗氧化剂,源自于绿茶,是绿茶中最主要活性成分,能高效清除自由基,亦能抑制与自由基有关的酶,产生显著的抗炎抗氧化作用[3]。TP能透过血脑屏障,保护神经细胞,减少氧自由基所致神经细胞损伤,具有潜在治疗神经损伤疾病的价值[4]。但是TP对脊髓损伤作用的研究还少见报道。本文拟研究TP对SCI大鼠急性期抗炎与抗氧化作用,期探讨TP对SCI急性期氧自由基与炎症因子的作用。
1 材料
1.1 实验动物
SD大鼠36只,SPF级,健康雌性,二月龄,质量180~220 g,购自湖南斯莱克景达实验动物有限公司,实验动物质量许可证号:SCXK(湘)2011-0003。饲养环境通风、清洁、安静,22~25 ℃,相对湿度40%~70%,饲养一周待动物适应环境后造模给药处理,每日按时供给水和饲料。
1.2 实验试剂
TP:质量分数98%,江西绿康天然产物公司,批号F14079501,生理盐水现用现配。甲基强的松龙(MPSS):比利时,批号141267,生理盐水现用现配。
MDA、SOD、超氧自由基(·O2-)、NO试剂盒(南京建成)。白细胞介素(IL-1β、IL-6、IL-8)ELISA试剂盒(批号依次为301330023113EIA、301330011112EIA、301330101213EIA, ADL公司,USA)。
兔抗iNOS多克隆抗体:ab15323,Abcam,USA,1∶200(V/V)。兔抗GAPDH多克隆抗体:sc137179,Santa Cruz,USA,1∶10 000(V/V)。山羊抗兔 IgG:二抗,sc-2004,Santa Cruz,USA,1∶10 000(V/V)。
1.3 仪器设备
752型紫外分光光度计(上海光学仪器一厂),XDS-1B倒置相差显微镜(Olympus,日本);TGL-16A低温离心机(长沙平凡仪器仪表公司),DY89-II型电动玻璃匀浆机(宁波新芝生物科技股份有限公司),BP121S电子天平(德国Sartorious公司);G42电泳仪、Fastblot B31蛋白质快速半干转移系统均购于德国Biometra公司。
2 方法
2.1 脊髓半切模型建立
选T10节段(T8椎板)作损伤节段,右侧半切脊髓[5]。大鼠以水合氯醛(300 mg/kg,i.p.)麻醉,俯卧四肢伸展固定于自制鼠台。在T10节段右侧横行切断脊髓,切断脊髓后,可见大鼠右后肢抽搐数次后软瘫。明胶海绵填塞断端间隙,逐层缝合肌肉、筋膜、皮肤,皮下注射5 mL生理盐水预防半切术后脱水。
2.2 分组与干预
SD雌性大鼠分为6组,每组6只,第一组为假手术组,采用与模型组一致的手术过程,打开椎管暴露脊髓,但不进行半切;其余各组脊髓进行右侧半切,分为模型组、阳性药组(甲基强的松龙100 mg/kg)、TP高剂量组(100 mg/kg)、TP中剂量组(50 mg/kg)、TP低剂量组(25 mg/kg)。术后5 min,假手术组和模型组灌胃生理盐水(10 mL/kg),其他组别灌胃生理盐水配制的药物。
2.3 取材与检测
2.3.1 心脏灌流 干预24 h后取材。水合氯醛(0.3 g/kg,i.p.)麻醉后心脏灌流,从左心室注入,右心耳流出。37 ℃生理盐水快速推注150 mL,后滴注200 mL(60滴/min),灌注直至右心耳流出的生理盐水变清亮,肺和肝变白。
2.3.2 HE病理组织染色 心脏灌流后,4%多聚甲醛10 min内缓慢推注60 mL后,再滴注200 mL(30滴/min),原切口处剪下4 cm脊柱,以损伤处为中心取下2 cm脊髓,预冷的生理盐水洗净组织,滤纸吸干水分,放入EP管中(内有4%多聚甲醛溶液1 mL)避光保存待做病理切片。
2.3.3 活性氧簇水平測定 心脏灌流后原切口处剪下4 cm脊柱,剥离取下4 cm脊髓,冰冷的生理盐水洗净组织,滤纸吸干水分。精准称重组织,冰上操作加生理盐水制备成10%的组织匀浆,3 000 r/min,离心10 min,取上清加入生理盐水按1∶9稀释成1%的组织匀浆,根据试剂盒测定·O2-、NO水平。
2.3.4 iNOS蛋白含量测定 脊髓组织100 mg加入0.5 mL RIPA裂解液4 ℃裂解1 h。12 000 r/min、 4 ℃离心20 min,取上清。加入上样缓冲液,煮5 min让蛋白变性。每孔上样总蛋白8 μL,15% SDS-聚丙烯凝胶浓缩胶电压80 V,分离胶120 V电泳2 h,80 mA转膜30 min。室温下封闭2 h(用50 g/L牛血清白蛋白的TBST缓冲液),然后分别加入一抗:兔抗iNOS多克隆抗体(1∶200)、兔抗GAPDH多克隆抗体(1∶10 000),4 ℃过夜。再分别加入相应二抗室温孵育1 h[山羊抗兔 IgG (H+L)/HRP,1∶10 000]。ECL发光试剂盒显影,用Image-Pro软件分析条带吸光值。
2.3.5 抗氧化酶系统活性测定 根据试剂盒测定1%的组织匀浆中SOD、MDA水平,方法同“2.3.3”。
2.3.6 血清IL-1β、IL-6与IL-8含量测定 给药24 h后摘右眼球取血5 mL。血液22 ℃静置2 h,4 ℃冰箱放置18~22 h,2 000 r/min 离心20 min,取上清,根据ELISA试剂盒说明书进行血清炎症因子含量测定。
2.4 统计学方法
实验数据以“x±s”表示。SPSS 17.0软件做统计分析,数据分析采用单因素方差分析,各组之间多重比较方差齐性采用LSD法,方差不齐采用Dunnett’s法。P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
3 结果
3.1 TP对脊髓组织病理形态的影响
HE染色后光学显微镜下观察,假手术组大鼠脊髓组织结构完整,细胞膜完整,神经细胞分布均匀、形态正常,神经纤维排列整齐,细胞间基质均匀。模型组脊髓组织在损伤区中央见大片血细胞,出现囊腔样变化,细胞肿胀、空泡变性,并有大量炎性细胞浸润。TP高剂量组组织结构排列较完整,神经纤维排列整齐,细胞间基质较均匀,偶见炎性水肿。TP中、低剂量组脊髓组织空泡减轻,可见炎性细胞浸润,但低于模型组。见图1。
3.2 TP对SCI大鼠脊髓中活性氧簇的影响
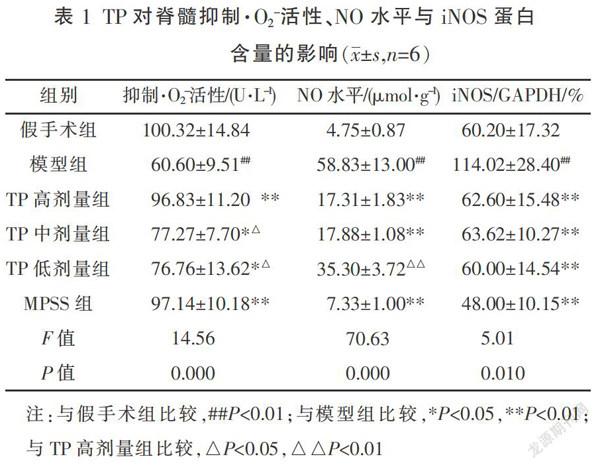
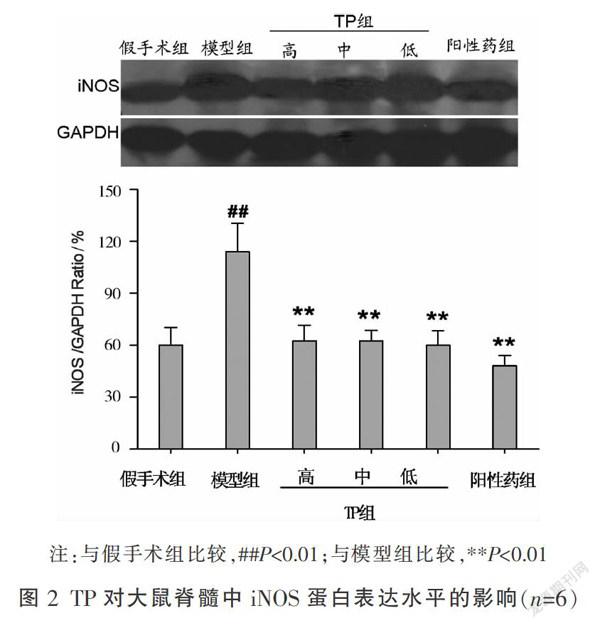
大鼠脊髓右侧半切24 h后,与假手术组相比,脊髓组织对·O2-活性抑制能力下降,NO水平与iNOS蛋白表达上升(P<0.01)。TP高、中、低3个剂量组给药24 h后,与模型组相比,脊髓组织对·O2-活性抑制能力增加,NO水平与iNOS蛋白表达均下降(P<0.05或P<0.01)。与高剂量组相比,TP中、低剂量抑制·O2-活性能力低于高剂量,TP低剂量降低NO水平能力低于高剂量(P<0.05),其余指标3个剂量TP组均无统计学差异,见表1。iNOS蛋白表达条带灰度值越小,说明iNOS蛋白表达量越少,见图2。
3.3 TP对SCI大鼠抗氧化酶系统的影响
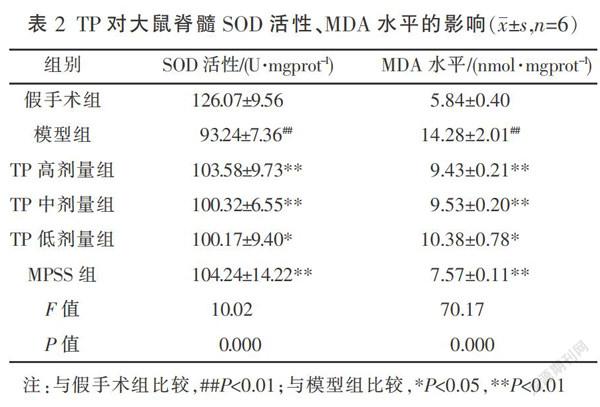
脊髓组织右侧半切24 h后,与假手术组相比,组织中SOD活性下降,MDA水平增加(P<0.01,表2)。TP高、中、低3个剂量给药24 h后,与模型组比较,脊髓组织中SOD活性增加,MDA含量减少(P<0.05或P<0.01,表2)。3个剂量TP组之间差异无统计学意义(P>0.05)。
3.4 TP对血清炎症因子的影响
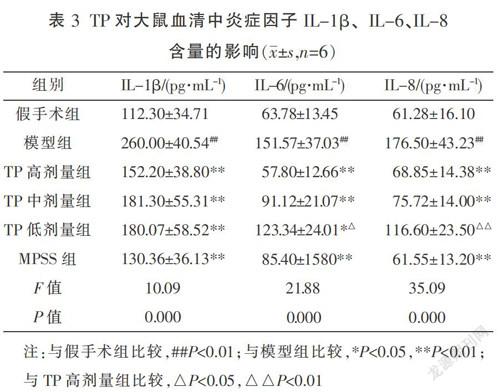
大鼠脊髓半切24 h后,与假手术组相比,血清炎症因子IL-1β、IL-6、IL-8含量均增加(P<0.01,表3)。TP高、中、低3个剂量给药24 h后,与模型组相比,血清IL-1β、 IL-6、IL-8含量均减少(P<0.05或P<0.01,表3)。与高剂量组相比,TP低剂量组对IL-6、IL-8含量的影响低于高剂量(P<0.05或P<0.01,表3);其余指标3个剂量TP组差异无统计学意义(P>0.05)。
4 讨论
SCI是一种后果严重、灾难性的神经损伤,其中具有可逆性并可被调控的继发性损伤急性期主要表现为氧自由基损伤、炎症因子聚集等,因而具有抗氧化抗炎的药物成为治疗SCI的重要手段,如被美国FDA唯一批准治疗SCI的药物MPSS,以及临床常用的神经节苷脂。但是这两种药物或者毒副作用明显,或者疗效不稳定。高效抗氧化剂成为了SCI研究近几年的热门方向。本文探讨了天然高效抗氧化剂TP对SCI的作用。TP源自绿茶,能清除自由基,具有抗炎、抗衰老、提高免疫力、防癌等一系列优异功能,且易通过血脑屏障,清除自由基[6]。因此,我们推测它也许能保护神经细胞,治疗神经细胞损伤性疾病。
继发性脊髓损伤急性期机体产生ROS,主要包括·O2ˉ、NO和H2O2等,损害机体引起多种途径的细胞功能紊乱。·O2ˉ自由基能够间接启动脂质过氧化损伤,破坏生物大分子如DNA、酶等。NO是体内最活跃的自体活性物质,过量的NO参与许多病理损伤过程,而iNOS能诱导产生NO,导致细胞凋亡[7]。机体在氧化代谢过程中会产生少量的自由基,机体本身亦存在抗氧化系统,包括清除ROS的GSH-Px、SOD等,用以维持氧自由基的代谢平衡[8]。SOD活性愈高,机体清除氧自由基能力愈强;与SOD密切相关的另一物质MDA是过氧化反应的最终产物,具有细胞毒性,其水平越高,细胞受自由基攻击的严重程度越明显[9]。本文研究结果显示,SCI大鼠急性期脊髓组织抑制·O2ˉ能力下降,NO水平与iNOS蛋白含量均增加,TP给药后,各浓度组抑制·O2ˉ能力增加,高剂量效果优于中低剂量;NO水平降低,中高剂量优于低剂量;3個剂量TP组均能降低iNOS蛋白含量,且差异无统计学意义。说明TP能有效拮抗SCI急性期的氧自由基的活性。同时TP处理后,受损脊髓组织内SOD活性升高,MDA水平下降,且3个剂量组之间差异无统计学意义,显示TP能提高受损脊髓组织抗氧化酶系统的活性。
中枢神经系统炎症反应会出现小胶质细胞的激活和白细胞的浸润,进而诱导释放IL-1β、IL-6、IL-8、TNF-α等前炎症因子。脊髓损伤后,产生的前炎症因子可加重继发性损伤的程度。研究认为,SCI后急性期产生的IL-lβ具有启动神经细胞凋亡和加剧炎症反应的作用,IL-6是参与全身炎性反应综合症的众多介质中最有影响的促炎因子,IL-8是一种有效的炎性介质,趋化和刺激中性粒细胞和T淋巴细胞,从而介导炎性反应[10-11]。SCI急性期,IL-1β、IL-6与IL-8水平明显增高,是急性时相的一种表现,使脊髓在原发性损伤的基础上进一步导致局部缺血而加重脊髓继发性损伤[12]。本研究发现TP能减少SCI大鼠血清中IL-1β、IL-6与IL-8水平,说明TP通过抑制炎症因子释放,产生显著抗炎作用,从而有效保护受损脊髓。
綜上所述,TP能降低受损脊髓组织活性氧簇水平,提高抗氧化酶系统活性,减少炎症因子的释放,说明TP对继发性SCI急性期可能具有一定的保护作用。本研究为SCI防治提供了一种可能有效的活性成分。尚需进一步研究的是TP对SCI慢性期药效学观察及其抑制SCI的分子作用机制。
参考文献
[1] 黄 胜,袁 莉,陈 安,等.补阳还五汤及其四类有效部位对脊髓损伤大鼠大脑运动皮质的神经保护作用[J].湖南中医药大学学报,2016,36(9): 36-39.
[2] 杨迎暴,朴英杰.白藜芦醇对脊髓损伤后继发性脊髓水肿、乳酸脱氢酶及ATP酶活性的影响[J].中国药理学通报,2002,18(5):539-542.
[3] TAO J, SHEN X, AI Y, et al. Tea polyphenols protect against ischemia/reperfusion-induced liver injury in mice through anti-oxidative and anti-apoptotic properties[J]. Experimental Therapeutic Medicine,2016,12(5): 3433-3439.
[4] KULANDAIVELU K, MANDAL A K. Positive regulation of biochemical parameters by tea polyphenol encapsulated solid lipid nanoparticles at in vitro and in vivo conditions[J]. IET Nanobiotechnol, 2016,10(6):419-424.
[5] 邓凤君,杨迎暴,徐江平,等. EGCG对脊髓损伤大鼠炎性因子释放及神经营养因子表达的影响[J].中国实验方剂学杂志,2010,16(5):195-198.
[6] 夏燕萍,俞茂华,陈 蔚,等.茶多酚改善代谢综合征大鼠糖脂代谢的作用机制研究[J].中国现代医学杂志,2016,26(17):1-6.
[7] JIA M, DI W, LIU Y, et al. ROS-induced oxidative stress in nobile-type dendrobium protocorm-like bodies(PLBS) during vitrification[J]. Cryo Letters,2016,37(4):253-263.
[8] KIM J, MIZOKAMI A, SHIN M, et al. SOD3 acts as a tumor suppressor in PC-3 prostate cancer cells via hydrogen peroxideaccumulation [J]. Anticancer Research,2014,34(6):2821-2831.
[9] YAO N W, LU Y, SHI L Q, et al. Neuroprotective effect of combining tanshinone IIA with low-dose methylprednisolone following acute spinal cord injury in rats[J]. Experimental Therapeutic Medicine,2017,13(5): 2193–2202.
[10] ALIZADEH A, DYCK S M, KATARIA H, et al. Neuregulin-1 positively modulates glial response and improves neurological recovery following traumatic spinal cord injury[J]. Glia, 2017, 65 (7):1152-1175.
[11] KWON B K, STREIJGER F, FALLAH N, et al. Cerebrospinal fluid biomarkers to stratify injury severity and predict outcome in human traumatic spinal cord injury[J]. Journal of Neurotrauma, 2017, 34(3):567-580.
[12] ZHOU Z, LIU C, CHEN S, et al. Activation of the Nrf2/ARE signaling pathway by probucol contributes to inhibiting inflammation and neuronal apoptosis after spinal cord injury[J]. Oncotarget, 2017,8(32):52078-52093.
