非酒精性脂肪肝患者血清HMGB-1、IL-1β、Vaspin水平与HOMA-IR的相关性研究
2019-09-10付淑姣杨志欣
付淑姣,杨志欣
(成都市西区医院消化内科,四川成都 610000)
非酒精性脂肪肝(NAFLD)是非酒精因素引起的以肝脏脂肪过度沉积为特征的临床病例综合征[1]。如果不及时控制病情,可发展至脂肪性肝炎、肝硬化及肝衰竭,甚至还可能出现原发性肝癌。NAFLD患者普遍存在胰岛素抵抗,脂肪细胞除了能储存能量,还可分泌多种影响胰岛素敏感性的细胞因子[2]。高迁移率族蛋白B1(HMGB1)、白细胞介素-1β(IL-1β)均是炎性介质,可能参与NAFLD的慢性炎症[3]。脂肪特异性丝氨酸蛋白酶抑制剂(Vaspin)是一种新发现的脂肪因子,可调节糖脂代谢,改善胰岛素敏感性[4]。为探讨NAFLD患者血清HMGB-1、IL-1β、Vaspin水平与胰岛素抵抗指数(HOMA-IR)的相关性,本文选取本院收治的188例NAFLD患者作为研究对象。现将研究结果报道如下。
1 资料与方法
1.1一般资料 选择2016年7月至2018年10月本院收治的188例NAFLD患者作为研究对象。纳入标准:均符合中华医学会肝脏病学分会脂肪肝和酒精性肝病学组制订的《非酒精性脂肪性肝病诊疗指南(2010年1月修订)》[5];无饮酒史或每周饮酒量低于40 g。排除标准:自身免疫性肝炎、酒精性肝病、病毒性肝病等其他肝脏疾病患者;近期接受过保肝降酶治疗者;恶性肿瘤患者;精神疾病患者;妊娠及哺乳期妇女。NAFLD组中男101例,女87例;年龄27~70岁,平均(48.26±8.25)岁;轻度脂肪肝73例,中度脂肪肝63例,重度脂肪肝52例。选取同期进行体检的健康人100例作为健康对照组,男53例,女47例;年龄28~72岁,平均(48.04±7.24)岁。2组受试者均无高血压、糖尿病、肝肾功能异常、感染性疾病等。
1.2方法 临床基本资料:记录所有研究对象性别、年龄,测量身高、体质量,计算体质量指数(BMI);所有研究对象抽取空腹静脉血4 mL 2份,在3 000 r/min下离心10 min,获得血清。采用瑞士罗氏公司Cobas6000自动生化分析仪检测空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。空腹胰岛素(FINS)采用放射免疫法检测,试剂盒来自万华普曼生物工程有限公司。采用稳态模型评价法(HOMA)计算HOMA-IR,HOMA-IR=(FPG×FINS)/22.5。血清生化指标:HMGB-1、IL-1β、Vaspin采用ELISA法检测,试剂盒来自上海康朗生物科技有限公司。
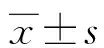
2 结 果
2.12组研究对象基本资料及血清指标的比较 2组间性别、年龄、病程、BMI、HDL-C等比较,差异无统计学意义(P>0.05)。NAFLD组TC、TG、LDL-C、FPG、FINS、HOMA-IR、HMGB-1、IL-1β、Vaspin水平均显著高于健康对照组(P<0.05)。见表1。
2.2不同严重程度NAFLD患者HMGB-1、IL-1β、Vaspin水平及胰岛素抵抗指标的比较 随着患者病情严重程度的加重,HMGB-1、IL-1β、Vaspin、FINS、HOMA-IR不断升高(P<0.05)。见表2。

表1 2组基本资料及血清指标的比较

表2 不同严重程度NAFLD患者HMGB-1、IL-1β、Vaspin水平及胰岛素抵抗指标的比较
注:与轻度组比较,*P<0.05;与中度组比较,△P<0.05
2.3NAFLD患者HMGB-1、IL-1β、Vaspin与胰岛素抵抗指标的相关性分析 Pearson相关性分析结果显示,HMGB-1、IL-1β、Vaspin与NAFLD患者FINS、HOMA-IR均呈正相关(P<0.05)。见表3。
2.4NAFLD患者的多元Logistic回归分析 以HOMA-IR为因变量,以HMGB-1、IL-1β、Vaspin为自变量,多元Logistic回归分析结果显示,HMGB-1、IL-1β、Vaspin是NAFLD患者胰岛素抵抗的独立影响因素。见表4。

表3 NAFLD患者HMGB-1、IL-1β、Vaspin与胰岛素抵抗指标的相关性分析

表4 NAFLD患者的多元Logistic回归分析
3 讨 论
NAFLD的发病机制非常复杂,目前,二次打击学说普遍受到国内学者的认可。初次打击是指胰岛素抵抗引起的肝细胞脂肪堆积和脂肪变性,二次打击则是指氧化应激、脂质过氧化及炎性反应等脂肪性病变的肝细胞出现持续性慢性炎性反应[6]。炎性因子可加剧IR,从而加快NAFLD的发生、发展。
HMGB-1是一种促炎细胞介质,也是一种晚期炎症因子,在一定刺激作用下可有单核细胞、巨噬细胞、内皮细胞、肿瘤细胞等分泌,与脓毒血症、慢性乙型肝炎、动脉粥样硬化等多种急慢性炎性反应有关[7]。帖彦清等[8]研究表明,不同类型脂肪肝患者血清HMGB1水平均有升高,HMGB与外周血炎性因子和氧化应激因子具有相关性,其可能通过调控炎性因子和氧化应激参与脂肪肝的发生、发展。ZENG等[9]研究表明,SIRT1/HMGB1通路是控制NAFLD炎症的关键治疗靶点,丹酚酸B通过SIRT1介导的HMGB1去乙酰化对高脂饮食和棕榈酸诱导的肝脂肪变性和炎症具有保护作用。
白细胞介素-1(IL-1)是一种重要的免疫和炎性调节因子,IL-1β属于IL-1亚型,有研究显示,IL-1β可促进脂质在肝细胞内的沉积,参与调节炎性反应、胰岛素抵抗及肝纤维化[10]。赖敏等[11]研究表明,NAFLD患者血清脂肪因子Chemerin明显升高,IL-1β与其密切相关。
Vaspin是来源内脏脂肪组织的丝氨酸蛋白酶抑制剂,其作用机制还未完全明确,但其可能通过减少炎性反应和改善胰岛素抵抗来延缓NAFLD病情进展[12]。余红艳等[13]研究表明,血浆Vaspin水平与物质及能量代谢密切相关,可能促进2型糖尿病患者脂肪肝的发生。刘师伟等[14]研究表明,Vaspin通过激活IRS/PI3K/Akt/Glut胰岛素信号通路,改善3T3-L1脂肪细胞胰岛素抵抗。
本研究结果表明,NAFLD组TC、TG、LDL-C、FPG、FINS、HOMA-IR、HMGB-1、IL-1β、Vaspin均显著高于健康对照组(P<0.05),提示NAFLD患者存在不同程度的糖脂代谢紊乱、炎性反应及胰岛素抵抗。本研究结果还显示,随着患者病情严重程度的加重,HMGB-1、IL-1β、Vaspin、FINS、HOMA-IR不断升高(P<0.05),说明NAFLD患者病情越严重,胰岛素抵抗现象和炎症程度越明显。另外,Pearson相关性分析结果显示,HMGB-1、IL-1β、Vaspin与NAFLD患者FINS、HOMA-IR均呈正相关(P<0.05)。多元Logistic回归分析结果显示,HMGB-1、IL-1β、Vaspin是NAFLD患者胰岛素抵抗的独立影响因素。分析其可能原因为NAFLD患者早期存在糖、脂代谢紊乱,引起胰岛素抵抗,导致脂质在肝细胞中沉积,形成单纯性肝脂肪变,随着病情进展出现氧化应激及慢性炎性反应,大量的活性氧可导致脂质过氧化、细胞因子和脂肪因子的产生,HMGB-1和IL-1β的大量释放,会加剧肝细胞的炎性病变、坏死和凋亡,逐渐加剧NAFLD的进程;而高水平Vaspin可能是一种与IR相关的代偿机制,当NAFLD患者的IR持续加重后,会使得肝脏的氧化应激、脂质过氧化、炎性反应不断加重,破坏肝细胞功能的完整性,最终导致Vaspin代偿性升高能力下降。所以,HMGB-1、IL-1β、Vaspin可能互相作用,共同影响NAFLD患者的胰岛素抵抗。
4 结 论
HMGB-1、IL-1β、Vaspin可能参与NAFLD患者胰岛素抵抗现象的发生、发展。
