基因编辑与遗传病治疗
2019-09-10席海瑞卢大儒
席海瑞 卢大儒

各种遗传病给人类社会带来巨大困扰。基因治疗从概念提出到临床应用,遗传病的基因冶疗一直是研究重点。慢病毒和腺相关病毒在遗传病的基因治疗上获得一定效果,但对更多遗传病无可奈何,基因编辑工具的出现给遗传病冶疗带来了新曙光,但在实际应用中需要制定规范、达成国际共识,科学家必须受生物医学伦理道德的约束。
遗传病是由于遗传物质的改变,包括染色体畸变、染色体上基因突变,所导致的疾病,它完全或部分由遗传因素决定,通常表现为先天性,也可由后天因素影响导致发生。遗传病主要分为因染色体数目或结构改变而引起的染色体病或染色体综合征,如21三体综合征(又称唐氏综合征)、猫叫综合征等;单基因突变引起的单基因病,如β-地中海贫血症、血友病等;多个基因突变引起的多基因病,如脊柱裂、无脑儿等遗传病被发现之前,就已长期困扰着人类,特别是单基因遗传病,已发现的单基因病有6500多种。虽然婚前检查及孕后筛查可防止一部分遗传病患儿出生,但是每年还是有相当数量的患有遗传疾病的婴儿诞生,包括之前因无筛查条件而出生的人群,遗传病给家庭及社会带来了巨大的负担。治疗遗传病成为生物医学科研人员的头号难题。
基因治疗的曙光与局限
从1950年代沃森和克里克证明遗传物质是DNA开始,科学家就发现人类的很多疾病归因于DNA层面出了问题,特别是各种各样的遺传病。1960年代,莱德伯格(J.Lederberg)提出基因治疗的最初概念:利用正常的外源基因取代患者的变异基因。1970年代,科学家认为遗传病治疗未来面对的主要问题是临床基因治疗,其主要难点是如何精确控制外源DNA进入细胞,并正确进入染色体上的确切位置而行使其功能。之后,科学家便投人大量精力研究遗传病的基因治疗,最初的研究策略是利用腺病毒、慢病毒及腺相关病毒,将正常外源基因导人患者体内。
1990年首例基因疗法的临床试验开始实施,四岁女孩德席尔瓦(A.DeSilva)患有重度联合免疫缺陷病(severe combined immunodeficiency disease,SCID),由于患者体内不能合成腺苷脱氨酶(A DA)导致缺乏正常的免疫力,科研人员从女孩体内获得自体白细胞,在体外利用逆转录病毒载体,将正确编码腺苷脱氨酶的ADA基因插入女孩的白细胞基因组内,再将感染慢病毒的白细胞重新回输到女孩体内,之后女孩体内的白细胞可以正常合成腺苷脱氨酶且免疫力显著提高。此后,基因治疗迎来爆发性的发展。但在1999年,18岁的美国男孩格尔辛格(J.Gelsinger)接受腺病毒载体注射进行基因治疗,导致多器官衰竭死亡,基因治疗进入了漫长的严冬期。直到2010年,基因治疗才慢慢苏醒:2012年欧盟审批通过了荷兰UniQure公司生产的阿利泼金(glybera),该药用于治疗一种极其罕见的遗传病——脂蛋白脂肪酶缺乏症,使用一次就可显著降低急性胰腺炎发病率,该药是利用腺相关病毒作为载体,治疗脂蛋白脂肪酶缺乏引起的严重肌肉疾病。2014年美国食品药品监督管理局(FDA)授予美国Celladon医药公司治疗心衰的基因疗法MYDICAR为“突破性疗法”,这是FDA首次批准的基因疗法。该疗法可重新激活人体内的肌浆网钙离子ATP酶2a(SERCA2a),改善心脏的泵血能力。
虽然基因治疗获得很多有前景的临床结果,但仍存在一系列难题:一是将外源基因整合到目的细胞的基因组后,如何维持其稳定表达,以及其对邻近基因正常表达所产生的不可预测的影响;二是由于有些外源治疗基因太大,不能通过现有载体进入目的细胞内;三是外源基因的导人并不能直接解决显性突变或去除突变,或插入遗传物质,如病毒基因组或细胞本身的受体。
基因编辑崭露头角
在科学家进行传统基因治疗研究的同时,一种称为“基因编辑”的技术开始崭露头角,并有了突飞猛进的发展。由于基因编辑可对基因组序列进行精确的有针对性的编辑,同时又具易用性、特异性和高效传递的优点,从而为遗传病的基因治疗带来了新思路和新希望。
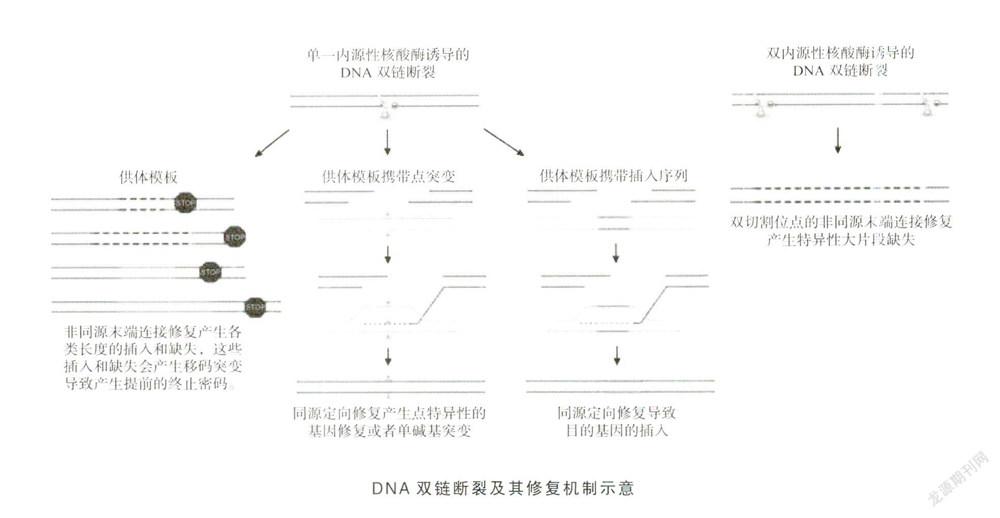
基因编辑的原理是编辑工具制造靶向DNA双链断裂(double strand breaks,DSB),利用细胞内源性的修复机制制造目的DNA的突变缺失,或者将目的基因片段插入靶向DNA的位置。DNA断裂后通常有两种主要修复途径:同源定向修复(homology directedrepair,HDR)和非同源末端连接修复(non-homologousend joining,NHEJ)。
HDR依赖于断裂末端与外源基因的同源序列,以模板依赖方式修复断裂。研究表明,通过在靶位点引入DNA双链断裂,可以刺激哺乳动物细胞中通过同源重组进行基因打靶的效率上升几个数量级。而NHEJ通过直接重新切割末端来修复DNA双链断裂,其中并无同源模板的参与,修复途径容易出错,且经常导致在断裂位点插入缺失。因此利用细胞内源性DNA修复机制,可以在特定的基因位点处设计各种基因改变。但是基因编辑的关键是在基因的精确位置引入正确的DNA双链断裂。目前主流的诱导位点特异性DNA双链断裂的工具有4种:锌指核酸酶(zinc finger nuclease,ZFN)、转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs),大范围核酸酶、CRISPR/Cas系统。其中由CRISPR/Cas系统发展来的单碱基编辑系统为基因编辑带来了新曙光。
锌指核酸酶率先实现基因编辑
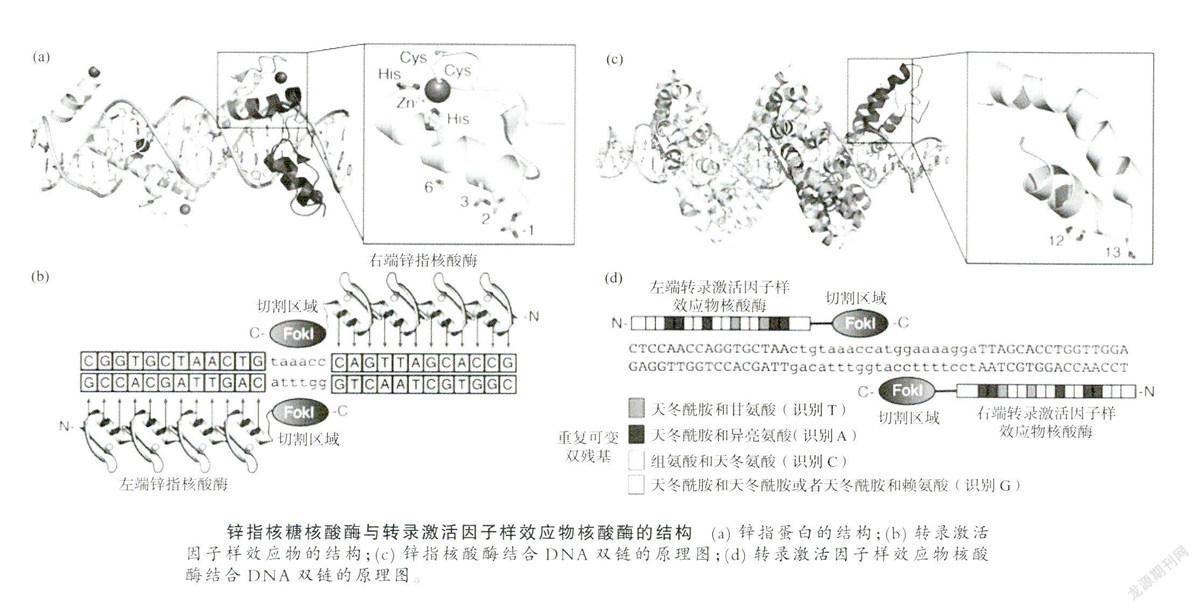
第一个用于基因编辑的酶是锌指核酸酶,它由一个DNA识别域和一个非特异性核酸内切酶构成,DNA识别域是真核生物中最丰富的转录因子Cys2-His2(半胱氨酸、组氨酸)锌指蛋白串联组成,DNA剪切域是由海床黄杆M1 Fok I(细菌Flavobacteriumokeanokoites的type IIS限制酶)非特异性核酸内切酶C端96个氨基酸残基组成。
锌指核酸酶只有在二聚体状态时才有酶切活性,每个Fok I单体与一个锌指蛋白相连构成一个ZFN,识别DNA的特定位点,当两个识别位点相距6-8碱基对时,两个单体ZFN相互作用产生酶切功能,诱导DNA双链断裂[1]。初步的实验表明,ZFN诱导的DNA双链断裂可通过NHEJ或HDR的修复达到编辑基因组的目的,这已在非洲爪蟾、线虫、果蝇及斑马鱼等进行过实验,在外源同源基因存在的情况下,可对目的基因进行10%~20%的正确修复,之后被用于成功修饰人体和多能干细胞的基因。
高效的转录激活因子样效应物核酸酶编辑
2009年,首次应用的TALENs为基因编辑开辟了新途径。植物病原体黄单胞菌分泌转录激活因子样效应物(transcription activator-like effectors,TALES),该蛋白具有识别特异性DNA碱基对的功能,科学家结合其特异性提出了新型DNA结合蛋白模块化设计可能性。TALENs的DNA结合性是由其高度保守的第3335位氨基酸以及高度可变的第12位和第13位氨基酸介导的。经设计组成的模块化的TALE单元重复连接起来,再与非特异性核酸内切酶组合,从而建立具有定制DNA结合特异性的长阵列,该阵列结合到特定DNA位点,并由非特异性核酸内切酶切断DNA双链,这就是TALENs。基于ZFN诱导基因组编辑10年来奠定的基础,作为可编程DNA结合结构域,TALE很快就被TALENs工程化。与ZFN的工作原理一样,TALE与Fok Ⅰ内切核酸酶催化结构域融合形成二聚体,切割预定的DNA靶位点[2]。TALENs的特异性切割活性已在酵母、拟南芥、水稻、果蝇及斑马鱼等多个动植物体系和体外培养细胞中得到验证,也被证明可有效诱导人源细胞及多能干细胞的NHEJ和HDR修复途径。
除了ZFN和TALENs,还有大范围核酸酶,大范围核酸酶是内切性脱氧核糖核酸酶,其最大特点是它在DNA中的工作识别位点较大——12~40个碱基对,因此被认为是最特异的天然限制酶。在大范围核酸酶中,最著名的是LAGLIDADG家族的归巢核酸内切酶,它是研究基因组最常用的工具之一,归巢核酸内切酶中最常用的是Ⅰ-CreI和Ⅰ-SceI酶[3]。许多研究表明,大范围核酸酶在基因组编辑领域有巨大的应用前景,但是归巢核酸内切酶的DNA结合域和切割结构域难以分离,对于新的蛋白质的特异性设计相对困难的缺点限制了它的进一步使用,主要应用于科研中细胞和动物水平的基因编辑,但在基因编辑临床治疗中贡献甚微。
更神奇的CRISPR/Cas编辑系统
在研究以上基因编辑工具的同时,科学家还在积极探索新的基因编辑工具。2002年荷兰科学家扬森(R.Jansen)通过对细菌和古细菌的研究,首次将细菌中已进化为以抵御入侵质粒和病毒基因组为目的的重复序列,命名为规律成簇间隔短回文重复序列(clusteredregularly interspaced short palindromic repeats,CRISPR),并提出CRISPR-associated(Cas)的概念[4]。因为CRⅠSPR具有切割外源基因的特性,所以科学家探索它是否可以作为应用于生物医学研究中的基因编辑工具。
2012年美国科学家杜德纳(J.Doudna)和卡彭蒂耶(E.Charpentier)首次发表CRⅠSPR/Cas系统的基因组编辑功能[5]。紧接着,2013年华人科学家张锋首次证实CRISPR/Cas系统能编辑人细胞基因组[6]。由于其简单便捷的操作性,CRISPR/Cas系统迅速席卷全球生物界。CRISPR系统的工作机制是:通过将入侵核酸的短序列整合到CRISPR基因座中,然后将它们转录并加工成CRISPR RNA(crRNA),并将其与反式激活的crRNAs(tracrRNAs)一起,与CRISPR相关Cas蛋白复合,通过核酸之间的碱基配对,执行Cas核酸酶对DNA的特异性切割,通过NHEJ和HDR两条修复途径,完成基因编辑。
研究发现,Ⅱ型CRISPR核酸酶最主要的三种成分是Cas9蛋白、成熟crRNA和tracrRNA。2012年杜德纳、卡彭蒂耶及其同事通过将crRNA和tracrRNA融合成单一向导RNA(single guide RNA,sgRNA),而将该系统简化为两个组分,大大提高了CRISPR/Cas的使用便捷性[5]。这样,只要根据目的序列合成特定的sgRNA,使其与Cas9在目的细胞内共同表达,即可进行特异性基因编辑。与之前三种核酸酶系统不同,CRISPR/Cas9核酸酶不需要为每个DNA靶位点设计新蛋白质,它通过改变决定特异性的gRNA短区域,可相对容易地靶向目的位点,从而使该系统成为引入位点特异性DSB的极具吸引力的方法此后CRISPR/Cas9系统被迅速广泛应用于生物学和医学等领域,成为基因组编辑领域的最大热点。
单碱基编辑:从基因手术刀到基因笔
单碱基编辑器是2016年华人科学家刘戴维(D.R.Liu)首先发明的一种新兴的基因组DNA点突变特定修复体系,它依赖于招募胞苷脱氨酶引入单碱基变化(不是双链断裂和供体模板),提高了潜在的效率,同时降低了DNA双链断裂引起的不必要的DNA损伤,简化了基因编辑的过程[7]。
刘戴维的开创性工作——碱基编辑器(baseeditor,BE)系统一经发表,就在不断升级版本。现在最常用的有两套系统:CBE系统,能特异性地将C突变为T;ABE系统,能特異性地将A突变为G} CBE系统包括sgRNA和融合蛋白,融合蛋自由改造的nCas9蛋自(Cas9蛋白的第10位天冬氨酸突变为丙氨酸)、大鼠来源的胞嘧啶脱氨酶(apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like protein,APOBECI)和尿嘧啶DNA糖基化酶抑制剂(uracilDNA glycosylase inhibitor,UGI)三部分组成。当sgRNA与融合蛋白结合并引导至目的的DNA序列互补配对、nCas9对目的DNA序列进行单链切割,APOBECI将非互补链中相应的C经脱氨基作用转变为U,UGI维持U的状态,DNA复制进一步使得U被T代替,从而完成C到T的突变[7]。
ABE系统也包括sgRNA与融合蛋白,融合蛋白由nCas9蛋白、野生型tRNA腺嘌呤脱氨酶(TadA)和突变型tRNA腺嘌呤脱氨酶(TadA*)组成。当sgRNA与融合蛋白结合并引導至目的的DNA序列互补配对,nCas9对目的DNA序列进行单链切割,TadA与TadA*将非互补链中相应的腺嘌呤A经脱氨基作用转变为次黄嘌呤(I),DNA复制进一步使得I被G代替,从而完成A到G的突变[8]。
单碱基编辑系统一经出现就广受好评,又经过对脱氨酶和Cas9类型的改造,目前已制造出各种类型的单碱基编辑系统,大大提高了其应用性。该系统已被应用于小麦、人类胚胎干细胞、造血干细胞及小鼠活体水平。相比普通CRISPR/Cas系统,它具有较低的脱靶率,虽然还有相应的效率稳定性问题和未知的安全性,但科学家还是将其视为适用于治疗遗传病的更好的基因编辑工具。2017年美国科学家利用单碱基编辑系统成功地将小鼠PSCK9基因引入位点特异性无义突变,导致成年小鼠血浆中PCSK9蛋白降低50%同时及血浆胆固醇水平降低约30%。[9]2017年我国科学家黄行许和刘见桥利用该系统在人胚胎细胞中进行了首次实验,获得目的单碱基突变的同时,也检测了单碱基编辑可能带来的脱靶效率[10]。
基因编辑大显身手
在五种基因编辑平台出现之后,CRISPR/Cas系统的操作简易性和应用广泛性,被大多数科学家认为是最有前途和可能最快投入实际应用的方法。但现实情况却不是这样,虽然锌指核酸酶的操作复杂,但它可定位的序列更长,进行基因编辑的精准度也更高,从而成为美国FDA首个批准用于人体临床试验的基因编辑平台。2017年美国圣加蒙公司(Sangamo Therapeutics)对患有亨特综合征的44岁男子B.Madeux进行了代号为“SB-913”的首例人体基因编辑治疗。
亨特综合征是一种罕见遗传病,患者主要是男性,每10万个至17万个新生男婴中会有一位不幸罹患此病。亨特综合征患者体内缺少IDS基因,该基因的功能是生成一种可分解有毒碳水化合物的酶,IDS基因缺失会导致扮演“清洁I="角色的酶缺位,从而造成细胞内累积有毒代谢物,给患者的器官带来毁灭性打击。由腺相关病毒、锌指核酸酶和IDS基因三部分组成的SB-913治疗药物进入人体后,腺相关病毒作为载体,携带锌指核酸酶和正常IDS基因直达人体肝细胞,肝细胞通过天生的DNA修复机制,可以把正常IDS基因插入染色体上的相应位点.完成目的细胞的基因编辑治疗。
2016年,美国宾夕法尼亚大学计划在人体上开始CRISPR研究,计划得到美国国立卫生研究院和FDA的许可——用CRISPR技术治疗黑色素瘤、肉瘤和多发性骨髓瘤。试验包括移除患者的T细胞,在实验室中将其编辑后,再注人患者体内。2018年,瑞士基因编译公司(CRISPR Therapeutics)成为首家获得欧洲监管机构许可开展临床基因治疗的公司.他们利用基因编辑技术来修复地中海贫血症患者的基因缺陷,先从患者骨髓中提取干细胞,然后用CRISPR进行基因编辑,同时重组进正常血红蛋白的基因,治愈地中海贫血症。斯坦福大学的研究人员计划通过直接纠正患者十几细胞中血红蛋白基因的突变,将有缺陷的细胞转化为正常细胞二但是.有科学家发现,人与人之间的基因差异可能会削弱CRISPR/Cas基因编辑的有效性,也可能会导致十分危险的脱靶效应,这使得CRISPR/Cas的临床之路蒙上了新阴影。
2018年11月26日中国贺建奎宣布了一对首例免疫艾滋病的基因编辑婴儿诞生,消息震惊了国际科学界和医学界人自细胞表面有一种CCR5基因是表达的蛋白质,RS型艾滋病病毒(HIV)借助CCR5蛋白进人并感染宿主细胞,致人患病。然而,自然人群中有一定比例的人,其CCR5基因因有32对碱基的缺失,导致表达的CCR5-Δ32蛋白无法被R5型HIV病毒识别和结合,从而使这些人不会得艾滋病。
贺建奎招募了8对男方HIV阳性、女方HIV阴性的志愿者夫妇,在体外受精的受精卵中注射了Cas9蛋自和针对CCR5基因的sgRNA,体外培养至囊胚进行基因诊断,之后将两个胚胎移植进母亲子宫中,最终诞生从出生其CCR5基因就被敲除的双胞胎婴儿,宣称该对婴儿对R5HIV免疫但是,实验室CRISPR/Cas9技术编辑敲除的CCR5基因的功能与人群中自然产生的CCR5基因突变缺陷的功能是否一致,尚未可知;且人群中的CCR5基因突变缺陷,会导致携带者在感染西尼罗河病毒后,出现更严重的神经系统疾病;同时,贺建奎只是从测序角度回应CRISPR/Cas9对于CCR5基因编辑在婴儿体内没有出现脱靶效应、并声称婴儿的CCR5基因并没有编辑为CCR5-032,所以婴儿中CCR5的突变表型未知,孩子们未来的风险也是未知的。
该事件报道后,100多名中国科学工作者迅速发表联合签署的声明进行强烈谴责:该实验技术[_毫无创新,严重违背国家的相关生命伦理规范准则,突破了科学家的伦理道德底线国家相关监管部门和国际医学专家们亦对此表示愤怒和谴责基因编辑婴儿事件对于基因编辑的疾病治疗带来了巨大的负面影响,同时也重创了从事基因编辑研究的中国科学家的声誉。
随着科学家的不断努力,已有基因编辑系统的持续开发和优化不仅在细胞和动物水平,也会在人类遗传疾病治疗中获得新成果但无论TALENs还是CRISPR/Cas系统,在正式商业化地应用于人类遗传病治疗之前,还有很长远的路要走.已有的技术和未来发明的基因编辑工具将为遗传病治疗提供新的可能与思路。但是基因编辑婴儿事件也给我们一个警示,基因编辑应用于疾病治疗的过程中生物医学伦理底线绝对不容被践踏。
[1]Gaj T,Gersbach C A,Barbas,C F.ZFN,TALEN,and CRISPR/Cas-based methods for genome engineering.Trends Biotechnol,2013,31(7):397-405.
[2]Joung J K,Sander J D.Innovation TALENs:a widely applicabletechnology for targeted genome editing.Nat Rev Mol Cell Bio,2013,14(1):49-55.
[3]Chevalier B S,Stoddard B L.Homing endonucleases:structural andfunctional insight into the catalysts of intron/intein mobility.NucleicAcids Res,2001,29(18):3757-3774.
[4]Jansen R,van Embden J D A,Gaastra W,et al.Identification of genesthat are associated with DNA repeats in prokaryotes.Mol Microbiol,2002,43(6)门565-1575.
[5]Jinck M,Chylinski K,Fonfara I,et al.A programmable dual-ma-guidedDNA endonuclease in adaptive bacterial immunity.Science,2012,337(6096):816-821.
[6]Engkakul P,Mahachoklertwattana P,Jaovisidha,et al.Unrecognizedvertebral fractures in adolescents and young adults with thalassemiasyndromes.J Pediatr Hematol Oncol,2013,35(3):212-7.
[7]Komor A C,Kim Y B,Packer M S,et al.Programmable editing of atarget base in genomic DNA without double-stranded DNA cleavage.Nature,2016,533(7603):420-424.
[8]Gaudelli N M,Komor A C,Rees H A,et al.Programmable base editingof A.T to G.C in genomic DNA without DNA cleavage.Nature 2017,55,(7681):464-471.
[9]Chadwick A C,Wang X,Musunuru K.In vivo base editing of PCSK9(Proprotein Convertase Subtilisin/Kexin Type 9)as a therapeuticalternative to genome editing.Arterioscl Throm Vas,2017,37(9):1741-1747.
[10]Li G L,Liu Y J,Zeng Y T,et al.Highly efficient and precise baseediting in discarded human tripronuclear embryos.Protein&Cell,2017,8(10):776-779.
關键词:遗传病 基因编辑 基因治疗 基因伦理
