加味丹参饮作用内源性H2S合成途径保护心肌缺血/再灌注损伤的实验研究
2019-09-10陈聪成细华任婷吴若霞周畅袁梦廖菁蔡雄
陈聪 成细华 任婷 吴若霞 周畅 袁梦 廖菁 蔡雄

〔摘要〕 目的 通過观察益气活血中药组方加味丹参饮(JWDS)对心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury, MIRI)模型大鼠血清硫化氢(H2S)合成酶/胱硫醚-γ-裂解酶(cystathionine-γ-lyse, CSE)、肌酸激酶同工酶(creatine kinase isoenzymes, CK)、乳酸脱氢酶(lactate dehydrogenase, DH)含量、心肌组织超微结构、心肌组织CSE mRNA表达的影响,从内源性H2S合成途径探讨JWDS治疗MIRI的作用机制。方法 给药组大鼠按剂量6.19 g/(kg·d)要求给药14 d,末次给药2 h后采用结扎冠脉左前降支/再灌流方法复制MIRI模型。HE染色观察心肌组织机构改变情况;ELISA法检测血清CK、LDH、CSE含量;Western-blot检测心肌组织CSE蛋白表达;Real-time PCR检测心肌组织CSE mRNA表达。结果 JWDS可明显改善MIRI模型大鼠心肌组织病理改变,降低血清LDH、CK含量(P<0.01),升高CSE含量(P<0.01),上调心肌组织CSE及mRNA表达(P<0.05,P<0.01)。PPG可明显降低JWDS组大鼠血清CSE含量(P<0.01),下调心肌CSE mRNA表达(P<0.01)。结论 JWDS对实验性心肌缺血/再灌注(MIR)大鼠心肌损伤具有明显保护作用,其机制与促进内源性H2S生成从而保护心肌细胞结构,抑制CK、LDH漏出,上调心肌组织CSE蛋白及mRNA表达有关。
〔关键词〕 心肌缺血再灌注;加味丹参饮;益气活血; H2S;CSE
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.10.003
Experimental Study on Effects of Jiawei Danshen Decoction on Endogenous H2S Synthesis
Pathway to Protect Myocardial Ischemia/Reperfusion Injury
CHEN Cong1,2, CHENG Xihua1, REN Ting1, WU Ruoxia1, ZHOU Chang1, YUAN Meng1, LIAO Jing1*, CAI Xiong2*
(1. School of Chinese Medicine, Hunan University of Chinese medicine, Changsha, Hunan 410208, China; 2. State Key Laboratory Breeding Base of Chinese Materia Medica Powder and Innovative Medicine Co-founded by Hunan Province
and Ministry of Science and Technology, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe effects of a prescription for strengthening Qi and promoting blood-Jiawei Danshen Decoction (JWDS) on serum contents of H2S synthetase/cystathionine-γ-lyase (CSE), creatine kinase isoenzyme (CK) and lactate dehydrogenase (LDH), myocardial tissue ultrastructure, and CSE mRNA expression in myocardial tissue of model rats with myocardial ischemia reperfusion injury (MIRI), so as to explore the mechanism of JWDS in treating MIRI through synthesis pathway of endogenous H2S. Methods Rats in medication group were given medicine 6.19 g/(kg·d) for 14 d, and 2 h after the last medication, the MIRI model was replicated by ligation of left anterior descending coronary artery/reperfusion method. Ultrastructural changes of myocardial tissue were observed by HE staining. The contents of serum CK, LDH and CSE were detected by ELISA method. The expression of CSE protein in myocardial tissue was detected by Western-blot. The expression of CSE mRNA in myocardial tissue was detected by Real-time PCR. Results JWDS significantly improved pathological changes of myocardial tissue in model rats with MIRI, decreased serum LDH and CK contents (P<0.01), increased CSE content (P<0.01), and up-regulated CSE and mRNA expression in myocardial tissue (P<0.05, P<0.01). PPG significantly decreased serum CSE content in rats of the JWDS group (P<0.01), and down-regulated CSE mRNA expression in myocardial tissue (P<0.01). Conclusion JWDS demonstrates significant protective effect on myocardial injury in experimental MIRI model rats, which is associated with promoting endogenous H2S generation to protect myocardial cell structure, inhibit CK and LDH leakage, and up-regulate CSE protein and mRNA expression in myocardial tissue.
〔Keywords〕 myocardial ischemia reperfusion; Jiawei Danshen Decoction; strengthening Qi and promoting blood; H2S; CSE
心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury, MIRI)是指心肌缺血后冠状动脉再通,恢复供血后导致的复杂心肌损伤反应,是导致溶栓治疗、心脏移植及冠脉搭桥等治疗手段失败的主要原因[1-4]。MIRI可导致包括再灌注性心律失常、心肌顿抑、血液无复流、微血管内皮细胞损伤以及微循环障碍等在内的一系列功能、结构、代谢方面的损伤,临床治疗心血管疾病应尽量避免MIRI带来的负面作用,對MIRI的临床表现、发病机制以及防治途径的研究具有重要意义[5-6]。硫化氢(H2S)是一种类似于一氧化氮(NO)、一氧化碳(CO)的内源性气体信号分子,主要由胱硫醚-γ-裂解酶(cystathionine-γ-lyse, CSE)催化底物L-半胱氨酸生成[7]。研究发现H2S可自由穿过细胞膜,是细胞防御的内源性机制,外源性H2S干预对离体心脏缺血预处理具有明显的保护作用[8]。
加味丹参饮(JWDS)是跟据大量临床经验,从《时方歌括》丹参饮化裁而来,由黄芪、丹参、檀香、川芎、赤芍等组成,全方共奏益气活血之功,在临床上对防治冠心病心绞痛有很好的疗效。部分研究证实该方可通过调控细胞凋亡、抗炎等有效途径的减轻心肌缺血再灌注损伤。但其多环节、多靶点作用的确切机制还未完全阐明。为探究是否通过内源性H2S调节通路对MIRI发挥治疗作用,本实验通过观察加味丹参饮JWDS对MIRI模型大鼠心肌组织细胞形态、血清合成酶/胱硫醚-γ-裂解酶(cystathionine-γ-lyse, CSE)、肌酸激酶同工酶(creatine kinase isoenzymes, CK)、乳酸脱氢酶(lactate dehydrogenase, DH)含量、心肌组织CSE及mRNA表达的影响,以及H2S合成酶抑制剂PPG对JWDS治疗效果的影响,进一步阐释JWDS保护MIRI的作用机制。
1 材料
1.1 动物
SPF级SD大鼠,雌雄各半,体质量(200±20)g,湖南斯莱克景达实验动物有限公司提供,动物许可证编号:SCXK(湘)2014-0008。
1.2 主要药物与试剂
加味丹参饮(由丹参、檀香、赤芍、川芎、当归、红花、生地黄、黄芪等组成),湖南中医药大学第一附属医院药剂科提供;LDH、CK、CSE ELISA试剂盒均购于武汉基因美生物,批号201804;硫氢化钠(NaHS),美国Sigma公司;RIPA(强)组织细胞快速裂解液(批号PAB180006)、Goat-anti-rabbit IgG二抗(批号PAB150011)、BCA蛋白浓度测定试剂盒(批号PAB180007)均购于BIOSWAMP公司;Anti-rabbit CSE抗体(批号Ab80643)、Anti-rabbit抗β-Actin抗体(批号Ab8227)均购于美国Abcam公司;Trizol试剂(批号15596026),ambion公司;YBR Green PCR试剂盒(批号KM4101),KAPA Biosystems公司;逆转录试剂盒(批号639505),TAKARA公司。
1.3 仪器
小动物呼吸机(DW-3000,淮北正华生物仪器设备有限公司);FX-211小动物心电图机(北京福田电子医疗仪器有限公司);MK3型酶标仪(芬兰雷勃);AC8型自动洗板机(Thermo公司);TG16W型微量高速离心机(湖南湘仪);GNP-9080型隔水式恒温培养箱(上海精宏);mini protean 3 cell型电泳仪、Real-time PCR、Universal Hood Ⅱ型凝胶成像系统(美国BIO-RAD);K30型干式恒温器(杭州爽盛仪器);Centriguge 5424 R型离心机(德国Eppendorf);Tanon-5200型ECL分析仪(上海天能)。
2 实验方法
2.1 分组与给药
取SD大鼠70只,按体质量随机分为空白组、假手术组、MIRI模型组(MIRI组)、缺血预适应组(IP组)、NaHS+MIRI组(NaHS组)、加味丹参饮+MIRI组(JWDS组)、加味丹参饮+PPG+MIRI组(JWDS+PPG组),每组10只。JWDS组与JWDS+PPG组每日以加味丹参饮(6.19 g/kg)灌胃,JWDS+PPG组于再灌注前30 min以CSE合成酶抑制剂PPG(33.9 mg/kg)腹腔注射干预,NaHS组以28 μmol/kg NaHS腹腔注射,空白组、假手术组、MIRI、IP组以等量生理盐水灌胃,给药体积均为10 mL/kg。每日给药1次,连续14 d。
2.2 缺血再灌注模型建立
末次给药2 h后建立MIRI模型。除空白组外,各组大鼠以10%水合氯醛腹腔注射麻醉,固定于解剖台上,颈部备皮消毒。切开气管,以8号灌胃针进行气管插管,动物呼吸机(呼吸频率60~80次/min,潮气量5~7 mL)辅助呼吸。沿第3/4肋骨上缘打开胸腔暴露心脏,剪开心包,沿冠状动脉于左前降支下方约2 mm处用无创缝合线结扎冠状动脉,连续监视心电图的变化,出现ST段弓背抬高,T波高耸/倒置或左心室变为苍白色即确认阻断成功。30 min后放松结扎线,再灌注90 min以ST 段回落1/2以上,T波下降或左心室由苍白变为暗红色表示再灌注成功。假手术组仅做开胸处理,不结扎。
2.3 HE染色观察心肌组织病理变化
取大鼠心肌组织,10%多聚甲醛浸泡固定,石蜡包埋,间断连续切片,HE染色,正置显微镜下观察心肌组织病理变化并拍照。
2.4 ELISA检测大鼠血清CSE、CK、LDH含量
大鼠心肌缺血/再灌注24 h后,脱颈处死大鼠,腹主动脉取血,室温静置30 min,3 000 r/min离心10 min,取上清,分装后置于-20 ℃冰箱冻存备用。参照ELISA试剂盒说明,检测血清CSE、CK、LDH含量。
2.5 Western blot检测心肌组织CSE表达
取大鼠左心室心肌组织,加入预冷RIPA裂解液研磨,提取总蛋白,测定蛋白含量。制备好的蛋白样品,经12%SDS-PAGE凝胶电泳后,电转至PVDF膜,转膜后置于含5%脱脂奶粉封闭液中封闭2 h,Anti-rabbit CSE/β-actin一抗(CSE 1∶1 000稀釋;β-Actin1∶10 000稀释)4 ℃下孵育过夜。加HRP标记的Goat-anti-rabbit IgG二抗(1∶10 000稀释)室温孵育1 h后,加入ECL发光液显影,ECL分析系统检测并拍照,Image J软件计算条带吸光度值。
2.6 Real-time PCR检测心肌组织CSE mRNA表达
再灌注结束后取大鼠左心室组织,Trizol试剂冰上提取总RNA后,测定样品RNA纯度及浓度。以总RNA为模板,按反转录试剂盒合成cDNA,进行扩增。引物序列:CSE-F:CCACCACAACGATTACCC;CSE-R:AGTCCAAACTCGGATGCC,引物长度:112 bp;β-Actin-F:CGTTGACATCCGTAAAGAC;β-Actin-R:TAGGAGCCAGGGCAGTA,引物长度:110 bp。PCR扩增条件为:95 ℃预变性 5 min,95 ℃ 5 s,56 ℃10 s,72 ℃ 25 s循环 40 次。以β-actin为内参基因,采用2-ΔΔCt法计算CSE mRNA相对表达量。
2.7 统计学处理
所有数据以Excel表格进行统计,Graphpad prism 7软件进行分析。结果以“x±s”表示,组间比较以one-way ANOVA单因素方差分析及q检验,以P<0.05为差异有统计学意义。
3 结果
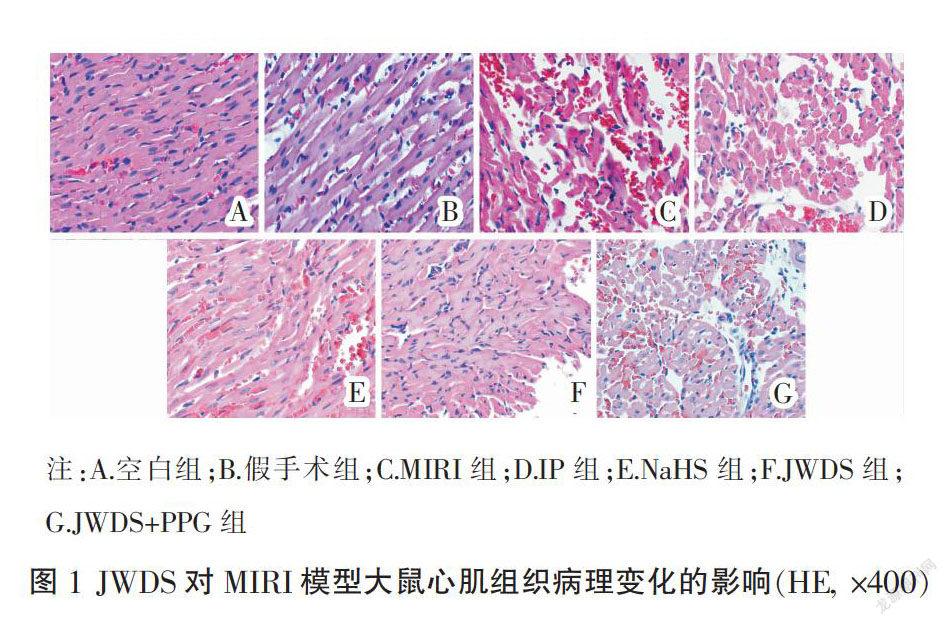
3.1 JWDS对MIRI模型大鼠心肌组织超微结构的影响
与空白组比较,模型组大鼠心肌组织局部坏死,细胞结构模糊,边界不清,胞内水肿明显,心肌细胞走形紊乱。与模型组比较,JWDS组大鼠心肌组织超微结构明显改善,细胞走形规律,轮廓完整,水肿程度减轻,JWDS+PPG组大鼠心肌组织坏死程度加重,细胞结构破坏,炎性细胞浸润增多。见图1。
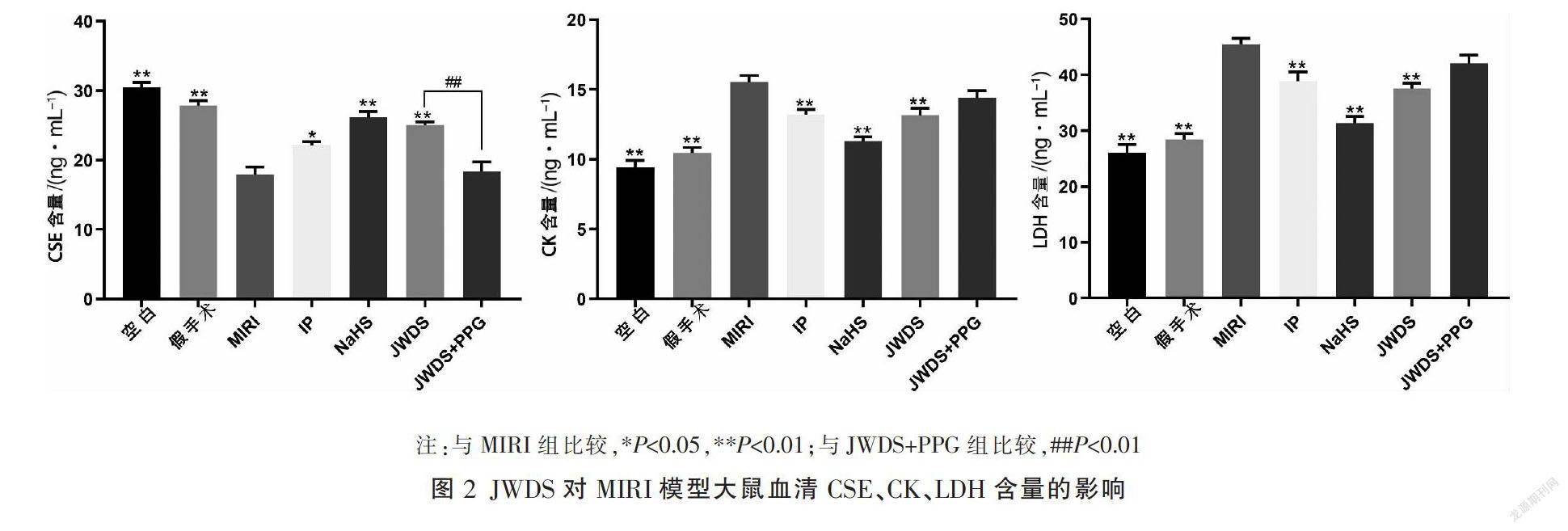
3.2 JWDS对MIRI模型大鼠血清CSE、CK、LDH含量的影响
与空白组比较,模型组大鼠血清LDH、CK含量明显升高(P<0.01),CSE含量明显降低(P<0.01)。与模型组比较,JWDS组LDH、CK含量明显降低(P<0.01),CSE含量明显升高(P<0.01)。与JWDS组比较,JWDS+PPG组CSE含量明显降低(P<0.01)。见图2。
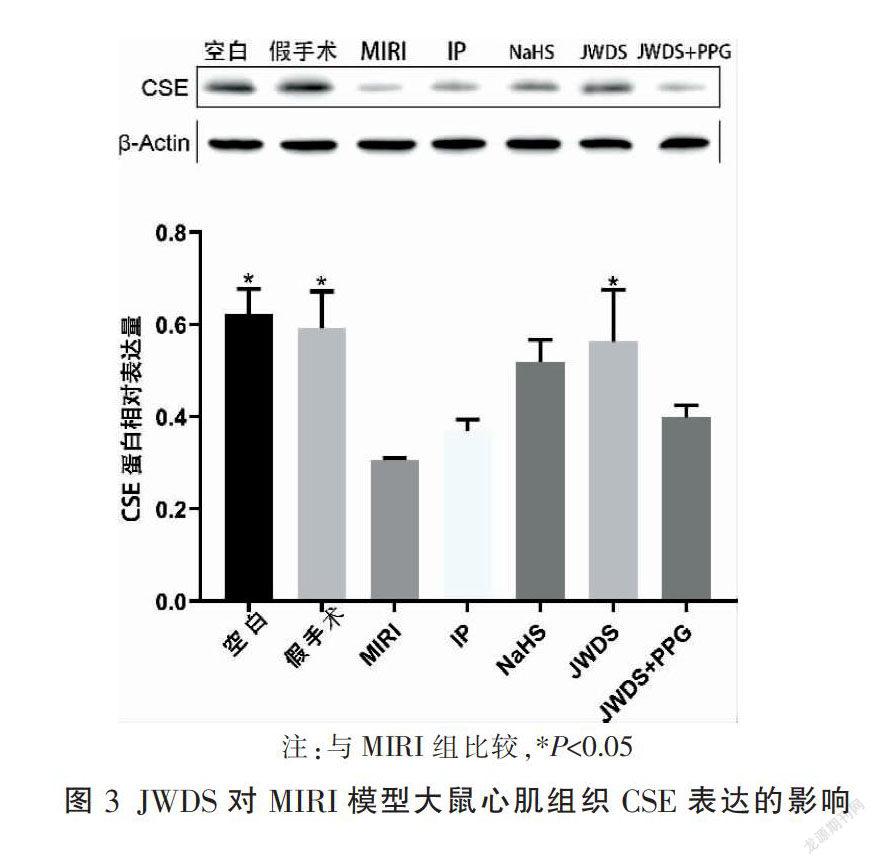
3.3 JWDS对MIRI模型大鼠心肌组织CSE蛋白表达的影响
与空白组比较,模型组大鼠心肌组织CSE表达明显降低(P<0.05);与模型组比较,JWDS组CSE表达明显升高(P<0.05);JWDS+PPG组CSE蛋白未见明显改变。见图3。
3.4 JWDS对MIRI模型大鼠心肌组织CSEmRNA表达的影响
与空白组比较,模型组大鼠心肌组织CSE mRNA表达明显降低(P<0.05)。与模型组比较,JWDS组CSE mRNA表达升高(P<0.01)。与JWDS组比较,JWDS+PPG组CSE mRNA表达明显降低(P<0.01)。见图4。
4 讨论
MIRI发病机制主要为心脏经缺血/再灌流刺激,心肌细胞损伤,能量供应障碍,氧自由基(reactive oxygen species,ROS)产生过多且生成过量脂质过氧化物,细胞内钙超载触发线粒体摄取Ca2+增加以及中性粒细胞浸润引发心肌细胞凋亡或自噬,细胞内LDH、CK等酶类异常升高,最终导致心肌梗死发生。同时再灌注损伤使得心肌代谢产物聚集,大量ROS产生,诱导细胞膜发生脂质化,降低细胞膜流动性,血管内皮细胞受损导致内源性NO合成减少,导致抑制ROS活性及OH生成能力下降[9]。研究发现机体对MIRI具有内源性的保护机制,因此以药物激活/模拟机体内源性保护机制可以发挥心肌保护作用,且无明显创伤性,临床使用更为方便,目前有诸如极化液、阿托伐他汀、环孢霉素A等药物已被证明具有干预MIRI发生/发展的作用,但鉴于MIRI是一种机制复杂的多因素疾病,对药物干预MIRI的作用机制及给药方案研究仍未得出明确结果[10-11]。
H2S是一种无色,有臭鸡蛋气味且易燃的水溶性气体,以NaHS形式存在于机体内,可分解为Na+与-HS,-HS与体内H+结合形成H2S,随着血液循环到达靶器官发挥保护作用。H2S是继NO、CO后发现的第三种内源性气体信号分子,参与机体内源性保护过程。内源性H2S的合成受CSE调控,CSE活性降低可导致H2S含量减少,减弱其对内皮细胞的保护作用。炔丙基甘氨酸(propargylglycine, PPG)对CSE活性具有不可逆性阻断作用,抑制机体H2S产生,进而引发或加重心肌缺血/再灌注损伤[12-15]。本实验研究将JWDS灌胃后14 d的大鼠再灌注前30 min以CSE合成酶抑制剂PPG(33.9 mg/kg)腹腔注射干预。实验结果显示,与仅用JWDS组相比,JWDS+PPG组血清中CSE含量明显降低,大鼠心肌组织损伤明显加重,心肌CSE表达也明显降低,可见反馈性加重对H2S合酶CSE的抑制,会使内皮源性H2S进一步减少,心肌损伤加重。实验结果提示JWDS对心肌的保护作用与H2S生成有较密切的联系。
中醫认为心肌缺血/再灌注损伤属“胸痹”范畴,“心脉闭阻”为其基本病机,临床多以活血化瘀法治疗,化瘀之法多以益气、行气为主。《灵枢·刺节真邪篇》云:“宗气不下,脉中之血,凝而留止”;《难经·二十二难》曰:“气主呴之,血主濡之”;王清任《医林改错》云:“元气既虚,必不能达于血管,血管无气必停留为瘀”;气能生血、行血和摄血,故“气为血之帅”,气虚则血瘀。吴焕林等[16]从319例冠心病患者证候分布规律分析发现,气虚占87.1%,血瘀占79.9%,提示气虚血瘀为临床主要证型。
JWDS是经长期临床实践总结出的治疗胸痹、防治缺血性心肌病的有效方剂,方中黄芪、丹参补气活血,当归、赤芍、川芎、红花、生地黄活血化瘀、养血和脉,全方共奏益气活血之效。本课题组前期研究发现JWDS不同配伍组方均对MIRI模型大鼠心肌组织具有保护作用,可抑制p38 MAPK信号通路,降低下游基因COX-2及ICAM-1表达,降低CK、LDH含量,减轻心肌损伤,且丹参、黄芪、赤芍、红花在组方中发挥主要作用[17-19]。然而JWDS是否通过调节内源性H2S合成发挥心肌保护作用的机制尚不明确,为阐明JWDS与内源性H2S合成的关系,本研究以外源性NaHS与JWDS以及CSE抑制剂(PPG)分别干预实验大鼠,再以结扎冠脉左前降支/再灌注方法复制MIRI模型,观察JWDS对MIRI模型大鼠心肌组织超微结构、血清CSE、CK、LDH含量、心肌组织CSE与mRNA表达的影响。结果发现JWDS可明显改善MIRI模型大鼠心肌组织超微结构,降低血清LDH、CK含量,升高CSE含量,减轻细胞水肿及坏死程度,上调心肌组织CSE与mRNA表达。研究结果显示JWDS对心肌缺血/再灌注损伤具有明显的保护作用,其机制与促进内源性H2S生成以保护心肌组织细胞结构、抑制CK、LDH漏出、上调CSE及mRNA表达有关。
参考文献
[1] ZHANG S J, SONG X Y, HE M, et al. Effect of TGF-β1/SDF-1/CXCR4 signal on BM-MSCs homing in rat heart of ischemia/perfusion injury[J]. European Review for Medical Pharmacological Sciences, 2016, 20(5):899-905.
[2] ZHU L, WEI T, GAO J, et al. The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J]. Apoptosis, 2015, 20(11):1433-1443.
[3] KALOGERIS T, BAO Y, KORTHUIS R J. Mitochondrial reactive oxygen species: a double edged sword in ischemia/reperfusion vs preconditioning[J]. Redox Biology, 2014, 2(1):702-714.
[4] IB?魣?譙EZ B, HEUSCH G, OVIZE M, et al. Evolving Therapies for Myocardial Ischemia/Reperfusion Injury[J]. Journal of the American College of Cardiology, 2015, 65(14):1454-1471.
[5] HAUSENLOY D J, YELLON D M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. Journal of Clinical Investigation, 2013, 123(1):92-100.
[6] SHIN B, COWAN D B, EMANI S M, et al. Mitochondrial Transplantation in Myocardial Ischemia and Reperfusion Injury[J]. Advances in experimental medicine and biology,2017, 982:595-619.
[7] KANG B, HONG J, XIAO J, et al. Involvement of miR-1 in the protective effect of hydrogen sulfide against cardiomyocyte apoptosis induced by ischemia/reperfusion[J]. Molecular Biology Reports, 2014, 41(10):6845-6853.
[8] ANDREADOU I, ILIODROMITIS E K, RASSAF T, et al. The role of gasotransmitters NO, H2S and CO in myocardial ischaemia/reperfusion injury and cardioprotection by preconditioning, postconditioning and remote conditioning[J]. British Journal of Pharmacology, 2015, 172(6):1587-1606.
[9] GREINER R. Polysulfides link H2S to protein thiol oxidation[J]. Antioxidants & Redox Signaling, 2013, 19(15):1749-1765.
[10] HEUSCH G, LIBBY P, GERSH B, et al. Cardiovascular remodelling in coronary artery disease and heart failure[J]. The Lancet, 2014, 383(9932):1933-1943.
[11] SZABO C. Hydrogen sulfide, an enhancer of vascular nitric oxide signaling: mechanisms and implications[J]. American Journal of Physiology Cell Physiology,2017,312(1):C3-C15.
[12] 彭凌云,陳协辉,梁进杰.CaR-CaM/CSE-H2S路径对缺血再灌注相关氧化应激的影响[J].心血管康复医学杂志,2018,27(3):247-250.
[13] 徐 超,赵鸿雁.硫化氢对脓毒症大鼠心肌损伤的作用及其机制探讨[J].四川大学学报(医学版),2018,49(4):540-545.
[14] HEUSCH G. Molecular basis of cardioprotection: signal transduction in ischemic pre-, post-, and remote conditioning[J]. Circulation Research, 2015, 116(4):674-699.
[15] DAS A, SAMIDURAI A, HOKE N N, et al. Hydrogen sulfide mediates the cardioprotective effects of gene therapy with PKG-Iα[J]. Basic Research in Cardiology, 2015,110(4):42.
[16] 吴焕林,阮新民,杨小波,等.319例冠心病患者证候分布规律分析[J].中国中西医结合杂志,2007,27(6):498-500.
[17] 陈 聪,廖 菁,李 鑫,等.加味丹参饮抑制p38MAPK表达保护缺氧/复氧乳鼠心肌细胞损伤的实验研究[J].湖南中医药大学学报,2016,36(2):35-39.
[18] 陈 聪,任 婷,胡 华,等.加味丹参饮预处理对大鼠心肌缺血再灌注损伤的保护作用[J].湖南中医药大学学报,2016,36(6):11-15.
[19] 陈 聪,黄政德,廖 菁,等.加味丹参饮不同组方对心肌缺血再灌注损伤COX-2、ICAM-2、P38 MAPK蛋白表达的影响[J].辽宁中医杂志,2016,43(12):2636-2638,2703-2704.
