二氢丹参酮对人非霍奇金淋巴瘤Raji细胞增殖、凋亡的影响及机制
2019-09-10陈亮董长城
陈亮 董长城
摘要 目的:探究二氢丹参酮对人非霍奇金淋巴瘤Raji细胞增殖、凋亡的影响及机制。方法:體外培养人非霍奇金淋巴瘤Raji细胞,并分为空白组和低/高剂量组,低/高剂量组以8、15 μmol/L二氢丹参酮处理,空白组以等量0.9%氧化钠注射液处理。用CCK-8法检测Raji细胞成活率,Annexin V-FITC/PI双染流式细胞术检测各组Raji细胞凋亡情况,试剂盒检测细胞中Caspase 8活性,免疫荧光法检测Raji细胞中CytC移位情况,蛋白免疫印迹法检测Raji细胞中Bad、Bax蛋白表达。结果:低/高剂量组药物干预24、48 h后细胞成活率及增殖指数低于空白组,差异有统计学意义(P<0.05)。干预48 h后,低/高剂量组Raji细胞凋亡率、Caspase 8活性及CytC表达量高于空白组,差异有统计学意义(P<0.05)。与空白组比较,低/高剂量组Bad蛋白表达升高,差异有统计学意义(P<0.05),Bax蛋白表达量差异无统计学意义(P>0.05)。结论:二氢丹参酮可有效抑制人非霍奇金淋巴瘤Raji细胞增殖,并诱导其发生凋亡,其作用机制与上调Caspase8的表达,诱导Bad表达有关,且呈剂量依赖性。
关键词 非霍奇金淋巴瘤;二氢丹参酮;增殖;凋亡;机制
Effects of Dihydrotanshinone on Proliferation and Apoptosis of Human Non-Hodgkin′s Lymphoma Raji Cells and its Mechanism
Chen Liang, Dong Changcheng
(Steel Hospital of Baotou City, Baotou 014010, China)
Abstract Objective:To investigate the effects of dihydrotanshinone on proliferation and apoptosis of human non-Hodgkin lymphoma Raji cells and its mechanism.Methods:Raji cells of human non-Hodgkin′s lymphoma were cultured in vitro and divided into a blank group and a low/high dose experimental group.The experimental group was treated with 8, 15 μmol/L dihydrotanshinone, and the blank group was treated with 0.9% NaCL.CCK-8 method was used to detect the survival rate of Raji cells, and Annexin V-FITC/PI double-staining flow cytometry was used to detect the apoptosis of Raji cells in each group.Caspase 8 activity was detected by kit, and Cytc translocation in Raji cells was detected by immunofluorescence, and Bad and Bax protein expression in Raji cells was detected by Western blotting.Results:The cell viability and proliferation index of low/high dose experimental group were lower than those of the blank group after 24 and 48 hours of drug intervention(P<0.05).After 48 hours of intervention, Raji cell apoptosis rate, Caspase 8 activity and Cytc expression in the low/high dose experimental group were higher than those in the blank group(P<0.05).WB detection showed that compared with the blank group, the expression of Bad protein in the low/high dose experimental group increased(P<0.05), and the expression of Bax protein had no significant difference(P>0.05).Conclusion:Dihydrotanshinone can effectively inhibit the proliferation and induce apoptosis of Raji cells in non-Hodgkin′s lymphoma, and its mechanism is related to up-regulation of Caspase 8 expression and Bad expression, and with dose-dependence.
Key Words Human non-Hodgkin′s lymphoma; Dihydrotanshinone; Proliferation; Apoptosis; Mechanism
中图分类号:R284;R733文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.12.023
非霍奇金淋巴瘤(Non-Hodgkin′s Lymphoma,NHL)是惡性淋巴瘤(Malignant Lymphoma,ML)的一种,占比达85%~90%,是一种具有高度侵袭性的血液系统恶性肿瘤,疾病进展迅速,较早发生远处扩散和结外侵袭,而单纯化疗治疗效果不佳[1-2]。从中草药资源中寻找新的活性化合物,提高患者的化疗敏感性、改善患者预后生命质量是目前临床研究的热点。二氢丹参酮属于菲醌类脂溶性化合物,其抗菌活性显著,且近年来研究报道,其可通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡,但与丹参其他生物学有效成分隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA等比较,抗肿瘤研究尚处于早期阶段,且在NHL方面的抗肿瘤效应研究尚不多见[3-4]。本研究重点探讨二氢丹参酮对人NHL Raji细胞增殖、凋亡的影响及机制。现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞株 人NHL Raji细胞,由中国科学院上海生命科学研究院馈赠。
1.1.2 试剂与仪器
主要试剂:二氢丹参酮(上海源叶生物科技有限公司,批号:YY90060)纯度98%;胎牛血清(杭州四季青公司,批号:08040502);RPMI-1640培养基(美国Gibco公司,批号:AE24464298);AnnexinV-FITC/PI凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:20170601);半胱氨酸天冬氨酸蛋白酶(Caspase-8)检测试剂盒(南京凯基生物公司,批号:BC3880);Bad、Bax抗体(美国Bioworld公司,批号:AB008、AB009)等。
主要仪器:SHEL-LAB2300型CO2培养箱,美国SHELDON公司产品;LXJ-II型超低温高速离心机,上海领成生物科技有限公司;IX71型荧光倒置显微镜,日本奥林巴斯公司产品;Elx800酶标仪,美国Bio-Tek公司产品;DY-A型稳压电泳仪,上海西巴斯公司;JY-ZY5型蛋白凝胶电泳转印系统,美国Bio Rad公司产品等。
1.2 方法
1.2.1 分组与模型制备
将Raji细胞采用含10%灭活胎牛血清的RPMI-1640培养基置于37 ℃ 5% CO2培养箱中培养,每2~3 d离心换液,进行传代培养,取生长至对数期状态良好的细胞进行后续实验研究[5]。
1.2.2 给药方法
消化细胞后调整细胞密度为2×105/mL,接种于96孔板中,分为空白组和低/高剂量组,每组设6个复孔,低/高剂量组以8、15 μmol/L二氢丹参酮处理,空白组以等量0.9%氧化钠注射液处理。
1.2.3 检测指标与方法
CCK-8法检测Raji细胞成活率:培养24、48 h后取出96孔培养板,每孔加10 μLCCK-8工作液,继续培养2 h,以酶标仪检测吸光度值(OD450 nm),计算细胞成活率=(组OD平均值/空白组OD平均值)×100%,重复3次检测[6]。
Annexin V-FITC/PI双染流式细胞术检测各组Raji细胞凋亡情况:于295 μL细胞悬液中加入Annexin V-FITC 5 μL,加入10 μL 10 μg/mL的碘化丙啶(PI),4 ℃避光反应15 min,加入200 μL 4 ℃缓冲液,应用Nex-in程序在guava easy Cyte8微流式细胞分析仪检测Raji细胞周期及凋亡率,实验重复3次,计算增殖指数=(S+G2/M)/(G0/G1+S+G2/M)[7]。
Raji细胞内Caspase 8活性检测:收集作用48 h后的Raji细胞,裂解细胞后收集上清。测定上清中蛋白浓度,采用Caspase-8试剂盒检测上清中Caspase-8含量,405 nm处测定各组细胞的吸光度值。
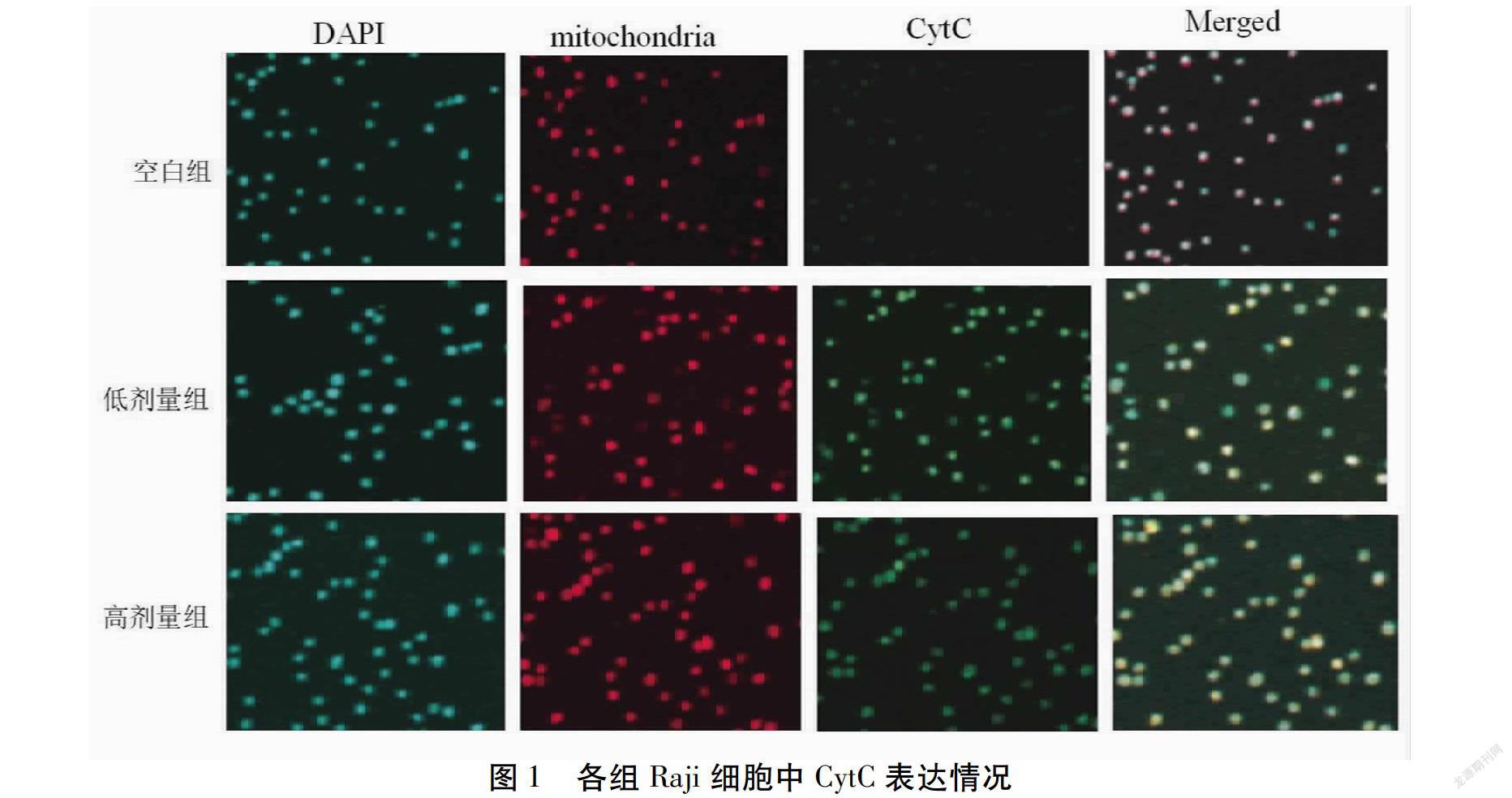
免疫荧光法检测Raji细胞中细胞色素C(CytC)移位情况:取培养于盖片上生长融合至95%左右的Raji细胞,4%甲醛固定,分别经DAPI、mitotracker Red CMXRos及绿色荧光标记后的CytC抗体孵育染色,激光共聚焦显微镜下观察Raji细胞中CytC蛋白移位情况[8]。
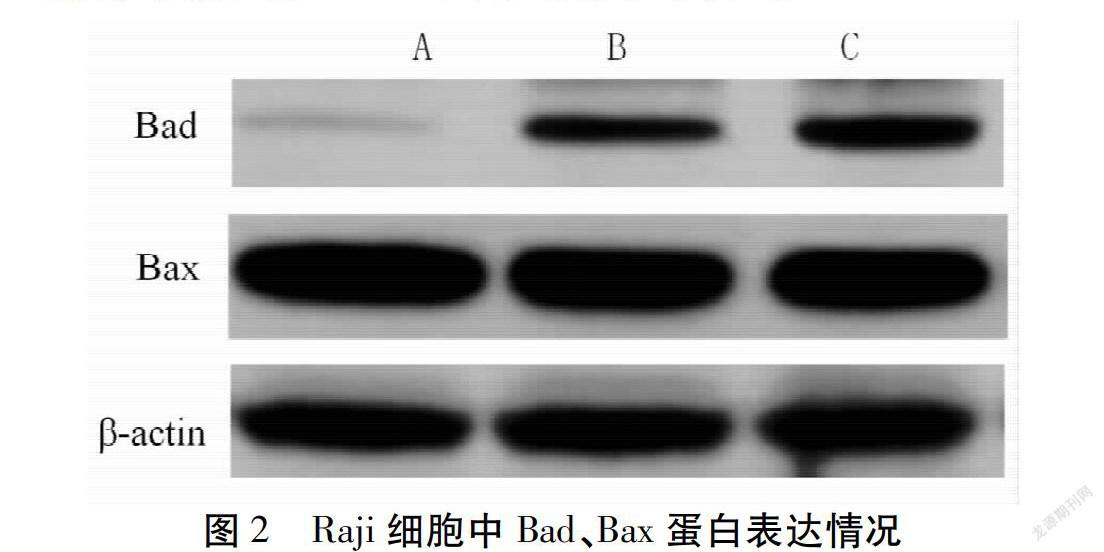
蛋白免疫印迹法检测Raji细胞中Bad、Bax蛋白表达:收集干预后48 h细胞,并提取细胞总蛋白,进行蛋白浓度测定,参照相关文献[7]检测方法检测Raji细胞中Bad、Bax蛋白条带积分吸光度值[9]。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,2组间比较进行独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组Raji细胞形态及增殖情况比较
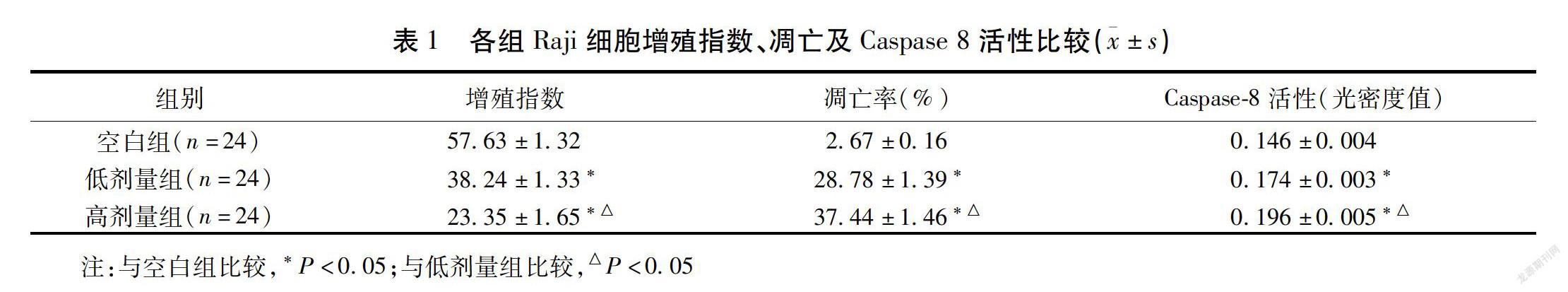
正常组Raji细胞形态规则,贴壁生长,组细胞形态不规则,立体感较差,大量细胞出现圆缩,间隙增加,可见部分细胞碎片。干预24 h后,空白组和低/高剂量组Raji细胞成活率分别为(99.42±0.13)%,(86.34±4.45)%,(78.56±9.73)%,干预48 h后,空白组和低/高剂量组Raji细胞成活率分别为(98.46±0.21)%,(66.47±6.45)%,(48.55±4.43)%,低/高剂量组干预24、48 h细胞活率及增殖指数均低于空白组,差异有统计学意义(P<0.05)。见表1。
2.2 各组Raji细胞凋亡情况及Caspase-8活性比较
干预48 h后,低/高剂量组Raji细胞凋亡率高于空白组,且高剂量组高于低剂量组(P<0.05)。见表1。
2.3 Raji细胞中Caspase 8活性及细胞色素C(CytC)表达情况
干预48 h后,低/高剂量组Raji细胞Caspase 8活性均高于空白组,且高剂量组高于低剂量组,差异有统计学意义(P<0.05)。见表1。低/高剂量组Raji细胞CytC表达量高于空白组,差异有统计学意义(P<0.05)。见图1。
2.4 各组Raji细胞Bad、Bax蛋白表达比较
与空白组比较,低/高剂量组Bad蛋白表达量均升高,差异有统计学意义(P<0.05)。Bax蛋白表达差异无统计学意义(P>0.05)。见图2,表2。
3 讨论
NHL目前治疗策略以化疗为主,且与常规NHL的化疗方案比较,高强度、短疗程包含CTX、MTX、Ara-c的各种化疗方案效果更佳,另外增加利妥昔单抗更有助于进一步增强疗效;但由于疾病的高度恶性和侵袭性,目前临床整体治疗效果仍不令人满意[10]。从中医学理论来说NHL起病源于正气虚损,加之癌毒侵袭,与痰、瘀互结所致。正气虚损与肾、脾的关系密切,肾为先天之本,《诸病源候论》曰:“肾藏精,精者,血之所成也”。脾为后天之本,《景岳全书》曰:“血者水谷之精也,源源而来,生化于脾”。均说明了肾、脾与气血、正气的密切联系;化疗药物属于攻邪类药物,此类药物在“以毒攻毒”的同时会损伤阴阳气血及脾、肾等脏,这也是NHL治疗中常提到的“攻邪伤正”理论[11-12]。
丹参是具有活血化瘀、益气安神、凉血消肿的传统中药,二氢丹参酮是丹参的抗肿瘤活性成分之一,近年来有关其体外抗肿瘤效应日渐突出,可有效抑制体外培养的卵巢癌细胞A2780[13]、人肝癌细胞[14]的增殖与转移,但目前有关二氢丹参酮对NHL的抗肿瘤效应研究尚不多见。本研究结果证实,与空白组细胞比较,二氢丹参酮干预后Raji细胞成活率及增殖指数明显降低,凋亡率明显升高,证实二氢丹参酮也具有较好的抑制Raji细胞增殖,并诱导其凋亡的作用。外源性凋亡途径主要由细胞表面死亡受体介导,而内源性凋亡途径主要由线粒体介导,外源性和内源性凋亡途径均可引起胞内Caspase-8的活化而导致细胞凋亡的发生。胞内酶原形式的pro-caspase 8经死亡受体与其相应配体结合后被激活,Bad、Bid、Bim等为Bcl-2家族成员,接受胞内死亡信号后激活,与Bax、Bak作用后导致蛋白寡聚并插入线粒体膜,膜通透性改变导致大量CytC移位并释放,胞质中的Caspase-9前体活化并进而启动Caspase级联反应,激活下游的Caspase-3和Caspase-7,完成底物剪切而引起细胞凋亡[15]。孙蓓等[16]研究发现,二氢丹参酮通过下调Bcl-2蛋白的表达、上调Caspase-3蛋白的表达对人肺腺癌GLC-82细胞产生较强的抑制作用,并诱导其凋亡。Lee等[17]发现,二氢丹参酮作用肝癌HepG2细胞后,检测到细胞内caspase 3、8、9活性增高,Bax表达上调。Ishitsuka等[18]用和厚朴酚诱导多发性骨髓瘤细胞凋亡时,发现胞内caspase 3、7、8、9活性增高,Bad表达上调。
本研究结果显示,干预48 h后,低/高剂量组Raji细胞Caspase 8活性及CytC表达量均高于空白组,与空白组比较,低/高剂量组Bad蛋白表达量均升高,Bax蛋白表达量无明显差异。提示二氢丹参酮可有效抑制人NHL Raji细胞增殖,并诱导其发生凋亡,其作用机制与上调Caspase8的表达,诱导Bad表达有关,且呈现一定的剂量依赖性。
参考文献
[1]Torres-Collado AX,Jazirehi AR.Overcoming Resistance of Human Non-Hodgkin′s Lymphoma to CD19-CAR CTL Therapy by Celecoxib and Histone Deacetylase Inhibitors[J].Cancers(Basel),2018,10(6):E200.
[2]Hilmenyuk T,Ruckstuhl CA,Hayoz M,et al.T cell inhibitory mechanisms in a model of aggressive Non-Hodgkin′s Lymphoma[J].Oncoimmunology,2017,7(1):e1365997.
[3]孫蓓,叶因涛,王冬,等.二氢丹参酮对人肺癌GLC-82细胞的抑制作用及其机制研究[J].中国药房,2015,15(34):4775-4778.
[4]Lal P,Cerofolini L,D′Agostino VG,et al.Regulation of HuR structure and function by dihydrotanshinone-I[J].Nucleic Acids Res,2017,45(16):9514-9527.
[5]刘加军,潘祥林,伍新尧,等.冬凌草甲素对Raji细胞的增殖抑制作用及其机制[J].中草药,2004,35(7):774-777.
[6]蒋庚西,李春光,赵铁军,等.沉默Yes相关蛋白1对人非小细胞肺癌细胞增殖和侵袭的影响[J].第二军医大学学报,2017,38(8):1004-1008.
[7]王晓丽,韩翠艳,李宏铃,等.Fas/FasL信号途径参与17-羟-岩大戟内酯B诱导U251细胞凋亡[J].中药药理与临床,2017,12(1):48-51.
[8]梁俭,骆杰炉,蔡庆群,等.基于不同Caspase凋亡通路的玄参环烯醚萜总苷抑制心肌梗死模型大鼠心肌细胞凋亡的作用机制研究[J].中国药房,2019,30(6):735-740.
[9]徐余超,陈晓伟,孙海翔,等.LY294002抑制PI3K/AKT/mTOR信号通路对胃癌细胞MGC-803的影响[J].环境与职业医学,2017,34(5):403-409.
[10]韩屹,张天翔,姚星星,等.非霍奇金淋巴瘤患者自体造血干细胞移植干细胞动员采集现状和疾病负担调查[J].中国药物经济学,2019,14(6):18-22.
[11]陈聪,侯雅静,陈云志,等.小金丹治疗肿瘤研究探讨[J].世界中医药,2019,14(9):2251-2253.
[12]付婷婷,王昌俊,黄旭晖.化痰祛瘀散结汤联合榄香烯注射液治疗恶性淋巴瘤临床疗效观察[J].四川中医,2017,43(8):102-105.
[13]姜国强.二氢丹参酮Ⅰ抑制卵巢癌增殖与转移作用的机制研究[D].大连:大连医科大学,2017.
[14]江城锋.丹参酮类化合物结构修饰及其放射增敏活性的研究[D].北京:北京协和医学院;中国医学科学院,2012.
[15]Zheng Q,Jiang Y,Zhang A,et al.The Mechanism of Mitochondria-Mediated Pathway in the Apoptosis of Platelets in Immune-Induced Bone Marrow Failure[J].Chin J Physiol,2017,60(6):338-344.
[16]孙蓓,叶因涛,王冬,等.二氢丹参酮对人肺癌GLC-82细胞的抑制作用及其机制研究[J].中国药房,2015,23(34):4775-4778.
[17]Lee WY,Liu KW,Yeung JH.Reactive oxygen species-mediated kinase activation by dihydrotanshinone in tanshinones-induced apoptosis in HepG2 cells[J].Cancer Lett,2009,285(1):46-57.
[18]Ishitsuka K,Hideshima T,Hamasaki M,et al.Honokiol overcomes conventional drug resistance in human multiple myeloma by induction of caspase-dependent and-independent apoptosis[J].Blood,2005,106(5):1794-1800.
(2019-09-27收稿 責任编辑:杨觉雄)
