基于全生命周期理念的中药安全性真实世界研究模式
2019-09-10郑文科金鑫瑶张俊华杨丰文黄宇虹谢雁鸣王保安鞠爱春张伯礼
郑文科 金鑫瑶 张俊华 杨丰文 黄宇虹 谢雁鸣 王保安 鞠爱春 张伯礼
摘要 安全性评价是中药上市后再评价的重点与难点,以自发呈报系统为主的被动监测和以集中监测为主的主动监测等方法较为常用,但不能实现对中药安全性风险的连续监测。全生命周期监管理念的提出为中药安全性评价提出新的更高要求,这需要机制和模式创新,需要医院、企业、合同研究组织、科研院所、管理部门等多方的联合行动。真实世界研究为中药安全性连续性监测研究提供了路径,搭建基于移动互联和大数据技术的公共数据平台,可以获取中药安全性相关的真实世界数据,通过数据综合分析可以形成真实世界证据,为识别安全风险、制定风险最小化措施提供遵循。
关键词 安全性评价;真实世界研究;全生命周期;大数据;上市后;风险评估;科学监管;集中监测
Real-World Study Model for Safety of Chinese Medicine Based on the Concept of Whole Life Cycle
Zheng Wenke1, Jin Xinyao1, Zhang Junhua1, Yang Fengwen1, Huang Yuhong2, Xie Yanming3, Wang Baoan4, Ju Aichun5, Zhang Boli1
(1 Evidence-based Medicine Center, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China; 2 The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China; 3 Institute of Basic Research in Clinical Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China; 4 Shaanxi Momentum Qixuehe Pharmaceutical, Co., Ltd., Xianyang 712000 ,China;5 Tianjin Tasly Pride Pharmaceutical Co., Ltd., Tianjin 300410, China)
Abstract Safety evaluation is the key and difficult point of re-evaluation of post-marketing Chinese medicine.Methods such as passive monitoring based on spontaneous reporting systems and active monitoring based on centralized monitoring are more commonly used, but continuous monitoring of the safety risks of Traditional Chinese Medicine cannot be achieved.The proposal of the whole-life-cycle supervision concept puts forward new and higher requirements for the safety evaluation of Traditional Chinese Medicine.This requires innovations in mechanisms and models, as well as joint actions by hospitals, enterprises, contract research organizations, research institutes and management departments.Real-world study provides a path for the continuous monitoring of Chinese medicine safety.The development of public data platforms based on mobile internet and big data technology can be used to obtain real-world data related to the safety of Chinese medicine.Comprehensive data analysis can generate real-world evidence for identifying risks and developing risk minimization solutions.
Key Words Safety evaluating; Real world study; Whole life cycle; Big data; Post marketing; Risk assessment; Scientific management; Centralized monitoring
中图分类号:R2-03文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.12.003
安全、有效是藥物基本属性。安全性评价是揭示药物特性,保障用药安全的重要措施,是指导临床合理用药的重要依据。临床安全性评价主要通过一系列方法发现药物在人体产生的不良作用,确定其发生类型、发生率,以及相关危险因素的科学研究过程。近年来,一系列药害事件的发生,使得中药安全性备受关注[1-2]。2009年,原国家食品药品监督管理局(SFDA)要求开展中药注射剂安全性再评价,并提出了具体要求。中共中央、国务院发布的《关于促进中医药传承创新发展的意见》中也明确提出要加强中药质量安全监管,加强中药注射剂不良反应监测[3]。可见,中药安全性评价是中药研究领域的重要问题。
我国早期药物安全性评价多依赖被动监测,例如自发呈报系统。该方法简便易于操作,可以发现风险信号,但无法得到不良反应发生率,也难以判定药品和不良事件的因果关系。学术界也一直探索更加适宜的安全性评价方法。随着电子医疗记录系统的普及,药物不良事件主动监测在药物安全性评价中发挥着越来越重要的作用[4]。我国药品安全性评价正从被动监测向主动监测与被动监测相结合转变过程中,药品生产企业也逐步重视药物上市后安全评价工作[5]。
中药注射剂产学研合作组织的创立者任德权教授、上海市药品不良反应监测中心杜文民博士、中国中医科学院谢雁鸣研究员等,自2009年起,率先将真实世界研究(Real-world Study,RWS)概念引入中药安全性评价研究[6]。2016年,美国发布的《21世纪治愈法案》(21st Century Cure Act,21CCA)[7],从政策层面肯定了真实世界研究(RWS)的价值与意义,推动了真实世界研究的发展。
1 真实世界研究与中药安全性评价
RWS还没有确切的定义。吴阶平医学基金会发布的《真实世界研究指南》提出,RWS是对临床常规产生的真实世界数据进行系统性收集并进行分析的研究。该定义强调了RWS与随机对照试验(Randomized Controlled Trial,RCT)是互补的关系。RWS包括观察性研究和试验性研究。观察性研究进一步分为描述性研究,如病例个案报告,病例系列研究、横断面研究;分析性研究,如巢式病例对照研究、队列研究。试验性研究则主要为实效性临床研究。在分析真实世界研究兴起的背景基础上,可以从狭义的角度定义真实世界研究,即基于数据平台记录的医疗或健康数据开展的研究。强调RWS是基于数据的研究,可以与以往研究方式进行区分,避免真实世界研究概念的泛化,更有现实意义。
真实世界研究用于药物安全性评价具有天然的优势。由于真实世界研究更贴近真实诊疗环境,能纳入很多RCT研究无法纳入的人群(比如儿童、老年人、合并其他严重疾病的患者等),能够获得在复杂未知条件下发生的不良事件,也能获得一些迟发的安全性事件。真实世界研究与以往自发呈报的本质差异在于是否为主动收集,可以避免漏报,获得更加全面的信息,且实施较为容易,研究费用也比医院集中监测研究低,可以实现研究样本的连续累积,实现全生命周期管理。因此,真实世界研究适用于中药上市后临床安全性评价的要求,以下介绍中药安全性真实世界研究的3种不同模式。
2 中药安全性评价模式的演变
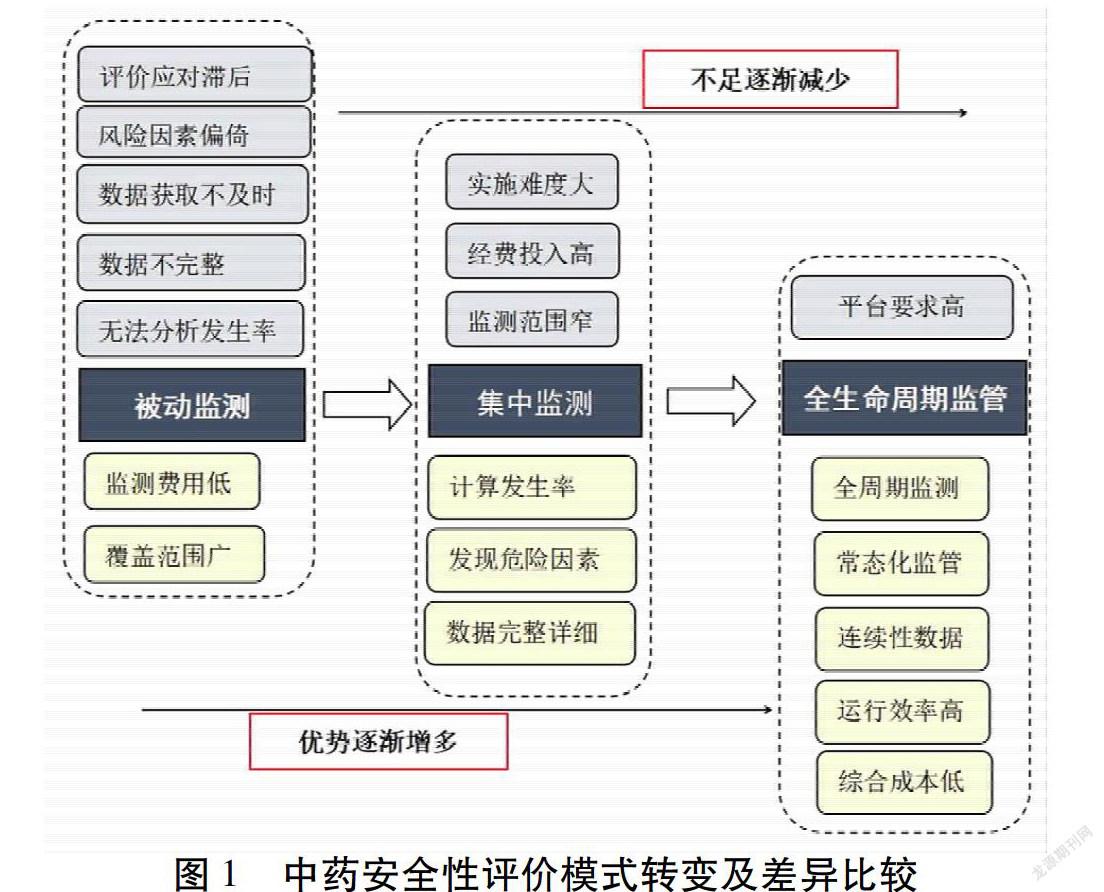
自国家监管部门要求开展中药安全性评价十年来,国内陆续开展了基于自发呈报系统的研究,医院集中监测研究,基于HIS数据挖掘的研究等,评价理念正逐步转变,安全性评价开展的广度、深度和研究质量等方面都有了很大的提高。在药品全生命周期管理的理念指导下,也推动形成了新的评价模式。我国药品上市后安全性再评价研究,大致可分3个研究模式,也呈现出发展递进的特征。见图1。
2.1 被动监测模式
被动监测已经应用了半个多世纪,是评价药物安全性的第一阶段,成为世界各国针对药品风险监测的常规性工作。自发呈报系统是被动监测的主要方式,是医务人员将在临床实践过程中发现的可疑ADR报告给药品生产、经营企业、ADR监测专业机构、药品监督管理部门。以自发呈报为主的被动监测是一个开放式的信息收集系统,可以快速捕捉风险信号,覆盖范围广,研究费用低,而且不影响医师处方习惯或日常临床工作,是药物安全性评价不可或缺的监管手段。
国际上常见的自发呈报系统有世界卫生组织(WHO)国际药物监测合作中心、美国安全性信息和不良事件报告系统(Med Watch)、英国不良反应黄卡制度、加拿大药物不良反应监测中心(CADRMP)、澳大利亚不良反应蓝卡制度。
自发呈报为我国药品不良反应监测最主要的方式之一,国家颁布《药品不良反应报告和监测管理办法》,规范药品不良反应报告形式及内容,并且每年发布《国家药品不良反应监测年度报告》,对药品不良反应信息进行汇总分析[9-10]。2019年10月发布的《国家药品不良反应监测年度报告(2018年)》显示:1999年至2018年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》1 368万份;2018年全国药品不良反应监测网络收到《药品不良反应/事件报告表》149.9万份,全国97.9%的区县报告了药品不良反应;来自医疗机构的报告占86.8%、来自药品经营企业的报告占8.0%、来自药品生产企业的报告占5.1%、来自个人及其他报告者的报告占0.1%;其中化学药品占83.9%、中药占14.6%、生物制品占1.5%;按照药品给药途径统计,静脉注射给药占60.0%、其他注射给药占4.2%,口服给药占32.2%,其他给药途径占3.6%。
随着药物安全性评价要求的提高,自发呈报系统的局限性愈发突出。被动监测存在不良事件漏报现象严重、报告随意性大、填报数据不完整、数据获取不及时;缺少用药基础数据,导致无法分析不良事件/不良反应发生率,无法判断药物与不良事件之间的因果关系,进而难以分析药物的危险因素,导致安全性评价应对滞后。
2.2 医院集中监测模式
针对被动监测模式“没有分母”的局限性,特别是需要对高风险品种进行集中评价,以医院集中监测为代表的主动监测模式得到重视,成为中药安全性评价的第二种模式。医院集中监测是指在一定时间(数月、数年)、一定范围(某一医院、几个医院或某一地区)内详细登记药物ADR发生的情况[11],分析ADR的发生规律和相关风险因素。相比于自发呈报系统,集中监测系统具有记录资料全面、可靠等优点。
应用医院集中监测方法对中药注射剂开展安全性研究集中出现在2010年以后[12-13]。基于已發表的文献,已经至少有14个品种开展了样本量超过30 000例的医院集中监测研究,涉及296 200例被监测对象[14]。通过对集中监测研究获得数据的分析,可以得出中药注射剂的不良反应发生率,约2~6‰。同时,发现了部分危险因素,如年龄、滴速、合并用药、用药疗程等与不良事件的发生相关。天津中医药大学针对医院集中监测研究在设计、实施过程中涉及到的各个环节,包括伦理、统计、医院选择、数据管理、标准化建设等方面进行了规范,并发布了专家共识[15-21]。谢雁鸣研究员带领的团队将中成药上市后安全性医院集中监测技术规范建立了团体标准[22],使之更具科学性和可操作性。
然而,集中监测研究同样存在样本少、经费投入大、实施难度大等局限性。按照“三例原则”,为了发现罕见不良反应,必须监测至少3万例患者,投入经费达到千万级。集中监测研究还属于前瞻性研究,样本量大,需要过程质量控制来保证数据可靠性和完整性,需投入大量数据核查和数据清洗工作,实施难度大。而且医院集中监测属于横断面研究,对于药品的全生命周期而言,仅监测一段时间内的用药情况,其信息收集不全面,仅监测数万例患者的用药情况,样本的代表性不充分。
2.3 全生命周期监管模式
所谓药品全生命周期管理,是指从药品的研发、审评注册、上市使用到上市后评价的整个过程。只要药品没有撤市,就需要进行有效性、安全性的监测和管理。2017年,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出要“加强药品医疗器械全生命周期管理”,成为新时代药品及器械安全性风险管控的新要求,也标志着中药安全性监测进入新的阶段。
全生命周期管理模式具有以下几个优势:1)监测常态化。将日常临床实践纳入监测范围,涉及更大范围的人群,临床与监测研究紧密结合,实现真实世界研究的常态化;2)全周期监测。从药品上市开始即进行监测,直至退市,囊括整个用药周期,可实现长周期观察,弥补横断面分析的不足;3)数据连续性。由于全周期监测,所获得数据并非片段式,而是具有连续、完整的特点,可以获得安全性的全景数据,也可以用于对远期效应、终点事件的追踪评估;4)运行效率高。通过健康大数据平台和移动、可穿戴设备的应用,可以大大减少人力投入,缩短数据获取、分析的流程和时间,大大提高研究效率;5)综合成本低。通过建立企业、医院、研究机构及合同研究组织的联合体,可以同时对多个品种进行全生命周期监测,可以解决企业发起的单个品种集中监测研究高成本问题,通过资源整合,节约研究成本支出。当然,该模式的顺利运行,需要协调多方共同参与,并且需借助大数据、人工智能等先进信息技术平台支持。
3 全生命周期监管模式框架
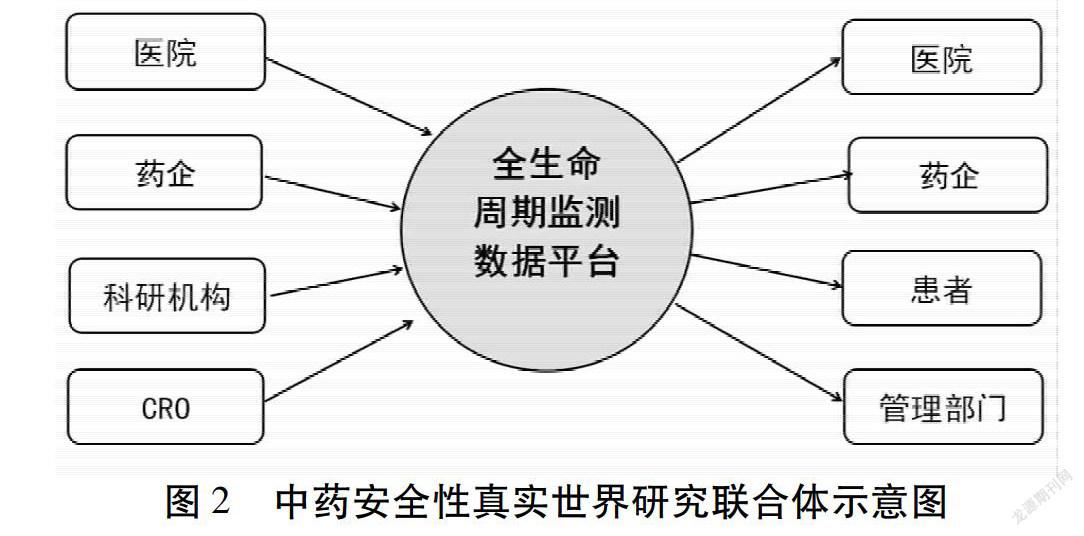
全生命周期监管是药物警戒的要求,也是未来中药安全性评价需要努力实现的方向。全生命周期的监管,涉及到多个主体和多个实施环节,包括生产企业、销售团体、监管部门、科研单位、医疗机构、患者人群。各方既是数据产生和采集的主体,也是数据利用和分享的主体。
开展基于全生命周期监管理念的中药安全性真实世界研究,需要通过建立科研单位-医院-企业-合同研究组织相结合的联合体。见图2。需要顶层设计统一架构,形成系统化、规范化、节约化运行的机制[24]。科研单位提出中药安全性评价真实世界研究的顶层设计,相关机构负责运行保障以及质量控制,在医疗单位实时收集目标药物的不良反应信息,汇总到不良反应数据中心,通过科研单位的数据分析,发现并明确风险信号,进而形成知识并通过说明书修订等方式递交给用户端,即医院、政府监管部门、患者以及企业。
该评价模式采用共建共享的方式,在医院集中监测研究的基础上进行升级,可较快转变为全生命周期动态管理模式,可以节约大量的成本,有利于快速提升企業的风险防控能力,提升对产品安全性的认识,不断提升临床合理安全用药水平。
当前,天津中医药大学临床循证评价团队已经搭建了相应数据平台,并开展中药安全性全生命周期监管模式的实践。
4 小结
随着中药临床应用的增长,中药安全性相关问题也日益受到重视和关注。中药虽然人用经验丰富,但是前期科研基础薄弱,部分药品说明书中不良反应尚不明确,缺乏药物间相互作用等信息。为了保障患者用药安全,必须开展安全性评价,而自发呈报系统以及横断面研究不能满足当前的需求,全生命周期监管势在必行。
全生命周期监管的理念为中药安全性评价提出了新要求,真实世界研究则为中药安全性评价提供了新思路。RWS符合中药安全性全生命周期监管的要求,还需要数据库平台的搭建、研究方法创新和研究联合体的建立,逐步形成高效的运行模式和保障机制。人工智能、大数据等先进信息技术的发展应用,可为中药安全性真实世界研究提供技术保障。基于全生命周期理念的中药安全性真实世界研究将成为主流研究模式,有助于深化对中药安全性的科学认识,为用药安全和产业健康发展提供证据支撑。
参考文献
[1]包国光,李晓霞.中药不合理应用引发药害问题的原因及防治[J].中国现代药物应用,2010,4(15):138-139.
[2]唐培仙,毛亚锦,张泽敏.因注射剂保存和使用不当造成药害现象的探讨[J].中国现代药物应用,2009,3(10):192-193.
[3]中共中央国务院关于促进中医药传承创新发展的意见[N].人民日报,2019-10-27(001).
[4]Sharrar R G,Dieck G S.Monitoring product safety in the postmarketing environment[J].Therapeutic Advances in Drug Safety,2013,4(5):211-219.
[5]Li L,Yin J.Drug Safety Evaluation in China[J].Current Allergy and Asthma Reports,2019,19(9):39.
[6]钟振华.中药注射剂的真实世界研究[J].中国处方药,2009,8(4):19.
[7]Scott Gottlieb,蒋蓉.21世纪治愈法案:医药创新的进展与发展路径[J].中国食品药品监管,2018,16(2):46-53.
[8]吴嘉瑞.基于文献数据库和传统药物警戒思想的中药注射剂安全性研究[D].北京:北京中医药大学,2007.
[9]药品不良反应报告和监测管理办法[J].药物不良反应杂志,2011,13(3):173-179.
[10]侯永芳,王丹,田春华,等.新旧《药品不良反应报告和监测管理办法》对比分析[J].中国药事,2011,25(11):1075-1078+1088.
[11]曾繁典,施侣元,詹思延(译).药物流行病学教程[M].JohnWiley&Sons(Asia)Pte Ltd,2008:2.
[12]李学林,唐進法,孟菲,等.10409例丹红注射液上市后安全性医院集中监测研究[J].中国中药杂志,2011,36(20):2783-2785.
[13]李晓黎,王建平.开展中草药注射剂不良反应集中监测确保用药安全[J].海峡药学,2010,22(12):315-317.
[14]李晴,李蓓蓓,郑文科,等.基于296200例的中药注射剂临床安全性集中监测研究的系统评价[J].中国循证医学杂志,2019,19(1):28-35.
[15]张俊华,任经天,胡镜清,等.中药注射剂临床安全性集中监测研究设计与实施专家共识[J].中国中药杂志,2017,42(1):6-9.
[16]郑文科,张俊华,翟静波,等.中药注射剂上市后安全性集中监测研究医院相关问题的思考[J].世界科学技术-中医药现代化,2016,18(12):2101-2104.
[17]王辉,张俊华,郑文科,等.中药注射剂安全性医院集中监测研究伦理学相关问题的思考[J].世界科学技术-中医药现代化,2017,19(1):161-165.
[18]翟静波,张俊华,阎小妍,等.中药注射剂安全性医院集中监测研究的统计分析相关问题及对策[J].世界科学技术-中医药现代化,2017,19(1):166-170.
[19]郑文科,张俊华,翟静波,等.中药注射剂上市后安全性集中监测研究医院相关问题的思考[J].世界科学技术-中医药现代化,2016,18(12):2101-2104.
[20]刘智,郑文科,张俊华,等.中药注射剂安全性医院集中监测研究数据管理内容与要点[J].世界科学技术-中医药现代化,2016,18(12):2083-2087.
[21]曹红波,张俊华,翟静波,等.中药注射剂安全性医院集中监测研究的标准化建设[J].世界科学技术-中医药现代化,2016,18(12):2093-2096.
[22]谢雁鸣,廖星,姜俊杰,等.中成药上市后安全性医院集中监测技术规范[J].中国中药杂志,2019,44(14):2896-290.
[23]费菲.詹思延:大数据和主动监测给药物全生命周期管理“脱胎换骨”[J].中国医药科学,2019,9(4):4-6.
[24]谢沂伯,纪立伟.基于HIS的医院药品安全性监测管理系统设计与应用[J].中国卫生信息管理杂志,2015,13(3):279-283.
(2019-11-10收稿 责任编辑:徐颖)
