提高多中心临床研究伦理审查效率和质量的探索及思考
2019-09-10王晶晶范士志廖祥丽段鸿彦朱剑武
王晶晶 范士志 廖祥丽 段鸿彦 朱剑武
中圖分类号 R951 文献标志码 A 文章编号 1001-0408(2019)23-3196-04
DOI 10.6039/j.issn.1001-0408.2019.23.05
摘 要 目的:探索提高多中心临床研究伦理审查效率和质量的方法。方法:《关于深化审批制度改革鼓励药品医疗器械创新的意见》《药品注册管理办法(修订稿)》政策出台后,结合我中心实际与实践,分析我中心提高伦理审查效率和质量的方法、完全备案制方式可能存在的问题以及提高多中心临床研究伦理审查效率和质量的途径。结果与结论:我中心采取了多样化的审查方式(会议审查、快速审查、备案制等),通过对研究项目实施分级管理及差异化审查流程,制订备案制操作细则等方式提高审查的效率和质量,跟踪审查和实地访查次数有所增加。我中心伦理委员会在探索过程中,认为完全实行备案制会出现组长单位伦理审查质量难以评估、各中心研究资质及条件不一等问题。为提高多中心临床研究伦理审查的效率和质量,可采用提高中心伦理的审查质量、加强各中心伦理委员会间的沟通与互认、建立伦理委员会秘书初审制等措施,实现效率与质量的平衡。
关键词 多中心临床研究;伦理备案制;伦理审查质量;伦理审查效率
Exploration and Reflection on Improving the Efficiency and Quality of Ethical Review in Multi-center Clinical Trial
WANG Jingjing1,FAN Shizhi2,LIAO Xiangli1,DUAN Hongyan1,ZHU Jianwu3(1.Office of Ethics Committee, Daping Hospital of Army Medical University, Chongqing 400042, China;2.Dept. of Cardio-vascular Surgery, Daping Hospital of Army Medical University, Chongqing 400042, China;3.Medical Research Department, Daping Hospital of Army Medical University, Chongqing 400042, China)
ABSTRACT OBJECTIVE: To explore the ways to improve the efficiency and quality of ethical review in multi-center clinical trial. METHODS: After issuing the policy of Opinions on Deepening the Reform of Approval System and Encouraging the Innovation of Pharmaceutical Medical Devices and Measures for the Administration of Drug Registration (Revised Version), combined with the practice of our center, the methods to improve the efficiency and quality of ethical review, the possible problems of complete filling system and the way to improve the efficiency and quality of ethical review in multi-center clinical trial were analyzed in our center. RESULTS & CONCLUSIONS: Our center adopted a variety of review methods (conference review, rapid review, filing system, etc.), implemented hierarchical management and differential review process for research projects, and formulated defined rules of filling system operation and other ways to improve the efficiency and quality of review, doubled the review efficiency, increased the number of follow-up review and field visit. In the process of exploration, the ethics committee of our center believes that the complete implementation of the filing system will lead to problems such as the difficulty to evaluate the quality of the ethical review of the leader unit, different research qualifications and conditions of each center, etc. In order to improve the efficiency and quality of the ethical review of multi-center clinical research, the measures are can be adopted, such as improving the quality of the ethical review of the center, strengthening the communication and mutual recognition of the ethics committees of each center, and establishing the preliminary review system of the secretary of the ethics committee, so as to realize the balance of efficiency and quality.
KEYWORDS Multi-center clinical trial; Ethical filling system; Ethical review quality; Ethical review efficiency
2003年版《药物临床试验质量管理规范》[1](GCP)第六十五条指出,多中心临床试验是由多位研究者按同一试验方案在不同地点和单位同时进行的临床试验。研究项目需要获得所有参研单位的伦理审查批件,每家单位逐一独立审查,这一过程常需要耗时超过半年,严重影响项目的开展进度。2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审批制度改革鼓励药品医疗器械创新的意见》[2](以下简称《意见》)。《意见》明确指出,要完善伦理委员会机制、提高伦理审查效率。同年10月23日,食品药品监督管理局发布的《药品注册管理办法(修订稿)》[3]中也提到,多中心临床试验认可组长单位或区域伦理批准。笔者在本文中对本机构提高伦理审查效率和质量的方法,完全备案制方式可能存在的问题及提高多中心临床研究伦理审查效率和质量的途径三方面进行研究,以希望提高伦理审查的效率和质量。
1 我中心提高伦理审查效率和质量的方法
我中心伦理委员会既往标准操作规程中规定,对于多中心临床研究均需要独立会议审查,不接受中心伦理批件。这种方式审查效率极低,上述新规出台后,伦理委员会办公室积极响应,结合自身实际,从以下几个方面修订标准操作规程,以提高伦理审查的效率。
1.1 建立多样化的审查方式
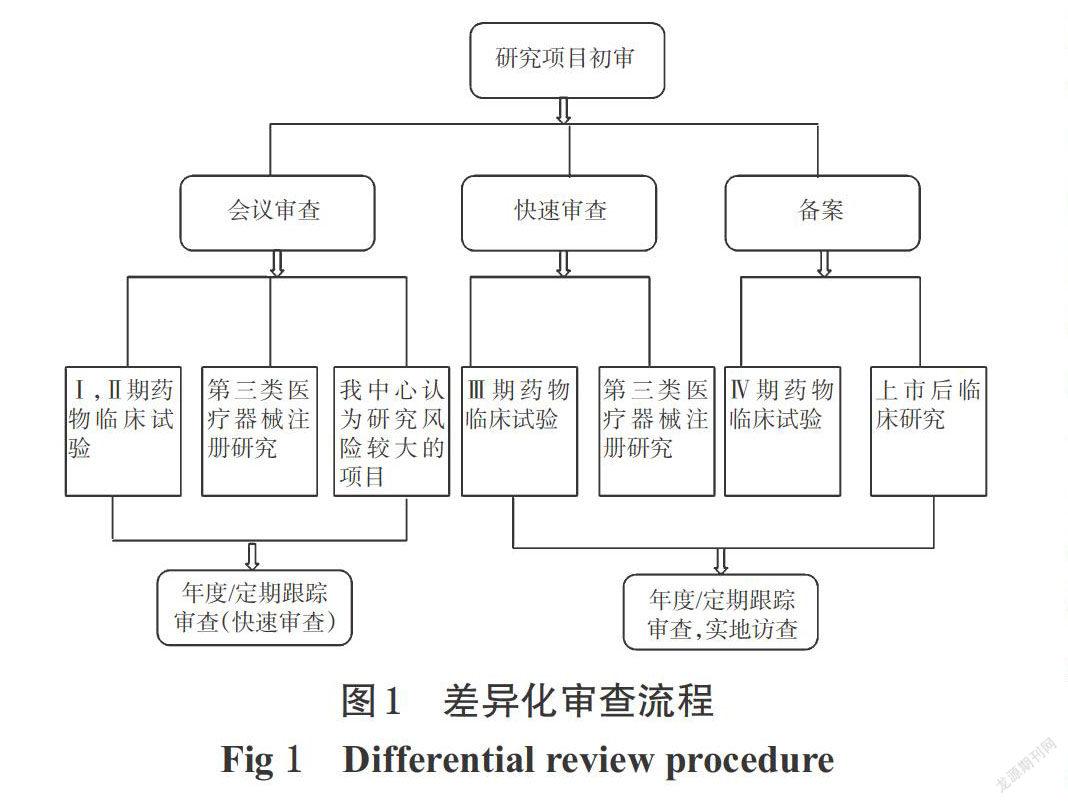
单一会议审查常规情况下属于定期会议,不能满足大量项目同时进行初始审查,极易造成审查项目积压。所以我院将初始审查的审查方式由单一会议审查调整为会议审查、快速审查和备案制:(1)会议审查。属于定期会议,需要满足法定到会人数,且每次审查项目数量有限。 (2)快速审查。由两名委员进行审查,如意见一致,则下发批件;若意见不一致,则需要转为会议审查。 (3)备案制。认可组长单位批件,不再重复审查,直接签发批件。
1.2 对项目进行分级管理及差异化审查流程
伦理办公室根据研究性质和风险程度对项目进行分类,以此来选择不同的审查方式,这样可以满足不同研究项目的审查需要,缩短等待审查的时间,待审项目能得到及时的受理和审查。
同时为进一步保证研究的伦理规范性,对于初审采用快速审查或备案制的研究项目,缩短跟踪审查频率,每6个月进行一次本中心进展情况的审查,必要时采取实地访查的方式。差异化审查流程见图1。
1.3 规定备案制操作细则
因备案制为新增的审查方式,修订后的标准操作规程对其操作流程进行了以下规定:(1)办公室秘书进行仔细的形式审查,对项目类别、研究药物及器械分类、组长单位批件及批准的文件一一进行审核,确保所递交的材料与组长单位伦理批件批准的文件一致。(2)如有针对本单位的个性化材料,可单独送审,由委员进行快速审查。(3)形式审查通过的项目,符合备案要求的,填写备案申请表,伦理秘书递主任委员审核确认,若同意,则附審查批件。
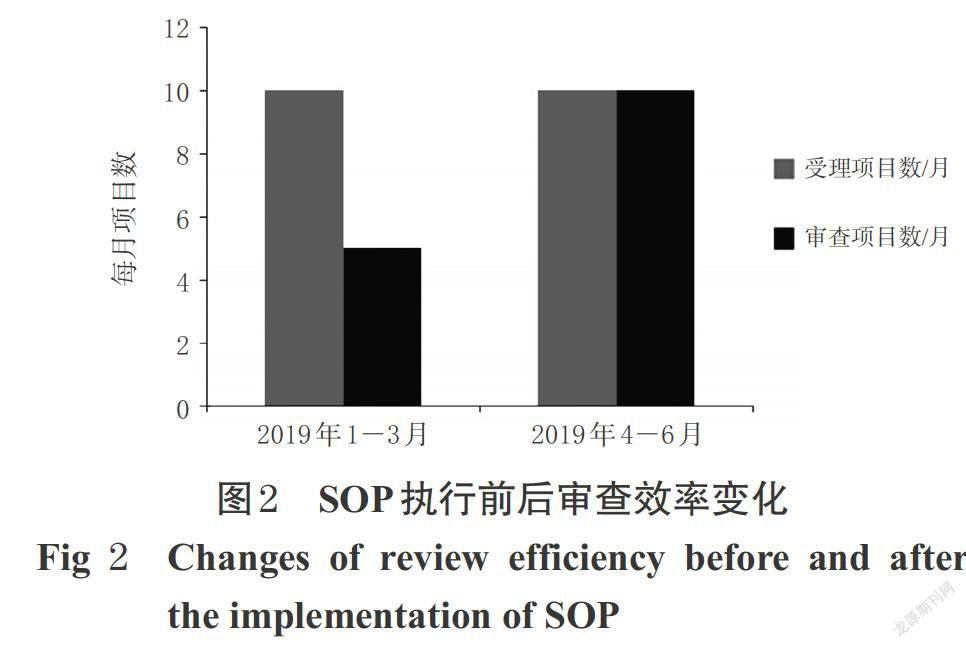
自2019年4月修订后的本中心伦理委员会《标准操作规程》(SOP)执行以来,我中心初始审查的效率提高了一倍,同时跟踪审查和实地访查的次数有所增加,实地访查的次数由既往的每半年一次,增加至每3个月一次。由此可见,我中心的分级管理、差异化审查方式可在保证审查质量的情况下,提高伦理审查效率。SOP执行前后审查效率变化见图2。
2 完全备案制方式可能存在的问题
我中心伦理委员会在探索过程中,认为完全备案制会存在如下问题。
2.1 组长单位伦理审查质量难以评估
目前由于缺乏官方的评估认证标准,国内各机构伦理委员会的资质无从考量。我国医学伦理领域第一家也是唯一一家经国务院批准的官方认证机构就是针对中医药领域的世界中医药学会联合会(WFCMS),其开展的认证也是我国医学伦理领域唯一的国家认证项目。认证对象是“开展涉及人的中医药研究的组织机构”[4],而在化学药领域,国内尚无任何官方认证机构。此外,大部分伦理委员会的伦理审查流程和标准尚未统一,虽然部分伦理委员会已通过国际认证,如发展伦理委员会审查能力的战略行动(WHO/SIDCER)、美国人体研究保护项目认证协会(AAHRPP)等,规范程度较高,但这类高水平的伦理委员会仍是少数[5]。
2.2 各中心研究资质及条件不一
2010年11月,国家食品药品监督管理局在发布的《药物临床试验伦理审查工作指导原则》[6]中指出,多中心临床研究,各分中心伦理委员会需审查本中心的研究资质及研究条件是否满足试验要求,特别是研究风险较大的项目,如前期研究发生多例严重不良事件、研究对象为危重症患者,由于各中心研究资质及条件不一样,完全不进行初始审查,直接备案,难以保证研究开展的质量。
3 提高多中心临床研究伦理审查效率和质量的途径
我中心在探索提高伦理审查质量和效率的过程中,思考总结了以下方法。
3.1 提高中心伦理的审查质量
组长单位高质量的伦理审查是参加单位不再重复审查的重要前提,这是受试者安全与权益能得到保护的关键。接受组长单位伦理审查结论,将不会再有其他伦理委员会去发现问题并进行补救,那么将对组长单位伦理审查提出更高的要求。如果组长单位伦理委员会审查质量不过关,所有参加单位的试验受试者都将面临权益与安全保护的问题。中国临床研究能力提升与受试者保护高峰论坛(CCHRPP)《临床研究伦理协作审查共识( 试行版) 》[7]提出了“主审伦理委员会”的概念,并对“主审伦理委员会”的资格进行了规定。也就是说,承担多中心临床试验主要伦理审查职责的伦理委员会必须满足相应的资格要求。组长单位伦理委员会不会自然而然就成为主审伦理委员会,而是要满足相应资格要求才能成为令各参加单位信服的主审伦理委员会,这样受试者的安全权益才能得到保证[8]。
故为提高中心伦理的审查质量,可推行设立国家级的伦理认证机构,建立涵盖全部中西医院的认证分级机制。通过认证的机构伦理委员会才可担任中心伦理的职责。并且相关部门应制订出符合我国国情的中心伦理审查具体操作指南,将中心伦理的审查要点、标准、流程等统一规定。这样各分中心也可评估中心伦理审查质量,从而在本中心采取适宜的审查方式[9]。
3.2 建立并加强各中心伦理委员会间的沟通与互认
3.2.1 建立各中心伦理委员会间的沟通机制 中心伦理与分中心伦理审查,缺一不可。应明确职责划分,加强沟通交流,增强协作意识。与中心伦理建立相互合作的“有审有备有沟通”的机制。可采取各中心伦理委员会联合建立工作微信群、定期举办年会等方式[10]。
3.2.2 设立主审伦理委员会+副审伦理委员会制 由主审伦理委员会负责对多中心临床研究项目的科学与伦理合理性承担主要审查职责[11],确保审查全面充分高质量,参加单位的伦理委员会承担副审伦理委员会职责,即在主审伦理委员会审查意见基础上,侧重对研究在本机构的可行性以及知情同意书的本地化要求等进行审查。如分中心可以对知情同意书审查并作出“本土化”的要求[12],以适应本地的受试者阅读和理解,同时分中心对项目进展过程中的严重不良事件、方案违背、年度定期跟踪审查、修正案等均需进行重点审查,对于本中心临床研究实施全过程进行严格的伦理监管,才可保证临床研究的伦理审查质量。
3.2.3 伦理审查互认 推行建立伦理审查结果互认制度,制定按照疾病分类的伦理审查标准和操作细则,在全国统一执行,实现伦理审查任务分流。例如北京友谊医院与北京佑安医院、北京地坛医院联合,开展了基于消化、肝病学科的伦理协作审查和互认试点的签约,省去了不必要的重复审批,节省了临床试验的时间[13]。
3.3 实行伦理委员会秘书初审制
对于实行“备案制”的项目,不能只是签收备案,伦理秘书收到材料后,应加倍仔细进行形式审查,如我中心伦理秘书对于送审材料与中心伦理批件均一一核对,同时针对本单位的相关材料还需及时送审。伦理办公室在对研究风险评估等没有充分把握时,还需聘请相关专业的独立顾问。
所以秘书的工作能力也是伦理委员会工作质量的关键要素之一。应加强对伦理委员会秘书的培训,提高岗位胜任力。培训内容可以结合现行法规指南,以及临床研究的设计、伦理审查的程序、受试者保护、知情同意书要点等多方面,同时卫生行政部门可提供针对伦理秘书的强制性继续教育课程,设定定期考核机制等方式[14],进一步提高秘书的伦理形式审查的能力,尤其对送审资料是否具有重大伦理问题的辨别力,正确判断能否签收该项目资料,以及如何对研究项目采取合适的审查方式,做好备审工作的把关人。
多中心临床研究是目前临床试验的常态,如何将《意见》落地,提高伦理审查效率,并保证伦理审查质量,是国内研究机构开展多中心临床试验的共同要求,本单位对此的实践仅在初始阶段,有待随着实践发展进一步深入。政府监管部门可建立与完善伦理委员会认证制,各研究单位可以积极探索,结合自身实际,借鉴国内外先进做法,通过制定个性化的备案制度、建立多种形式的伦理协作审查模式、加强自身伦理审查制度建设等方式,实现效率与质量的平衡。
參考文献
[ 1 ] 国家食品药品监督管理局.药物临床试验质量管理规范[S]. 2003-09-01.
[ 2 ] 中共中央办公厅,国务院办公厅.关于深化审评审批制度改革鼓励药品医疗器械创新的意见[S]. 2017-10-08.
[ 3 ] 国家食品药品监督管理局.药品注册管理办法(修订版)[S]. 2017-10-23.
[ 4 ] 马长永,马晓,徐辉.关于建立我国伦理审查委员会认证制度的展望与思考[J].中国医学伦理学,2016,29(1):10-13.
[ 5 ] U.S Food and Drug Administration. Guidance for industry using a centralized IRB review process in multicenter clinical trials[EB/OL].[2017-12-02].http://www.fda.gov/RegulatoryInformation/Guidances/ucm127004.htm.
[ 6 ] 国家食品药品监督管理局.药物临床试验伦理审查工作指导原则[S]. 2010-11-08.
[ 7 ] 中国临床研究能力提升与受试者保护高峰论坛(CCHRPP)临床研究伦理协作审查共识(试行版)[EB/OL].[2019- 05-20].http://www.sohu.com/a/213407638_776163.
[ 8 ] 周吉银,刘丹,曾圣雅,等.我国多中心临床试验组长单位伦理审查制度的挑战[J].中国医学伦理学,2018,31(9):1157-1161.
[ 9 ] 严晋,刘瑜钟,筱华,等.效率与质量的平衡:构建多中心临床试验伦理审查协调体系与平台的设想[J].中国新药与临床杂志,2017,36(10):586-592.
[10] 陆麒,姜柏生.区域伦理委员会的定位、职能与发展[J]. 医学与哲学,2018,39(12A):1-5.
[11] 柳正植,崔英子,齐彩缤,等.多中心药物临床试验中牵头单位的职责[J].长春中医药大学学报,2016,32(4):844- 846.
[12] 王艳桥,乔洁,陆麒,等.国内多中心临床试验的中心伦理审查模式初探[J].医学与哲学,2016,37(3A):28-31,35.
[13] 黄旭,汪秀琴.关于多中心临床试验伦理协作审查的思考[J].中国新药杂志,2018,27(11):1290-1293.
[14] 李浩,孔德香.我院伦理委员会工作现状分析及对策探讨[J].中国医疗管理科学,2018,8(5):27-30.
(收稿日期:2019-06-29 修回日期:2019-10-18)
(编辑:刘明伟)
