基于钌(Ⅱ)多吡啶配合物[Ru(bpy)2(dppz)]2+的单链DNA分子光开关性能
2019-09-05宋伟涂小宝祁慧晨徐加发田丹碧
宋伟 涂小宝 祁慧晨 徐加发 田丹碧

摘要:在合成DNA的熒光探针[Ru(bpy)2dppz]2+(RuBD)的过程中,初步发现了其特别的分子光开关特性,不仅取决于双链DNA(dsDNA)还取决于单链DNA(ssDNA)。当RuBD与水溶液中的DNA酶结合时,荧光强度在dsDNA / RuBD和ssDNA / RuBD之间显示出明显的差异。此外在实验中,发现ssDNA / RuBD比dsDNA / RUDB的荧光更强,故我们采用荧光光谱,荧光显微镜和电化学法等方法,进一步研究RuBD与ssDNA的性质。
关键词:钌(Ⅱ)多吡啶配合物;分子光开关;单链DNA(ssDNA);双链DNA(dsDNA)
虽然钌(Ⅱ)多吡啶配合物 [Ru(bpy)2(dppz)]2+作为核酸的光谱探针已有二十多年的历史,其独特的性质在生物化学、细胞生物学、诊断和治疗方面的应用前景直到最近才受到重视[1-5]。作为体外和离体的理想探针,它已被用于实时跟踪技术,该技术使用荧光显微镜监测活细胞中的单个病毒组分或DNA序列,因为它们具有强烈的双链DNA(dsDNA)结合亲和力,低背景辐射、长寿命光开关效应和红移发射[6-9]。
RuBD的光开关效应普遍认为归因于dsDNA碱基之间高度平面dppz配体的插入[1,10-13],使得条带研究和应用仅涉及dsDNA。单链DNA (ssDNA)的光开关效应似乎被忽略,对它的研究很少。
在设计以RuBD为荧光探针的Pb2+荧光传感器过程中,我们首先发现RuBD的光开关效应不仅依赖于与dsDNA的结合,还依赖于与ssDNA的结合。我们进一步采用荧光光谱法、荧光显微镜等,研究ssDNA对RuBD的性质。我们希望我们的发现有助于更清楚地呈现RuBD DNA的结合机制,对其未来的生物应用提供新思维,RuBD在新型诊断剂方面具有重要应用价值,此类诊断剂不仅适用于双链DNA /单链DNA,以及用于核酸位点和结构的通用治疗[14-18]和生物化学探针设计[19-21]。
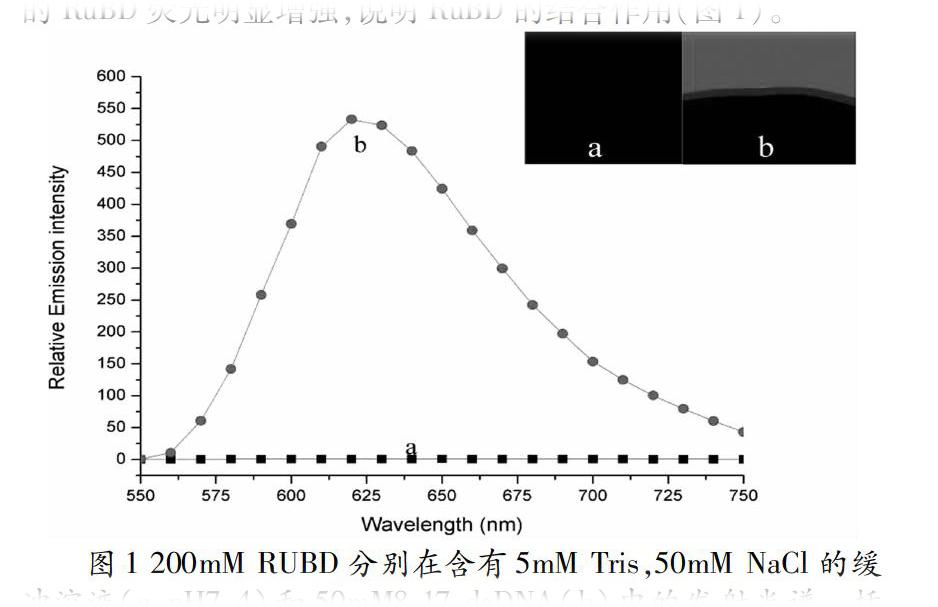
[Ru(bpy)2(dppz)](BF4)2 的合成遵循文献[22,23],采用荧光光谱法研究RuBD的结合性能。结果表明,与双链DNA结合的RuBD荧光明显增强,说明RuBD的结合作用(图1)。
我们在脱氧核酶(DNAzyme)裂解反应中发现了RuBD的特殊性质,它可以在ssDNA存在时产生显着的荧光效应,这一特性这已被应用于制备Pb2+ 生物传感器 [24]。
8-17 ssDNA,是一种对Pb2+有特异性催化作用的单链DNA分子。这种DNA分子生产成本低,可多次变性和复性且不丧失活性或结合能力,特别是其催化链可以借助Pb2+,催化底物链的裂解[25,26]。
在我们最初的设计策略中,仅仅基于RuBD与dsDNA的结合能力,故选用RuBD作为荧光探针。但在试验过程中,结果超出了我们的预期。
荧光光谱可以发下RuBD在5mM Tris缓冲溶液中具有可忽略的荧光(图2,粉红色三角形点)。当RuBD与8-17 dsDNA溶液混合时,荧光强烈发射(红色圆点),证明了RuBD典型的光开关特性。通过添加Pb2+,8-17 dsDNA核酶水解成8-17 ssDNA和一些底物片段。如果RuBD的光开关效应仅取决于dsDNA的插入,那么含有8-17 ssDNA和信号链底物片段的混合液的荧光强度将降低或检测不到。但令人惊讶的是,该混合溶液的荧光强度显著增强(~75%)(黑色四角点)。
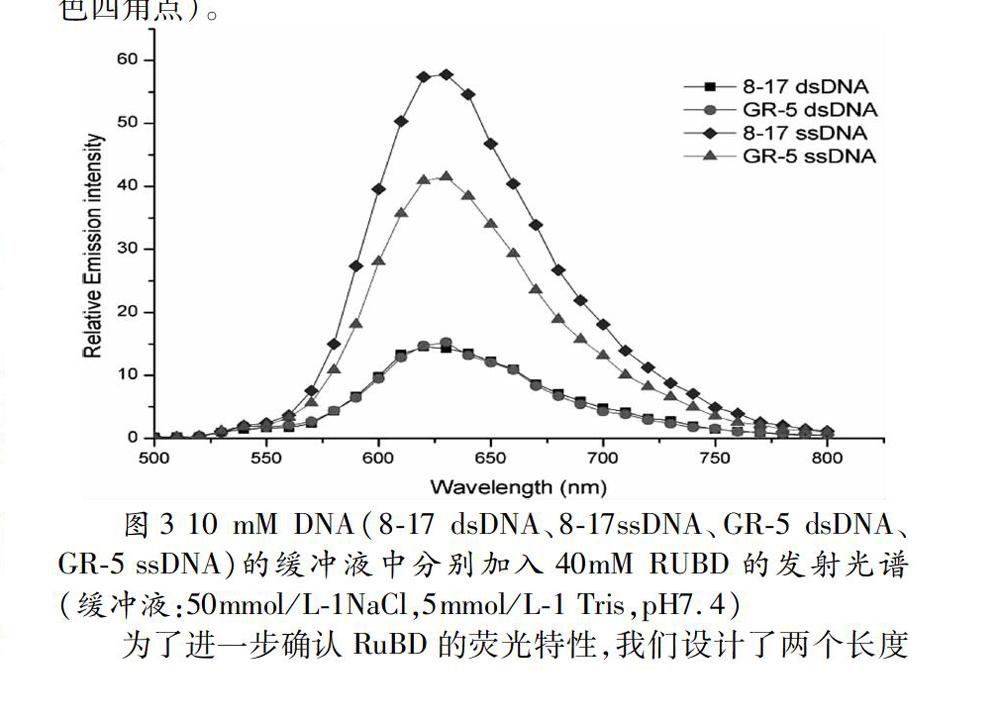
用一种特殊设计的GR-5 DNA核酶进行DNA的裂解反应,其性能与8-17 DNA核酶相似。发现该溶液的荧光强度也增大,说明RuBD与双链DNA可以产生较强荧光,也可以与单链DNA产生较强荧光。为了验证RuBD的分子荧光开关性能,我们分别使用DNA dsDNA和ssDNA溶液(8-17 dsDNA和8-17ssDNA,GR-5 dsDNA和GR-5 ssDNA)测试荧光强度。 通过向溶液中添加等量的RuBD,产生的荧光强度如图3,由此我们发现,ssDNA / RuBD的荧光强度增强尤其显著,约增强250%(GR-5 ssDNA/RuBD,绿色三角形点)和300%(8-17ssDNA/ RuBD,蓝色四角点)。
为了进一步确认RuBD的荧光特性,我们设计了两个长度相同但结构不同的DNA,其中一个(DNA/H)呈发夹状,另一个(DNA/S)呈直线状。图4显示,在相同条件下,RuBD与DNA/S结合产生的荧光强度强于DNA/H,且与荧光显微镜图像结果一致。 与DNA/H相比,RuBD与单链DNA/S结合产生更强更显著的荧光特性。
RuBD可能通过静电作用与ssDNA结合,尽管联吡啶配体部分插入的可能性不能完全消除[28-31]。我们采用循环伏安法(CV)进一步考察。通过巯基-金的相互作用,将5'末端具有硫醇的ssDNA固定在工作电极金电极表面。将ssDNA修饰的电极在封闭试剂MCH溶液中进一步孵育,以获得良好排列的DNA单层,防止RuBD进入电极表面。分别在缓冲液(a)和RuBD溶液(b)中对修饰电极进行循环扫描,在RuBD溶液中电流峰值明显增强(见图5)。采用计时库仑法进行实验,也具有一致的结果。由于RuBD的静电吸附,峰值电流可归因于表面受限的氧化还原过程,证明了我们先前假设的吸附作用(图6)。
综上所述,钌(Ⅱ)多吡啶配合物(RuBD)不仅可以插入dsDNA,还可以插入ssDNA,值得引起我们关注的是,其和ssDNA作用时产生的荧光强度远远大于dsDNA。我们希望关于RuBD的分子光开关特性能引起科学界的关注,其在化学传感、生物传感、生物示踪、荧光成像、超分辨成像等领域表现出极大的潜在应用价值,值得进一步研究开发。
参考文献:
[1]Erkkila, K. E.; Odom, D. T.; Barton, J. K. Recognition and reaction of metallointercalators with DNA. Chem. Rev. 1999, 99, 2777-2796.
[2]Friedman, A. E.; Chambron, J. C.; Sauvage, J. P.; Turro, N. J.; Barton, J. K.A molecular light switch for DNA: Ru(bpy)2(dppz)2+. J. Am. Chem. Soc. 1990, 112, 4960-4962.
[3]Puckett, C. A.; Ernst, R. J.; Barton, J. K. Exploring the cellular accumulation of metal complexes. Dalton Trans. 2010, 39, 1159-1170.
[4]Brandenburg B.; Zhuang, X. W. Virus trafficking-learning from single-virus tracking. Nature Reviews Microbiology. 2007, 5, 197-208.
[5]Cook, N. P.; Torres, V.; Jain, D. Martí, A. A.Sensing amyloid-β aggregation using luminescent dipyridophenazine ruthenium(II) complexes. J. Am. Chem. Soc. 2011, 133, 11121-11123.
[6]Novakova, O.; Kasparkova, J.; Vrana, O.Correlation between Cytotoxicity and DNA Binding of Polypyridyl Ruthenium Complexes. Biochem. 1995, 34, 12369-12378.
[7]Kelly J. M.; Tossi, A. B.; McConnell, D. J. A study of the interactions of some polypyridylruthenium(II) complexes with DNA using fluorescence spectroscopy, topoisomerisation and thermal denaturation. Nucleic Acids Res. 1985, 13, 6017-6034.
[8]Liang, Q.; Eason, P. D.; Long. E. C. Metallopeptide-DNA Interactions: Site-Selectivity Based on Amino Acid Composition and Chirality. J. Am. Chem. Soc. 1995, 117, 9625-9631.
[9]Franklin, C.A.; Fry J. V.; Collins, J. G. Comparative Analysis of [Au(en)2]3+ and [Pt(en)2]2+ non Covalent Binding to Calf Thymus DNA. Inorg. Chem. 1996, 35, 7541-7545.
[10]Metcalfe, C.; Thomas, J. A. Kinetically inert transition metal complexes that reversibly bind to DNA.Chem. Soc. Rev. 2003, 32, 215-224.
[11]Ji, L. N.; Zou, X. H.; Liu, J. G. Shape-and enantioselective interaction of Ru(Ⅱ)/Co(Ⅲ) polypyridyl complexes with DNA. Coord. Chem. Rev. 2001, 216, 513-536.
[12]Lim, M. H.; Song, H.; Olmon, E. D. Sensitivity of Ru(bpy)2dppz2+Luminescence to DNA Defects. Inorg. Chem. 2009, 48, 5392-5397.
[13]Kumar, C.V.; Barton, J. K.; Turro, N. J.Interactions of polypyridyl cobalt complexes with DNA studied by rotating electrode methods. J. Am. Chem. Soc. 1985, 107, 5518-5523.
[14]Shi, S.; Geng, X. T.; Zhao, J.; Yao T. M.; Wang, C. R.; Yang, D.J.; Zheng, L. F.; Ji, L. G. Interaction of [Ru(bpy)2(dppz)]2+ with human telomeric DNA: Preferential binding to G-quadruplexes over i-motif. Biochimie. 2010, 92, 370-377.
[15]Shao, J. Y.; Sun, T.; Guo, Q. Y. In situ electrochemically tuned photoluminescence of [Ru(bpy)2(dppz)]2+aggregates with single-walled carbon nanotubes and DNA monitored by guanine oxidation. Transition Metal Chemistry. 2011, 36, 499-504.
[16]Liang, M. M.; Jia, S. P.; Zhu, S. C.Photoelectrochemical sensor for the rapid detection of in situ DNA damage induced by enzyme-catalyzed Fenton reaction. Environmental Science & Technology. 2008, 42, 635-639.
[17]Rüba, E.; Hart, J. R.; Barton, J. K.[Ru(bpy)2(L)]Cl2: Luminescent Metal Complexes That Bind DNA Base Mismatches. Inorg. Chem. 2004, 43, 4570-4578
[18]Wong, E.; Giandomenico, C. M. Soluble Single-Walled Carbon Nanotubes as Longboat Delivery Systems for Platinum(IV) Anticancer Drug Design. Chem. Rev. 1999, 99, 2451-2466.
[19]O'Connor, M. B.; Killard, A. J.; O'Kennedy, R. J. Production and characterization of a polyclonal antibody for Os(II) and Ru(II) polypyridyl complexes. Inorg. Biochem. 2006, 100, 1252-1259.
[20]Hu, L. Z.; Bian, Z.; Li, H. J.; Han, S.; Yuan, Y. L.; Gao, L. X.; Xu, G. B. [Ru(bpy)2dppz]2+ electrochemiluminescence switch and its applications for DNA interaction study and label-free ATP aptasensor. Anal. Chem. 2009, 81, 9807-9811.
[21]Zhou, P.; Zheng, Z. H.; Lu, W. Multicolor Labeling of Living-Virus Particles in Live Cells. Angew. Chem. Int. Ed. 2012, 51, 670-674.
[22]Amouyal, E.; Homsl, A.; Chambron, J. C.; Sauvage, J. P. ChemInform Abstract: Synthesis and Study of a Mixed-Ligand Ruthenium(II) Complex in Its Ground and Excited States: Bis(2,2-bipyridine)(dipyrido(3,2-a:2,3-c)phenazine-N4N5) ruthenium(II). J. Chem. Soc. Dalton Trans. 1990, 6, 1841-1845.
[23]Ackermann, M. N.; Interrante, L. V. Ruthenium(II) complexes of modified 1,10-phenanthrolines. 1. Synthesis and properties of complexes containing dipyridophenazines and a dicyanomethylene-substituted 1,10-phenanthroline. Inorg. Chem. 1984, 23, 3904-3911.
[24]Yang, X. R.; Xu, J.; Tang, X. M.; Liu, H. X.; Tian, D. B.A novel electrochemical DNAzyme sensor for the amplified detection of Pb2+ ions. Chem. Commum. 2010, 46, 3107-3109.
[25]Li, J.; Lu, Y. A Highly Sensitive and Selective Catalytic DNA Biosensor for Lead Ions. J. Am. Chem. Soc. 2000, 122, 10466-10467.
[26]Lu, Y. New Transition-Metal-Dependent DNAzymes as Efficient Endonucleases and as Selective Metal Biosensors.Chem.Eur. J. 2002,8,4588-4596.
