pH响应型纳米载体在肿瘤靶向药物递送系统中的应用
2019-09-05崔斯雯王东凯
姜 瑶,崔斯雯,王东凯
pH响应型纳米载体在肿瘤靶向药物递送系统中的应用
姜 瑶,崔斯雯,王东凯*
(沈阳药科大学 药学院,辽宁沈阳 110016)
综述基于聚合物胶束、聚合物囊泡、介孔二氧化硅纳米粒、脂质体作为pH响应型纳米载体在肿瘤靶向药物递送系统中的研究进展,以期为后续研究提供参考。以“pH响应型”“药物递送系统”“靶向治疗”等为关键词,组合查询了在PubMed、Elsevier、SpringerLink、中国知网、万方、维普等数据库中的相关文献,并对其中的30篇中外文献进行归纳、分析、总结。pH响应型纳米载体是一类能够根据外界pH的变化而改变自身物理化学性质的功能性聚合物,从而达到靶向控释药物。近年来,由于其独特的刺激响应功能,在药物递送、疾病诊断及生物医学成像等方面有广泛的应用。pH响应型纳米载体在肿瘤靶向药物递送系统中有着广阔的应用前景。
药剂学;药物递送系统;综述;纳米载体;pH响应型;肿瘤治疗
随着纳米技术和纳米材料的改进,将纳米载体用于肿瘤靶向药物递送系统已经取得了很大的进展。纳米药物递送系统具有缓控释、提高药物溶解性和渗透性、靶向性等优势,但同时也出现一些不足。例如某些纳米药物在到达靶部位前释放药物,或者在靶部位不能及时或按一定速率释放药物,使非靶部位血药浓度增大,生物利用度降低[1]。因此为了实现抗肿瘤药物在肿瘤部位的选择性释放,智能刺激响应型材料作为药物递送载体引起了研究者的极大兴趣,也逐渐有了很大进展。刺激响应型药物递送系统,是一种功能性药物递送系统,通常在某些特定刺激下释放药物。这些刺激可以是内源性刺激也可以是外源性刺激,包括物理刺激(光、声、热)、化学刺激(pH、氧化还原、电荷反转)和生物刺激(酶、核酸、生物分子)等。在这个递送系统中,载有药物分子的纳米载体作为“门卫”( gatekeepers)阻止药物分子从孔道中释放,只有在一定的外界环境刺激下,“门卫”才能被移除,从而使药物释放出来[2]。本文作者将重点探讨pH响应型纳米载体,按照纳米载体种类的不同,结合实例对其设计原理和构建方法进行综述。
1 pH响应型纳米载体的构建依据
人体正常组织和血液的 pH值在7.4左右,而肿瘤组织的细胞外环境呈现弱酸性(pH值6.5~7.2)。在肿瘤细胞内,溶酶体和内涵体的pH进一步降低(pH值4.0~6.0),这种微酸环境为纳米载体研制提供了新的策略(图1)[3-4]。利用肿瘤组织相对于正常组织具有较低pH值的这个特点,可实现肿瘤部位的深层穿透,将药物运送到靶部位,使药物在肿瘤部位蓄积从而释放。在肿瘤微酸环境下,pH响应性化学键断裂或使电荷解离等方式,暴露出“激活”状态的药物载体或者药物分子,可增强肿瘤细胞对抗癌药物的摄取,从而提高抗肿瘤效果。目前设计pH响应型载体一般有2种方法:一种方法是利用含有pH敏感基团构建载体如羧基和氨基等,这些基团根据在不同pH环境下质子化或去质子化导致聚合物分子解离程度的改变,从而导致聚合物链水溶性发生明显转变,使药物释放;另一种方式是利用pH敏感化学键构建载体如括腙键、缩醛键、酯键、配位键等,这些不稳定的化学键在生理条件下稳定,然而在肿瘤微酸环境下,化学键可发生断裂,使药物得到释放[5]。
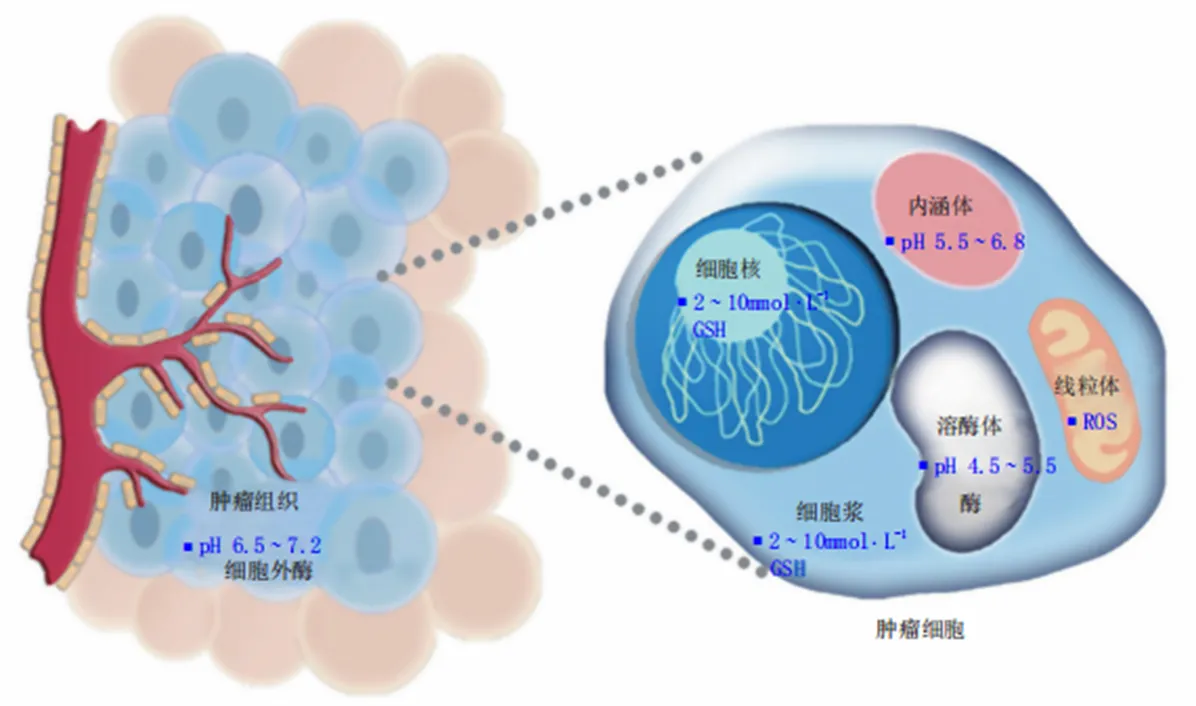
Fig. 1 Bio-signals in tumor microenvironments
2 不同种类的pH响应型纳米载体
2.1 聚合物胶束
聚合物胶束(polymeric micelles)是球形胶体颗粒,其尺寸通常为10~100 nm,由不同疏水或亲水的两亲共聚物组成。聚合物胶束由于其生物相容性、肿瘤靶向性以及具有优异的物理化学性质、载药量和释放性能等优势引起研究者们极大关注[6]。在生物医学领域,特别是作为药物载体,被广泛应用于药物递送和癌症治疗。它们可以通过改造进一步提高生物利用度、延长循环时间和增强抗癌活性。
聚合物的pH敏感性主要来自两个方面,一是可电离基团的质子化,二是pH敏感性连接键的降解。因此可以将可电离基团结合到聚合物胶束中,使其在肿瘤细胞外或细胞酸性环境下电离,之后药物便实现了靶向释放。Hu等[7]利用聚硫二甲氧嘧啶(PSDM)和聚(组氨酸)-聚乙烯亚胺两亲聚合物构建了一种阳离子胶束,将血液环境下带负电的聚磺胺地托辛-聚乙二醇静电结合到该胶束系统中,包裹抗肿瘤药物紫杉醇,以实现pH响应的释药功能。
另一种赋予聚合物胶束pH敏感性的方法是在较低pH环境下pH敏感性连接键的降解。Zhou等[8]开发了一种基于-(2-羟丙基)甲基丙烯酰胺(HPMA)共聚物自组装的胶束药物递送系统,通过pH敏感的腙键将疏水性药物多柔比星和疏水性-谷甾醇缀合到亲水性HPMA聚合物主链上来合成两亲性缀合物。结果表明该交联聚合物胶束稳定性好,渗透性显著增强,从而增加药物在肿瘤细胞中的累积。
2.2 聚合物囊泡
聚合物囊泡(polymersome)是由多种亲水或疏水嵌段自组装而成的两亲嵌段共聚物。嵌段共聚物,又称镶嵌共聚物,通常是由两个或两个以上性质不同的聚合物链段连接而成的一种特殊共聚物[9]。图2为聚合物囊泡的结构示意图。
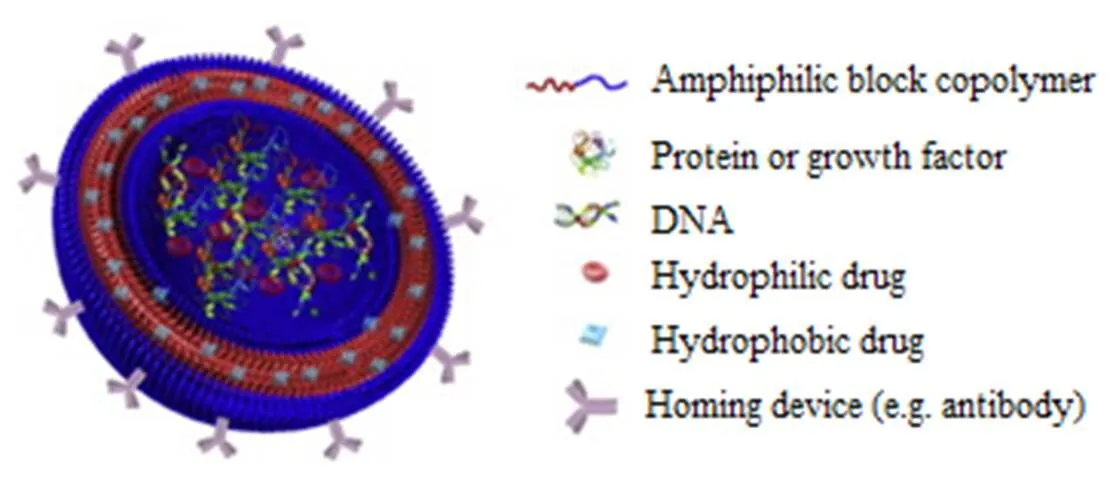
Fig. 2 The structure of polymersome
与脂质体相比,聚合物囊泡囊膜表面的疏水核心要大于常规的磷脂膜,因此它的储存能力更好、稳定性更高。此外,嵌段共聚物的性质可以根据需求通过聚合物合成来改造,绝大多数由合成共聚物制成的囊泡都具有致密的聚环氧乙烷(PEO)外壳,这使得它们具有“隐形”特征,因此其体内相容性可能会更好且能延长药物循环时间[10]。近年来,聚合物囊泡在药物递送、生物医学成像以及疾病诊断等各方面具有很大吸引力[11]。
正常人体组织环境的pH值约为7.4,肿瘤细胞和炎症组织的pH值约为6.8,而细胞核内体和溶酶体的pH值约为5.0~6.0,这种pH环境上的差异为pH响应型载体释放药物提供了潜在的触发因素。通常,聚合物囊泡是由嵌段共聚物在pH大于pKa条件下形成的,此时疏水链段的碱性基团基本不带电。当pH值逐渐降低至小于pKa时,疏水链段发生质子化或水解,增加了聚合物的亲水性从而释放药物[12]。Du等[13]通过使用PEG-CPADN(CPADN:4-氰基戊酸二硫代萘甲酸酯)的TTMA和AA单体顺序自由基加成-断裂链转移(RAFT)共聚而成功获得了聚乙二醇-聚三甲氧苯亚甲基三羟甲基丙烯酸酯-聚丙烯酸(PEG-PTTMA-PAA)三嵌段共聚物,再用溶剂交换法制备了聚合物囊泡。研究表明聚合物囊泡中缩醛的水解速率具有高度的pH依赖性。在弱酸环境下观察到缩醛水解显著增强,增加了聚合物的亲水性,进而释放盐酸阿霉素。Du等[14]用生物相容性两性离子共聚物,聚[2-(甲基丙烯酰氧基)乙基磷酸胆碱-嵌段-2-(二异丙基氨基)乙基甲基丙烯酸酯](PMPC-b-PDPA)自组装制备了高度生物相容的pH敏感性二嵌段共聚物囊泡。通过将溶液pH值从2调节至6以上来自发地形成囊泡,疏水性PDPA链形成囊泡壁。将水溶性药物盐酸阿霉素包封入囊泡的亲水内腔中,可达到药物缓释的目的。
2.3 介孔二氧化硅纳米粒
介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSN)由于其不仅具有独特的介孔结构,还拥有可调节的孔径、巨大的比表面积、稳定性和生物相容性强、药物负载能力强等优异性质,成为近几年的研究热点[15]。但由于MSN的孔径开放性,包裹的药物存在释放速度快、半衰期短的问题,极大限制了MSN在肿瘤靶向药物递送系统中的应用。目前,研究者们积极探索通过对MSN表面进行功能性修饰,使其对内源或外源刺激具有响应,从而对药物可控释放[16]。而基于pH响应的介孔二氧化硅纳米粒药物递送载体研究比较广泛。
pH响应型介孔二氧化硅纳米粒的响应机制主要分为两种:一种是基于pH敏感键;另一种是基于pH敏感材料。pH敏感化学键一般指在中性条件下稳定而在弱酸环境下易断裂的化学键,包括腙键、酯键和缩醛键等[17]。将药物通过pH敏感键连接于MSN表面,实现在弱酸环境下的可控释放。Zhang Q等[18]在MSN介孔表面用聚乙二醇(PEG)修饰后,将亚氨基二乙酸(IDA)作为配体接枝在中孔表面上,通过配位键依次螯合铜铁和多柔比星(DOX),并通过体外释放实验证明其 pH 响应释放特性。体内药代动力学实验也表明,与游离DOX相比,载入介孔二氧化硅纳米载体的DOX循环时间更长、血浆清除率更慢。一些具有pH敏感性的无机材料或聚合物也可以用于构建pH响应型MSN,例如聚乙烯吡咯烷酮(PVP)、聚丙烯酸(PAA)磷酸钙、氢氧化物等[19]。这类材料遇酸易溶解从而达到释药目的。Xiao X等[20]在研究中用聚丙烯酸材料修饰MSN表面以降低三氧化二砷的毒性并改善药代动力学参数,实现药物在肿瘤酸性微环境中的释放。Rim等[21]则用磷化钙修饰MSN,在暴露于细胞溶酶体pH时,通过溶解磷化钙从孔中释放客体抗癌药物。
2.4 脂质体
脂质体(liposomes)是一种由磷脂膜组成的人工膜,尺寸可控易于制备,具有靶向性。由于它没有天然毒性而受到广泛探索[22]。众所周知,聚乙二醇化脂质体不易被网状内皮系统(RES)的巨噬细胞吸收,因此在循环中停留相当长的时间。Koren等[23]用核小体特异性单克隆抗体-磷脂偶联物与细胞穿透性TAT肽,引入可降解的pH敏感性腙键,加以癌症特异性mAb 2C5修饰,制备了一种pH敏感的聚乙二醇化长循环脂质体。该载体处于较低pH环境后,特异性TAT肽的位点暴露,从而促进细胞内载体递送多柔比星。这种方法可以潜在地最小化脂质体负载的药物,有效地在肿瘤部位累积并在细胞内递送,具有大大改善抗癌疗法的潜力。Zuo TT等[24]应用精氨酸-甘氨酸-天冬氨酸三肽(RGD)定位到肿瘤组织,包载多烯紫杉醇(DTX),用薄膜分散法成功制备了双靶向pH 敏感脂质体(RGD/DTX-PSL),可以有选择地在低pH水平环境释放药物。
3 多重刺激响应型纳米载体
3.1 pH/温度响应型纳米微球
生物体内正常组织和肿瘤部位之间同时存在 pH值和温度的变化,因此作为刺激响应型的药物载体,pH/温度响应型载体一直是研究的热点。实现pH/温度双重响应的方法可以将pH响应单体和温度响应单体共聚或接枝,也可以制成特殊结构[25]。Fundueanu等[26]基于可生物降解和生物相容性的天然聚合物制备了pH和温度双重敏感纳米微球。首先在酸化水溶液中将普鲁兰与环氧氯丙烷悬浮交联制备普鲁兰多糖微球。为了赋予它们的温度敏感性,通过支链淀粉的-OH基团与琥珀酸酐(SA)反应,将羧基加入到热敏性支链淀粉微球,引入pH敏感单元(-COOH)。支链淀粉微球作为温度控释溶菌酶的基质是不错的选择。该实验结果表明,引入pH敏感单元后的普鲁兰微球较普通普鲁兰微球的亲水性更强,吸水膨胀率大大提高,也解决了生物降解的问题。Li等[27]研究了基于壳聚糖-接枝-聚(-异丙基丙烯酰胺)(CS-g-PNIPAM)具有温度和 pH 双重敏感的自组装离子交联空心球,用于5-氟尿嘧啶的控制释放。研究发现,制备的纳米微球具有环境响应性,通过改变介质的pH值或温度来控制颗粒尺寸。由于交联微球的空心结构大,载药量较大,药物分子间吸引力也很高。研究发现,当温度高或者离子强度大时,由于药物和聚合物之间相互作用的减弱和微球粒径的减小,5-氟尿嘧啶释药速率明显加快。
3.2 pH/氧化还原响应型纳米载体
生物体内存在着多种氧化还原系统,其中硫氧化蛋白/硫氧化蛋白还原酶系统在触发药物释放研究中应用较多。肿瘤组织中存在高浓度的还原型谷胱甘肽,大多数基于氧化还原触发药物释放的载体都具有氧化性的二硫键。二硫键在低还原性正常组织中相当稳定,而在肿瘤环境中的减少导致药物递送系统结构的破坏致使药物释放[28]。
李等[29]合成了通过二硫键与PEG连接的胆固醇改性的聚(-氨基酯)的pH和氧化还原双重响应共聚物。基于该共聚物包载DOX的NP在pH值6.5下显示最大的药物释放。又如,Zhan等[30]制备了三重响应纳米凝胶用于靶向递送多柔比星。这些纳米凝胶对高温(42 ℃)、还原环境(4.0 mmol∙L-1DTT)和低pH值(5.0)有响应。
4 展望
近年来,通过研究肿瘤的微酸环境,利用其独特的pH响应因素在解决药物定位释放、载体靶向性等难题上有很大的进步。但目前此类给药系统的研究多数仍处于实验阶段,还有很多难题有待解决,例如载体的生物相容性、副产物的毒性、刺激响应过程的不可逆性等。随着纳米科技和高分子材料的迅速发展,相信pH响应型纳米载体作为药物载体在不久的将来一定会发挥其巨大的优势,在药物载体领域开辟新的道路。
[1] WANG A Z, LANGER R, FAROKHZAD O C, et al. Nanoparticle delivery of cancer drugs[J]. Annu Rev Med, 2012, 63: 185-198.
[2] 田浩, 赵鹏飞, 郑明彬. 刺激响应型纳米载体在肿瘤诊疗中的研究进展[J]. 生物化学与生物物理进展, 2018, 45(6): 593-600.
[3] DE I R R, AILI D, STEVENS M M. Enzyme-responsive nanoparticles for drug release and diagnostics[J]. Adv Drug Deliv Rev, 2012, 64(11): 967-978.
[4] ZHANG Yu, YIN Shaoping, XU Jianan, et al. Research advances in tumor microenvironment responsive polymeric nano-drug delivery systems[J]. Progress in Pharmaceutical Science, 2018, 42(5): 366-374.
[5] LIU J, HUANG Y, KUMAR A, et al. pH-Sensitive nano-systems fordrug delivery in cancer therapy[J]. Biotechnol Adv, 2014, 32(4): 693-710.
[6] ZHOU Qing, ZHANG Li, YANG Tiehong, et al. Stimuli-responsive polymeric micelles for drug delivery and cancer therapy[J]. International Journal of Nanomedicine, 2018, 13: 2921-2942.
[7] HU J, MIURA S, NA K, et al. pH-responsive and charge shielded cationic micelle of poly (-histidine)-block-short branched PEI for acidic cancer treatment[J]. J Control Release, 2013, 172(1): 69-76.
[8] ZHOU Z, LI L, YANG Y, et al. Tumor targeting by pH-sensitive, biodegradable, cross-linked-(2-hydroxypropyl) methacrylamide copolymer micelles[J]. Biomaterials, 2014, 35(24): 6622-6635.
[9] 柯力援, 石凯. 环境响应型聚质体传递系统的研究进展[J]. 沈阳药科大学学报, 2015, 32(7): 569-575.
[10] LEVINE D H, GHOROGHCHIAN P P, FREUDENBERG J, et al. Polymersomes: A new multi-functional tool for cancer diagnosis and therapy[J]. Methods, 2008 (46): 25-32.
[11] LEE J, JAN Feijen. Polymersomes for drug delivery: Design, formation and characterization[J]. Journal of Controlled Release, 2012, 161: 473-483.
[12] ONACA O, ENEA R, HUGHES D, et al. Stimuli-responsive polymersomes as nanocarriers for drug and gene delivery[J]. Macromol Biosci, 2008, 9(2): 129-139.
[13] DU Yinfeng, CHEN Wei, ZHENG Meng, et al. pH-sensitive degradable chimaeric polymersomes for the intracellularrelease of doxorubicin hydrochloride[J]. Biomaterials, 2012, 33: 7291-7299.
[14] DU Jianzhong, TANG Yiqing, Lewis A. pH-Sensitive vesicles based on a biocompatible zwitterionic diblock- copolymer[J]. J Am Chem Soc, 2005, 127(51): 17982-17983.
[15] YU Yue, TAO Chun, YANG Haiyue. Advances in preparation of mesoporous silica nanoparticlesand its use as different functional drug[J]. Chinese Journal of New Drugs, 2017, 26(16): 1906-1912.
[16] 马博乐, 陈雨晴, 祝星宇. 介孔二氧化硅纳米粒的功能化修饰及其在药物研究中的应用[J].中国药房, 2018, 29(15): 2156-2160.
[17] 崔妍, 汪顺浩, 潘雪婷. 介孔二氧化硅在药物递送系统中的研究进展[J]. 生物加工过程, 2018, 16(1): 50-58.
[18] ZHANG Qing, HAO Yu, ZHAO Dongli, et al. A surface-grafted ligand functionalization strategy for coordinate binding of doxorubicin at surface of PEGylated mesoporous silica nanoparticles: Toward pH-responsive drug delivery[J]. Colloids and Surfaces B: Biointerfaces, 2017, 149: 138-145.
[19] RIM H P, MIN K H, LEE H J, et al. pH-Tunable calcium phosphate covered mesoporous silica nanocontainers for intracellular controlled release of guest drugs[J]. Angew Chem Int Ed Engl, 2011, 50(38): 8853-8857.
[20] XIAO X, LIU Y, GUO M, et al. pH-Triggered sustained release of arsenic trioxide by polyacrylic acid capped mesoporous silica nanoparticles for solid tumor treatmentand[J]. J Biomater Appl, 2016, 31(1): 23-35.
[21] RIM H P, MIN K H, LEE H J, et al. pH-Tunable calcium phosphate covered mesoporous silica nanocontainers for intracellular controlled release of guest drugs[J]. Angew Chem Int Ed, 2011, 50(38): 8853-8857.
[22] LEE Y, THOMPSON D H. Stimuli-responsive liposomes for drug delivery[J]. Wiley Interdisciplinary Rev Nanomed Nanobiotechnol, 2017, 9(6): 232-246.
[23] KOREN E, APTE A, JANI A, et al. Multifunctional PEGylated 2C5-immunoliposomes containing pH-sensitive bonds and TAT peptide for enhanced tumor cell internalization and cytotoxicity[J].J Control Release, 2012, 160(2): 264-273.
[24] ZUO T T, GUAN Y Y, CHANG M L, et al. RGD(Arg-Gly-Asp)internalized docetaxel-loaded pH sensitive liposomes: preparation, characterization and antitumor efficacyand[J]. Colloids and Surfaces B: Biointerfaces, 2016, doi:10.1016/j.colsurfb.2016.07.056.
[25] 张春燕, 张存雪, 王慧云. 多重刺激响应型纳米药物传递系统的研究进展[J]. 中国新药杂志,2013, 22(20): 2383-2387.
[26] FUNDUEANU G, CONSTANTIN M, ASCENZI P. Preparati-onand characterization of pH-and temperature- sensitive pullulanmicro-spheres for controlled release of drugs[J]. Biomaterials, 2008, 29(18): 2767-2775.
[27] LI G, GUO L, WEN Q, et al. Thermo- and pH-sensitive ioniccrossli-nked hollow spheres from chitosan-based graft copolymerfor 5-fluorouracil release[J]. Int J Biol Macromol, 2013, 55: 69-74.
[28] RAZA A, HAYAT U, RASHEED T, et al. Redox-responsive nano-carriers as tumor-targeted drug delivery systems[J]. European Journal of Medicinal Chemistry, 2018, 157: 705-715.
[29] LI J, MA Y J, WANG Y, et al. Dual redox/pH responsive hybrid polymer-lipid composites: synthesis, preparation, characterization and application in drug delivery with enhanced therapeutic efficacy[J]. Chem Eng J, 2018, 341: 450-461.
[30] ZHAN Yuan, Mara G, YI Panpan, et al. Thermo/redox/pH-triplesensitive poly(-isopropylacrylamide-co-acrylic acid) nanogels for anticancer drug delivery[J]. J Mater Chem B, 2015, 3(20): 4221-4230.
Application of pH-responsive nanocarriers in tumor-targeted drug delivery systems
JIANG Yao,CUI Siwen, WANG Dongkai*
(,,110016,)
To review the research progress of several types of pH-responsive nanocarriers based on polymermicelles, polymersome, mesoporous silica nanoparticles and liposomes in tumor-targeted drug delivery systems. Research provides a reference for subsequent research.With the words "pH-sensitive" "drug delivery system" "targeted therapy", etc. as the key words, and the related literatures in the database such as PubMed, Elsevier, Springer Link, China national knowledge internet, Wanfang and Weipu, etc. were combined and searched. 30 Chinese and foreign literatures were then analyzed and summarized.pH-responsive nanocarrierswere a class of functional polymers that could change their physical and chemical properties according to changes in the external pH to achieve targeted controlled drug release. In recent years, due to its unique stimuli-response function, it has a wide range of applications in drug delivery, disease diagnosis and biomedical imaging.pH-responsive nanocarriers have broad application prospects in tumor-targeted drug delivery systems.
pharmaceutics; drug delivery system; review; nanocarriers; pH-sensitive; tumor treatment
2019-02-26
姜瑶(1994-), 女(汉族), 吉林长春人, 硕士研究生, E-mail 1138381627@qq.com;
王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事药物制剂新剂型及缓控释制剂研究, Tel. 024-43520529, E-mail wangdksy@126.com。
R94
A
(2019)05–0209–07
10.14146/j.cnki.cjp.2019.05.007
(本篇责任编辑:赵桂芝)
