清肠利肝方对急性肝衰竭小鼠肝细胞凋亡的影响*
2019-09-05张向颖李红艳李秀惠
张向颖 李红艳 任 锋 李秀惠
1.首都医科大学附属北京佑安医院中西医结合中心(北京, 100000) 2.北京市肝病研究所
急性肝衰竭(ALF)是由炎症介导的肝细胞损伤,并伴随肝细胞凋亡和坏死的临床综合症[1],多由肝炎病毒、应用肝毒性药物和肝脏缺血再灌注损伤等病因引起,在临床上多表现为病情危重、发展迅速、病死率很高,迄今在临床上除肝移植外尚没有特异有效的治疗药物和方法[2]。肝细胞凋亡是ALF早期一种重要的病理学表现,如能抑制肝细胞凋亡,则有望延缓甚至阻断ALF的病情进展[3]。我院院内协定处方清肠利肝方在临床治疗肝衰竭过程中发挥了重要作用,临床疗效较好,前期研究表明清肠利肝方对ALF小鼠具有保护作用,然而这种保护作用是否与其对肝细胞凋亡的抑制作用有关尚不清楚。因此,本研究通过建立D-氨基半乳糖联合脂多糖诱导的急性肝衰竭小鼠模型,进一步探讨清肠利肝方对ALF小鼠肝细胞凋亡的影响,为后续研究和清肠利肝方的推广奠定基础。
1 材料与方法
1.1 实验动物和试剂 健康C57BL/6雄性小鼠,8~12周龄,重量18~25g,购自军事医学科学院,在北京市肝病研究所饲养,实验前12h和实验期间禁食,自由饮水。D-氨基半乳糖(D-GalN),脂多糖(LPS)购自Sigma公司。Cleaved-caspase3和β-actin兔抗鼠单克隆抗体以及辣根过氧化酶(HRP)偶联的羊抗兔多克隆抗体均购自美国Cell Signaling公司;增强化学发光试剂盒购自美国Santa Cruz公司;蛋白定量试剂盒购自美国Bio-Rad公司。末端转移酶介导的缺口末端标记法(TUNEL)染色试剂盒购自美国Roche公司。Caspase3活性检测试剂盒购自碧云天公司。清肠利肝方购自北京康仁堂药业,方剂组成:生地、大黄、厚朴、蒲公英、炽壳。
1.2 动物分组与模型制备 C57BL/6小鼠腹腔注射D-GalN(700 mg/kg)联合LPS(10μg/kg)建立急性肝衰竭模型,清肠利肝方(50mg/kg)在注射D-GalN/LPS之前3d灌胃给药,1次/日。实验分组:正常对照组小鼠给予与模型组和干预组相同剂量、相同处理方式的生理盐水;急性肝衰竭模型组小鼠腹腔注射D-GalN/LPS;清肠利肝方干预组小鼠D-GalN/LPS给药前3d给予清肠利肝方灌胃,1次/日。D-Gal/LPS给药6h后收集小鼠肝脏组织和血清。
1.3 观察指标
1.3.1 生存率观察 从D-GalN/LPS干预小鼠开始计时,精确到小时,观察造模处理后24小时内各组小鼠的生存状态(每组10只小鼠),记录每只小鼠的死亡时间及造模后24小时各组小鼠的存活数。绘制生存曲线,进行生存分析。
1.3.2 肝组织细胞凋亡检测 采用TUNEL染色法,取新鲜肝组织包埋,制备5μm冰冻切片,按照试剂盒说明书进行TUNEL染色。
1.3.3 组织蛋白提取,浓度测定以及蛋白免疫印迹检测 用加入磷酸酶抑制剂和蛋白酶抑制剂的蛋白裂解液匀浆肝组织提取蛋白,8000×g、4℃离心5min,取上清液进行蛋白浓度测定。蛋白免疫印迹操作如下:取组织蛋白上样、电泳、转膜、一抗(1∶1000稀释)孵育,TBST漂洗3次,加入辣根过氧化物酶标记的羊抗兔二抗孵育(1∶2000稀释),TBST漂洗后取等量的ECL发光试剂A液和B液混匀后孵育PVDF膜,压片曝光。
1.3.4 肝组织caspase3活性测定 取肝组织裂解液匀浆裂解,按照试剂盒说明书进行活性检测。
2 结果
2.1 清肠利肝方干预降低ALF小鼠死亡率 模型组小鼠在D-GalN/LPS注射6 h后开始出现死亡,至24 h观察结束时仅存活2只,死亡率为80%;而清肠利肝方干预组小鼠在注射16 h后开始出现死亡,至24 h观察结束时存活7只,死亡率为30%(图1)。
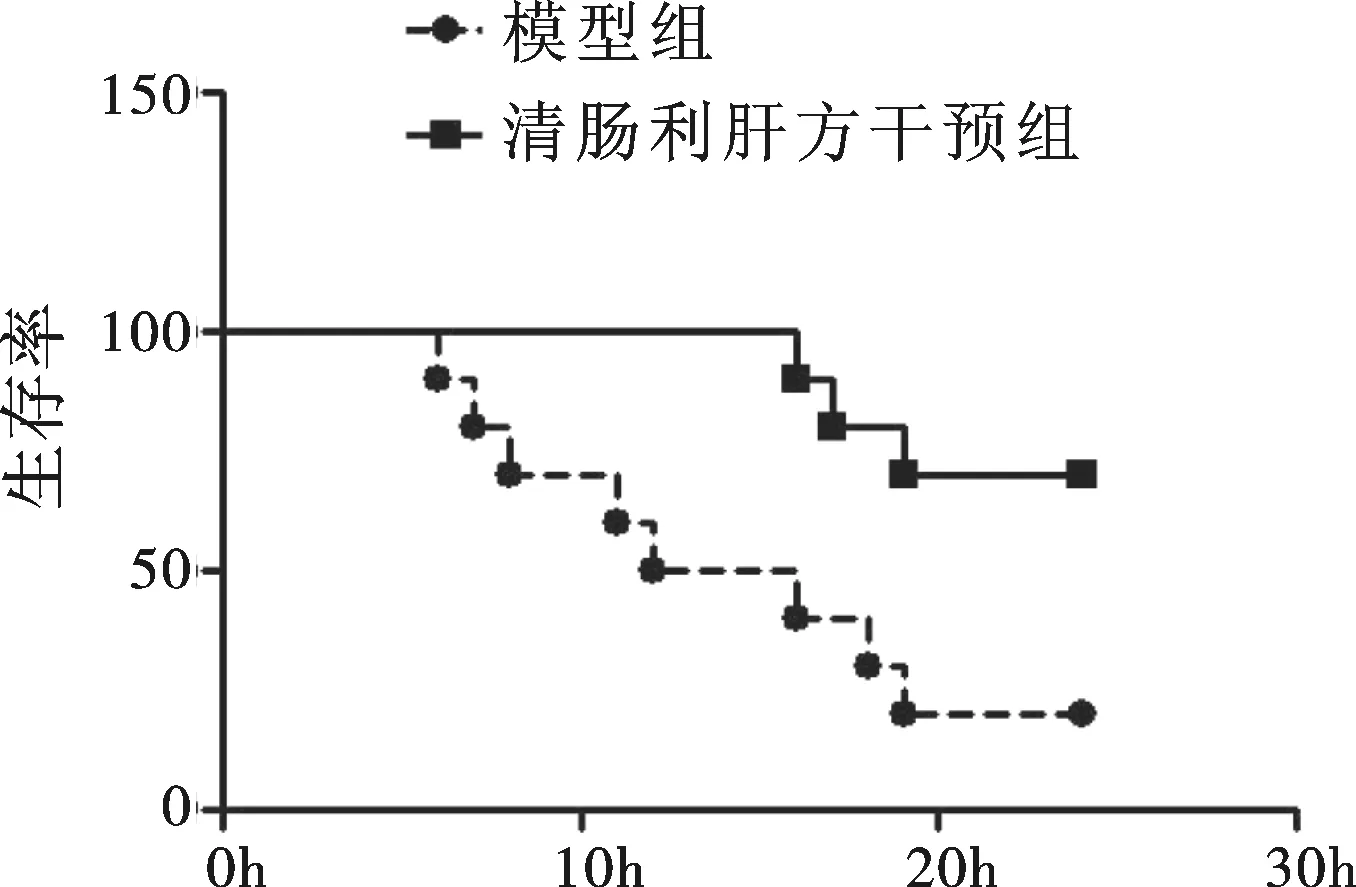
图1 清肠利肝方干预与ALF小鼠模型组生存曲线图
2.2 清肠利肝方干预抑制ALF小鼠肝脏组织细胞凋亡 D-GalN/LPS造模后6 h,模型组小鼠肝组织TUNEL染色见满视野凋亡阳性细胞,凋亡率为(67.6±3.01)%,清肠利肝方干预组小鼠肝组织凋亡阳性细胞少见,清肠利肝方干预组凋亡率为(16.0±1.76)%,显著低于模型组(P<0.0001)(插页图2)。
2.3 清肠利肝方干预抑制ALF小鼠肝组织cleaved caspase3蛋白表达水平 与正常对照组相比,模型组小鼠肝组织中cleaved caspase3蛋白表达增加,而清肠利肝方干预后可使ALF小鼠肝组织中cleaved caspase3蛋白表达降低(图3)。

图3 WB检测肝组织中cleaved caspase3表达水平图
2.4 清肠利肝方干预抑制ALF小鼠肝组织caspase3活性 模型组小鼠肝组织caspase3活性为(118.7±24.89),清肠利肝方干预组小鼠肝组织caspase3活性为(34.99±6.67),显著低于模型组(P=0.012)(图4)。
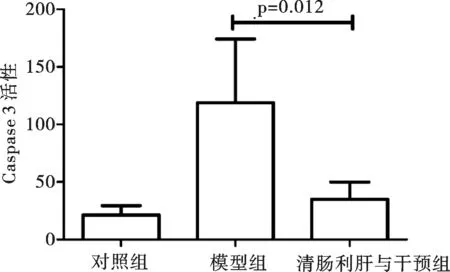
图4 各组小鼠肝组织caspase3活性检测
3 讨论
ALF是一个多因素参与的、复杂的病理生理过程。在众多因素中,内毒素血症是该病死亡的重要原因[4]。内毒素不仅可以诱导产生内毒素血症,还可诱发体内细胞的凋亡[5]。肝细胞凋亡是ALF一种重要的死亡形式,近年来研究表明肝细胞凋亡与ALF关系十分密切[6]。肝细胞凋亡是一种短时相病理改变,是ALF早期的一种重要病理学表现,也是药物治疗的重要靶点[7]。
Caspase3一般以无活性前体存在于细胞中,当细胞进入凋亡时才被激活,从而进入细胞核中执行凋亡效应,使得染色质凝集、DNA片段化、凋亡小体的形成等[8]。Caspase3的激活在肝细胞凋亡的发生中起重要的作用,是细胞凋亡过程中最主要的终末执行酶,是多种凋亡刺激信号传递的汇聚点。
TNF-α被认为是肝细胞凋亡的重要诱导因素,它与相应的配体结合后能激活caspase的级联反应,最终引起细胞DNA断裂、细胞凋亡。文献表明:TNF-α是D-GalN/LPS诱导ALF中的主要促凋亡因子[9]。JNK 是丝裂原活化蛋白激酶(MAPK)家族成员[10],可由细胞应激、炎症因子(TNF-α)等因素诱导激活,其中研究最为广泛的是,TNF-α 通过与TNFR1 结合,介导JNK的激活[11]。TNF-α介导的细胞凋亡与持续激活的 JNK 信号通路有关[12]。基于JNK2基因敲除小鼠及JNK激酶抑制剂SP600125的研究表明,JNK可通过诱导线粒体膜通透性改变、细胞色素C释放和 bid转位,介导肝细胞凋亡[13]。因此,在ALF动物,TNF-α不仅可直接诱导肝细胞凋亡,还可通过激活JNK 介导的线粒体凋亡通路,从而显著放大TNF-α的促凋亡效应。在 D-GalN/LPS 诱导的ALF小鼠,TNF-α上调可能是肝细胞凋亡的启动因素,JNK激活介导的线粒体途径可能是ALF早期肝细胞大量凋亡的关键。
我们前期研究结果表明,清肠利肝方对D-GalN/LPS诱导的ALF小鼠具有明显的保护作用,表现为减轻ALF肝组织病理学损伤,有效降低血清TNF-α含量,降低磷酸化JNK蛋白表达,在炎症与细胞凋亡等应激反应中发挥重要调节作用。本实验检测结果显示,清肠利肝方能有效降低ALF小鼠肝细胞cleaved caspase3的表达和caspase3的活性,提示清肠利肝方可能通过调节JNK和TNF-α发挥对ALF小鼠肝细胞的抗凋亡作用,从而减轻ALF小鼠肝损伤。
