不同葡萄糖浓度对小鼠胚胎体外发育影响
2019-09-04豆昌凤程小翠李欢欢赵彩霞俞海洋
豆昌凤,周 鑫,程小翠,李欢欢,赵彩霞,俞海洋,王 荣,张 迪
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
随着人们生活水平的提高,对糖类的摄取量也不断增多,再加上遗传和环境因素的影响,全球糖尿病的发病率仍然居高不下,育龄期妇女糖尿病的发病率也不断增高[1]。据统计,目前全球怀孕的女性中有大约1.7%~11.6%患有糖尿病,这也使得胎儿患有各种先天性缺陷[2]。胚胎发育受到众多因素的影响,其内在机制是非常复杂的,但葡萄糖作为一种关键的能源提供者对胚胎发育发挥着巨大的调控作用。葡萄糖可通过多种机制对细胞产生保护作用,也有抑制作用。在许多体外和体内实验中,葡萄糖浓度影响卵母细胞的发育能力[3]。高血糖通常与各种代谢紊乱相关,往往伴随着生育率的降低。与糖尿病有关的女性不孕是由于高葡萄糖水平对发育胚胎的有害影响[4]。
研究认为,对哺乳动物早期胚胎,过量的葡萄糖会对胚胎产生氧化应激损伤,影响其发育,甚至导致胚胎发育阻滞[3]。虽然在胚胎发育的生殖道环境中存在着一些关于葡萄糖浓度的争议。但发现葡萄糖浓度比血糖正常血清(5.56 mM)高3~4倍,这会损害胚胎发育。在小鼠模型中,植入前胚胎在含有15~27 mM葡萄糖(是正常小鼠血清的2~3倍)的培养基中培养,会损害囊胚的扩张和孵化[6]。体外研究进一步表明,高糖浓度损害了神经干细胞的增殖和产妇高血糖影响后代细胞凋亡,增殖,迁移和分化过程中的基因表达[7]。
PTGFR基因编码的蛋白是G蛋白偶联受体家族的成员,是前列腺素F2-α(PGF2-alpha)的受体,前列腺素通过与其受体PTGFR结合在生殖、血压、以及骨重塑方面PGF2α发挥广泛的病理和生理功能,PTGFR在生殖发育相关部位如子宫内膜、卵巢、胚胎中表达较多,且有研究表明,糖尿病患者循环中前列腺素(PG)F2α水平也明显升高,PGF2α受体(PTGFR)在空腹和糖尿病应激小鼠的肝脏中表达上调[8-9];血小板活化因子(PTAFR)是一种由植入前产生的有效的信号磷脂,于1972年首次报道[10],PTAFR参与了许多生殖和发育过程[11-12],包括排卵[13-14]、着床前胚胎发育[15]、植入[16]和分娩[17]。皮素A受体(EDNRA)的激活在糖尿病微血管病变中起重要作用;EDNRA的激活在糖尿病微血管病变中起重要作用,有报道糖尿病孕妇血浆ET-1水平在整个观察期明显高于健康孕妇[18];尾加压素II(UTS2R)是已知的最有效的血管活性激素之一[19];速激肽受体3(TACR3)基因编码神经激肽3(NK3)受体,是一种G蛋白偶联受体,广泛分布于神经系统,通过多种信号途径发挥其多种生理作用,在胎盘中有表达。这5个基因与发育和生殖相关,其变化会引起编码蛋白发生变化。
本研究通过体外培养方法,分析了在不同浓度葡萄糖环境下小鼠植入前胚胎的生长发育,使用定量荧光PCR方法分析胚胎发育相关基因(PTGFR,PTAFR,EDNRA,TACR3,UTS2R)表达水平的变化,试图发现葡萄糖对早期胚胎体外发育产生的影响及可能途径,为探究孕妇糖尿病对胚胎发育影响提供思路,为胚胎技术、临床辅助生殖提供必要的实验参考数据。
1 材料与方法
1.1 实验动物
实验动物采用清洁级的8 w昆明白雌性小鼠和8~10 w昆明白雄性小鼠。购买自安徽医科大学实验动物中心;保持12 h光周期,控制温度在18~23℃,相对湿度60%~70%。
1.2 实验试剂和药品
葡萄糖购自美国Sigma公司,白色粉末;配制M2操作液,ksom培养基和HTF获能液的各试剂均购自Sigma公司,孕马血清促性腺激素(pregnant mare timulationgonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG),购自宁波第二激素厂,胚胎培养级水购自HyClone;生理盐水购自国药;RNase抑制剂购自TIANDZ;一步法定量试剂盒购自Takara;其他药品若无特殊说明,均购自Sigma。
1.3 主要仪器
眼科镊,尖头剪,倒置显微镜(德国Leica,DMI3000B),二氧化碳培养箱培养箱(美国Thermo,3141),小型台式高速冷冻离心机(德国eppendorf,5417R),分析天平(梅特勒,XS205DU),超净工作台(苏州净化,SW-CJ-2E),药品恒温冷藏柜(SANYO,MDR-411FR),定量 PCR 仪(ABI,StepOnePlus)。
1.4 动物的超数排卵
选取8~10 w的KM雌鼠和8~10 w的KM雄鼠,腹腔注射10 IU的PMSG,46~48 h腹腔注射10 IU的HCG,12 h后体外受精。
1.5 小鼠MII卵收集、体外受精及胚胎体外培养
在注射hCG后12 h左右,将雄鼠用颈椎脱臼法处死,取75%酒精消毒腹部后,打开腹腔,剪下附睾尾迅速将其置于预温的HTF获能液中,于解剖镜下用剪刀剪开,使精子流出,放入培养箱培养;接着以同样的方法处死雌鼠,并取出输卵管,放入M2操作液中,置于显微镜下用尖头镊将输卵管壶腹部明显膨大处穿破,使卵丘-卵子复合体流出,然后放入获能液中,放入培养箱培养。注射hCG14 h后取60 μL精子加入卵子获能体系中,4~5 h后用操作液M2并在解剖镜下观察,选有双原核的受精卵进行体外培养。。
1.6 胚胎培养
在四孔板的每个孔中分别加入含0、5.5、27.5 mmol·L-1葡萄糖的 KSOM 培养液,每孔 30~40 个胚胎。在饱和湿度的二氧化碳培养箱中预平衡培养液,胚胎在37℃、5%CO2和饱和湿度的二氧化碳培养箱中持续培养4 d。观察各时期胚胎并记录。计算2-细胞率、4-细胞率、桑甚胚率、囊胚率。
1.7 定量PCR
收集各组的囊胚到1.5 mL离心管中,每管5个,用5 μL裂解液裂解,可-80℃冻存。用Takara公司一步法定量PCR试剂盒检测PTGFR,PTAFR,EDNRA,TACR3,UTS2R。基因表达变化采用2-△△Ct法进行相对定量。以Gapdh为内参基因[20]。引物信息见表1。

表1 5个基因引物序列
定量PCR中的各参数按照标准流程设定,采用Takara公司的一步方法执行。即42℃5 min,95℃10 s反转录,然后 95℃5 s,60℃30 s,50次循环。结束时执行溶解曲线检测分析。每3枚囊胚用于一个PCR反应体系,重复三次。
1.8 统计分析
采用SPSS16.0对各期胚胎形成率差异进行分析单因素方差分析,p<0.05未显著性差异。
2 结果与分析
2.1 不同浓度葡萄糖对胚胎发育的影响
将体外受精胚胎置于含有不同浓度葡萄糖的培养液中在37℃、5%CO2培养箱中培养,探究葡萄糖对胚胎发育影响。发育情况如图1所示。统计各期胚胎发育情况。由表2与图2知,与5.5 mM浓度葡萄糖对照组比较,无糖组及高塘组2-细胞率、4-细胞率和桑椹胚率无明显差异(p>0.05),囊胚率明显降低(p<0.05)。
各组胚胎2-细胞形态学观察,见图1a~c。光镜下受精后26 h的无糖培养液培养2-细胞、对照2-细胞和高糖培养液培养的2-细胞图。2-细胞率与受精有着密切关系,光镜下并没有观察到高糖影响下的胚胎出现异常,各组胚胎发育率分别为95.5%,95.25%,93.75%。
各组中2-细胞胚胎的形态学观察,见图1a~c。受精后26小时的无糖培养液中的2-细胞胚、对照2-细胞胚和高糖培养液中的2-细胞胚图。光镜下并没有发现高糖导致胚胎出现发育异常,各组胚胎发育率分别为 95.5%,95.25%,93.75%。
各组中4-细胞胚胎形态学观察,见图1d~f。受精后48小时的无糖培养液中4-细胞胚、对照组4-细胞胚和高糖培养液培养的4-细胞胚图。光镜下同样未发现高糖影响胚胎形态出现异常,但各组胚胎发育率出现差异,分别为90%,93.25%,82.25%。
各组胚胎囊胚形态学观察,见图1j~l。光镜下无糖培养液培养囊胚、对照组囊胚和高糖培养液培养的囊胚图。各组胚胎发育率分别为51.25%,73.75%,52.25%。正常培养液中囊胚率在70%以上,无糖培养液培养囊胚、高糖培养液培养的胚胎囊胚率显著降低。
从表2的结果可以发现,当胚胎在不同浓度葡萄糖培养液中培养时,胚胎在2-cell,4-cell,各阶段的发育与正常组比较没有显著性改变,而胚胎在桑椹胚开始受到明显抑制,胚胎囊胚形成率下降受到显著抑制。各组胚胎都能顺利地发育通过2-cell,4-cell阶段,主要的发育受抑制期表现为桑椹胚后阶段。
2.2 不同葡萄糖对胚胎发育相关基因表达的影响
为本工作特别挑选了5个已知的在小鼠具有关键作用的基因进行表达分析,探究葡萄糖在分子水平对胚胎发育的影响,这五个基因分别是PTGFR、PTAFR、EDNRA、TACR3、UTS2R。利用定量PCR方法,比较并分析了它们在0 mM、5.5 mM、27.5 mM条件下发育形成囊胚中的表达。5个基因的表达情况见图3。可以看出,与对照组相比,五个基因分别是PTGFR、PTAFR、EDNRA、TACR3和UTS2R的表达都有变化,低糖浓度下PTGFR的表达降低,但没有受到显著影响,但是高糖浓度下PTGFR的表达显著升高;与之相反的是EDNRA的表达情况,低糖浓度下EDNRA的表达显著升高,高糖浓度下EDNRA的表达降低,但没有受到显著影响;而另外3个基因PTGFR、TACR3和UTS2R的表达在葡萄糖存在的情况下都发生了改变,高糖和低糖情况下表达量增加,呈现上调表达。其中TACR3在低糖浓度下呈现上调表达,但是没有显著增加,在高糖浓度下Tacr3表达受到葡萄糖的明显影响,表达量显著增加;与TACR3的表达情况相反的是,低糖情况下,表达量显著增加呈现上调表达,高糖浓度下PTAFR表达明显增加、UTS2R的表达呈上调趋势但不显著。

图1 不同葡萄糖浓度体外培养条件下小鼠胚胎图

表2 不同浓度葡萄糖对小鼠胚胎体外发育影响
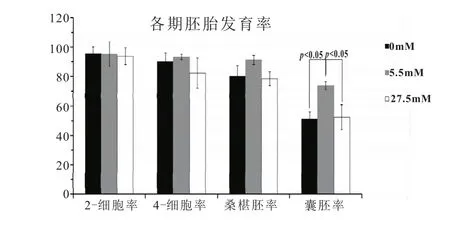
图2 不同葡萄糖浓度体外培养条件下小鼠胚胎发育

图3 5个基因在不同葡萄糖浓度体外培养条件下小鼠囊胚中的差异表达
3 讨论
孕妇体内异常糖含量会导致一系列问题,流产、畸形、巨大胎儿、先天性器官畸形等,胚胎发育受到众多因素的影响,其内在机制是非常复杂的。葡萄糖可通过多种机制对细胞产生保护作用,也有抑制作用。孕期高血糖会升高氧化应激反应,产生的大量超氧自由基对胚胎造成损害[21]。在卵裂前期,即8-细胞之前的阶段,主要的供能物质是丙酮酸,当发育到8-细胞胚时,葡萄糖成为主要的供能物质[22],对胚胎发育发挥着巨大的调控作用,这与本实验结果是吻合的。本实验通过在培养体系中添加葡萄糖体外培养胚胎,实验结果表明葡萄糖浓度对胚胎发育有显著影响,低糖、高糖环境下葡萄糖阻碍了胚胎的发育,尤其是从桑椹胚到囊胚阶段的发育。为了保证胎儿的正常发育,调节控制孕妇体内糖含量非常重要[23]。已证明胚胎受高糖影响,细胞凋亡是一个及其复杂的程序化过程。实际上,许多与细胞凋亡有关的基因都在早期胚胎发育过程中发挥作用。葡萄糖浓度影响基因的表达,我们认为PTGFR、PTAFR、EDNRA、TACR3、UTS2R参与了高浓度葡萄搪诱导的着床前胚胎细胞的凋亡,胚胎发育相关基因PTGFR、PTAFR、EDNRA、TACR3、UTS2R在囊胚形成和胚胎植入过程中发挥着重要功能。研究指出,PG受体在哺乳动物排卵、黄体退化、胚胎着床和分娩等生殖过程,发挥着关键而复杂的调节作用,PTGFR(前列腺素F2α受体)是识别子宫内膜妊娠的胚胎信号受体[24],抑制其合成会导致物种在植入前终止妊娠,有研究表明证明PTGFR在空腹和糖尿病应激小鼠的肝脏中表达上调,本实验与之结果是相吻合的。EDNRA(endothelin receptor type A)内皮素受体A型该基因编码内皮素-1的受体,是Endothelin的G蛋白偶联受体,内皮素-1是一种在强效和持久的在血管收缩中起作用的肽。该受体与鸟嘌呤核苷酸结合(G)蛋白结合,这种偶联激活磷脂酰肌醇-钙第二信使系统。研究表明EDNRA(内皮素受体A型)也参与生殖活动调节,可通过自分泌或旁分泌对胚胎发生和早期胚胎发育起到调控作用[25]。TACR3(速激肽受体3)在调节促性腺激素释放激素的释放中发挥重要作用,是人类正常生殖发育和功能的关键调节因子,TACR3在生殖内分泌调控中的作用不容忽视[26],在高糖处理组中,该基因表达上调。PTAFR是血小板激活因子受体即PAF受体,研究表明较高水平PAF可以提升妊娠率,因此在人类生殖过程如排卵、受精、着床等中发挥重要作用[27],培养基中添加PTAFR促进胚胎代谢、减少胚胎细胞死亡的发生率,同时提高体外发育率,可作为哺乳动物着床前胚胎的自分泌生长/存活因子之一,然而在本研究中,实验组中该基因表达量上调,推测在实验组中胚胎为了存活,会增加PTAFR的表达,从而使胚胎发育到囊胚。查阅文献可知UTS2R(尾加压素Ⅱ受体)在血管收缩方面发挥作用,对增加迁移、粘附和体外血管生成等有显著影响[28]。与对照组相比,PTAFR、EDNRA、TACR3和UTS2R下在低糖浓度下呈现上调表达。在高糖浓度下PTGFR、PTAFR、TACR3和UTS2R呈现上调表达。证明了在基因表达水平上,葡萄糖对胚胎发育存在影响证明了在基因表达水平上孕妇高糖对胚胎发育影响的存在。尽管对葡萄糖调节PTGFR、PTAFR、EDNRA、TACR3和UTS2R基因表达的途径与机制还不清楚,但我们可以认为它是通过包括渗透压、细胞信号传导和表观遗传修饰,氧化应激等多种途径实现的[29]。
葡萄糖具体通过哪条途径影响胚胎发育,尚有待进一步研究。本文系统的分析葡萄糖的浓度对胚胎发育的影响,葡萄糖浓度对胚胎发育的规律。阐明影响胚胎发育的葡萄糖浓度效应及影响发育的关键阶段。说明母体糖尿病对胚胎发育产生影响,为了胎儿的正常发育,应控制发育环境中的葡萄糖浓度。本研究可以为提高哺乳动物胚胎体外培养效率提供一定的实验参考数据,也可为人类临床辅助生殖提供研究思路,为解决孕妇高糖促成致畸的这些因素提供参考依据,同时对于后期建立小鼠模型以进一步研究与糖尿病诱导的胚胎病变相关的潜在机制是重要的。
4 小结
哺乳动物胚胎发育是一个极为复杂的过程,胚胎早期阶段的细胞谱系的正确建立是整个后期发育的基础。本研究探讨了糖浓度对胚胎发育的影响,研究的结果证明了糖浓度可以极大地影响胚胎的早期发育和发育关键基因的表达。不但帮助理解环境因素在胚胎发育上的影响,更有助于为防止胎源性疾病及先天畸形的发生提供理论研究基础。
