血清肿瘤坏死因子受体6对老年慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者转归的影响
2019-09-04梁昌芬林镜明朱勇德李镇邓托
梁昌芬 林镜明 朱勇德 李镇 邓托
(海南省第三人民医院 1急诊科,海南 海口 572000;2呼吸内科)
慢性阻塞性肺疾病(COPD)是一种以不完全可逆气流持续受限为特点的慢性呼吸系统疾病,发病率高,致病因素复杂,预防和治疗困难,尤其急性加重期的(AE)COPD老年患者,可引发急性肺损伤,进而出现呼吸衰竭,甚至死亡。研究表明,细菌或病毒感染是AECOPD疾病发生的主要诱因,与机体肿瘤坏死因子(TNF)-α、中性粒细胞等多种炎症因子密切相关〔1〕。TNF-α通过与靶细胞上可溶性TNF受体(TNFR)结合,释放大量炎症因子,促进机体细胞凋亡,导致炎性细胞浸润肺部组织,形成AECOPD疾病。肿瘤坏死因子受体-6(DcR3)是在TNFR家族中新发现的一种可与TNF-α特异性结合的特殊细胞凋亡抑制剂,与TNF-α结合形成的TNF-DcR3复合物不能介导细胞因子传递凋亡信号,通过抑制TNF-α与靶细胞结合调控机体炎症水平,已被证明在自身免疫、肿瘤免疫、抗病毒免疫和移植免疫中起重要作用〔2〕,但对老年AECOPD合并呼吸衰竭患者的影响尚不清楚。本研究拟分析DcR3在老年AECOPD合并呼吸衰竭患者血清中的表达水平及其对预后转归的影响。
1 资料与方法
1.1一般资料 2015年3月至2017年3月收治的老年AECOPD患者134例,按照是否并发呼吸衰竭分为呼吸衰竭组65例和非呼吸衰竭组69例,其中呼吸衰竭组男35例,女30例,年龄61~85〔平均(70.58±6.34)〕岁;非呼吸衰竭组男37例,女32例,年龄60~83〔平均(70.19±5.85)〕岁。按照慢性阻塞性肺疾病全球倡仪(GOLD)分级标准分为:Ⅱ级31例,Ⅲ级66例,Ⅳ级37例。另取同期体检健康志愿者60例为对照组,其中男33例,女27例,年龄60~84〔平均(71.02±6.23)〕岁。3组年龄、性别无显著差异(P>0.05)。
1.2纳入与排除标准 纳入标准:①经《慢性阻塞性肺疾病诊治指南》〔3〕确诊为AECOPD,其中呼吸衰竭诊断标准为动脉血氧分压(PaO2)<60 mmHg,或伴有动脉血二氧化碳分压(PaCO2)>50 mmHg〔4〕;②临床资料完整;③签署知情同意书。排除标准:①合并肝、肾等重要器官严重病变;②合并恶性肿瘤、血液系统病变、呼吸系统等严重感染;③合并精神系统异常。本研究经医院伦理委员会审核通过。
1.3临床基本资料收集 采用全自动生化分析仪检测入院时血清白蛋白(Alb)、C反应蛋白(CRP);采用肺功能测定仪检测第1秒用力呼吸容积占预计值百分比(FEV1%)、第1秒用力呼吸容积占用力肺活量百分比(FEV1/FVC);采用血气分析仪检测PaO2和PaCO2。对照组数据均于体检当日获取。
1.4血清相关炎症因子测定 采用酶联免疫吸附试验检测入院时血清白细胞介素(IL)-8、TNF-α、DcR3水平,所用试剂盒均购自上海联迈生物工程有限公司。
1.5随访 出院后1年时间内进行随访,统计生存与死亡情况,以发生死亡判定为预后不良。
1.6统计学分析 采用SPSS17.0软件进行t检验、COX回归分析、方差分析。
2 结 果
2.1基本临床资料 呼吸衰竭组Alb、FEV1%、FEV1/FVC、PaO2水平显著低于非呼吸衰竭组和对照组(P<0.05),且非呼吸衰竭组显著低于对照组(P<0.05);呼吸衰竭组CRP、PaCO2水平显著高于非呼吸衰竭组和对照组(P<0.05),且非呼吸衰竭组CRP水平显著高于对照组(P<0.05),见表1。

表1 3组研究对象基本临床资料
与对照组相比:1)P<0.05;与非呼吸衰竭组相比:2)P<0.05;下表同
2.2血清相关炎症因子比较 呼吸衰竭组血清IL-8、TNF-α、DcR3水平显著高于非呼吸衰竭组和对照组(P<0.05),且非呼吸衰竭组显著高于对照组(P<0.05),见表2。

表2 3组研究对象血清相关炎症因子比较
2.3影响老年AECOPD合并呼吸衰竭患者不良预后的危险因素 以老年AECOPD合并呼吸衰竭患者是否发生死亡为因变量,以性别、年龄、GOLD分级、Alb、CRP、FEV1%、PaO2、PaCO2、IL-8、TNF-α、DcR3为自变量行COX回归分析,单因素分析显示,Alb、FEV1%、PaO2、IL-8、TNF-α、DcR3水平均是影响老年AECOPD合并呼吸衰竭患者不良预后的危险因素(P<0.05);多因素分析显示TNF-α、DcR3水平是影响老年AECOPD合并呼吸衰竭患者不良预后的独立危险因素(P<0.05),见表3。
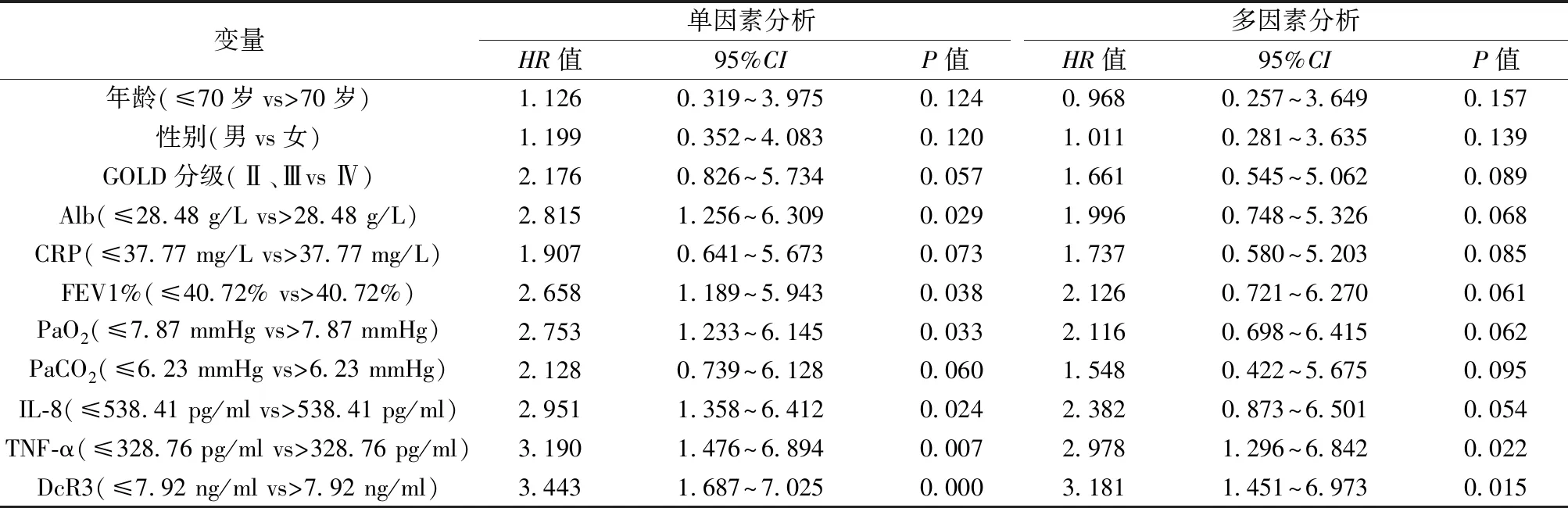
表3 影响老年AECOPD合并呼吸衰竭患者不良预后的危险因素
3 讨 论
AECOPD致病原因复杂,遗传、吸烟、环境污染、化学物质、呼吸道感染等均可诱导发生,其中由感染导致的人体气道炎症失衡是其发生的主要因素〔5〕。研究表明,感染可导致AECOPD患者气道出现高炎症水平,刺激机体产生氧化应激反应,释放炎症因子,引起气道壁黏膜充血水肿、气道塌陷,阻塞气道影响通气功能,致使气道重塑、气道壁增厚,造成CO2潴留和顽固性低氧血症,最终并发呼吸衰竭〔6〕。TNF-α是由单核细胞、巨噬细胞及星状细胞、内皮细胞等分泌的一种具有促炎作用的免疫调节因子,生物活性广泛,可刺激人体气道平滑肌细胞大量释放具有收缩平滑肌功能的内皮素-1,引起气道细胞增殖,发生气道重建〔7〕。Singh等〔8〕研究显示,TNF-α作为AECOPD患者机体免疫应答的重要介质,可大量释放炎性细胞因子、活性氧自由基、脂类及蛋白水解酶,引起炎性细胞浸润,诱导黏附因子释放,促进组织纤维增生,影响血管内皮细胞通透性,破坏肺结构。雷小婷等〔9〕研究显示,高水平的TNF-α可引起体内炎症加剧,导致AECOPD患者咳痰量增加,WBC计数水平上调,炎性因子IL-8释放量增加,进而破坏溶酶体引起溶酶体酶大量释放,对肺泡细胞造成损伤,诱发呼吸衰竭产生。本研究提示AECOPD疾病可能导致老年患者炎症因子水平升高。
在AECOPD合并呼吸衰竭疾病发病过程中,机体自身调节系统为对抗炎症介质保持自身稳态,势必会产生一系列抗炎介质来抑制气道炎症,控制疾病进程,其中以抗炎介质DcR3较为有效〔10〕。DcR3是定位于人类染色体20q13.3上的表面受体,可与TNF家族配体FasL、LIGHT及TNF样配体1A结合,负调控细胞凋亡,在某些肿瘤疾病中高表达〔11〕。潘留兰等〔12〕研究表明,DcR3可使巨噬细胞趋向具有抗炎特性的M2表型,减少抗炎细胞因子分泌;还可阻断LIGHT与淋巴毒素受体介导的细胞凋亡信号传导过程,激活树突状细胞,参与细胞免疫调节,使Th2/Th1平衡向Th2反应倾斜,抑制T细胞趋化性。Chen等〔13〕研究表明,DcR3序列缺少跨膜结构域,可阻断TNF-α的生物学活性,降低促炎因子产生,下调机体炎症水平。但Edfeldt等〔14〕研究表明,DcR3是免疫反应的多功能调节剂,一方面可能参与免疫抑制,另一方面可能具有促炎功能,可促进内皮细胞分泌细胞间黏附分子和IL-8等炎症因子。本研究提示老年人AECOPD合并呼吸衰竭疾病的发生可能引起血清中DcR3水平的升高,与Felix等〔15〕研究结果一致。进一步分析显示,血清DcR3水平可能与老年AECOPD合并呼吸衰竭患者预后转归有关。
