重组RPLP0蛋白的表达、鉴定及评价①
2019-09-03卢小岚罗文依王舒琪张国元刘剑平王东生
卢小岚 王 强 杜 琴 梁 骑 罗文依③ 王舒琪③ 张国元 刘剑平 王东生
(川北医学院附属医院检验科,南充 637000)
核糖体磷蛋白大亚基P0(Ribosomal phospho-protein large P0,RPLP0)蛋白是核糖体大亚基上的一个重要组成部分,参与蛋白质合成过程的调节,对核糖体的稳定和活性起关键作用[1]。此外,RPLP0蛋白还与系统性红斑狼疮、细胞凋亡、肿瘤的发生发展密切相关[2,3]。His6是6个组氨酸残基组成的融合标签,能构成独特的结构特征利于纯化和检测。GST是一种能促进蛋白表达和溶解的标签蛋白。本研究拟采用基于PCR的基因拼装(PCR based gene assembly)技术[4],在RPLP0基因N端引入GST标签,C端引入His6标签,以期获得具有可溶性易纯化性的融合蛋白。
1 材料与方法
1.1材料
1.1.1实验试剂 PET41a质粒购自Novagen公司;限制性内切酶BamH Ⅰ、Xho Ⅰ、T4 DNA 连接酶、高保真聚合酶和诱导剂IPTG均购自日本TaKaRa公司;OverExpress C41(DE3)菌种、DNA ladder、质粒提取试剂盒购自北京天根公司;胰蛋白胨和酵母粉购自美国Sigma公司;卡那霉素和氯霉素购自美国Gibco公司;TRIzol购自美国Invitrogen公司;逆转录试剂盒购自日本TOYOBO公司;引物合成及DNA测序委托上海生工公司完成;HRP标记羊抗小鼠抗体、HRP标记羊抗人IgG抗体购自美国Abcam公司;WB所用重组RPLP0蛋白购自Diarect公司;其余试剂均为国产或进口分析纯试剂。
1.1.2实验对象 收集川北医学院附属医院2016年1月~2017年12月期间经欧蒙免疫印迹法(LIA)检出的抗核糖体P蛋白抗体阳性患者的血清110例。收集经欧蒙免疫印迹法检测抗U1-nRNP、SmD1、SS-A、SS-B、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC和AMA M2阳性不同自身抗体的血清样本各6份。
1.2方法
1.2.1PCR扩增 根据Genbank中RPLP0基因编码序列设计一对PCR引物,并在引物的5′端分别引入BamH Ⅰ和Xho Ⅰ的酶切位点;引物为:P1:5′-agggatccatgcccagggaagacagg-3′;和P2:5′-agctcgaggtcaaagagaccaaatcccat-3′(下划线为酶切位点);采用TRIzol法提取细胞总RNA,以Hela细胞提取总RNA后逆转录制备的cDNA为模板,逆转录体系为20 μl:2×RT缓冲液4 μl,RT Enzyme Mix 1 μl,Primer Mix 1 μl,RNA 1 μl,ddH2O 13 μl。用cDNA和合成的引物进行扩增,扩增反应总体系为50 μl:2×Mix 25 μl,cDNA模板2 μl,特异性引物对各2 μl (10 μmol/L),ddH2O 19 μl;扩增反应条件为:95℃预热3 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环后再进行72℃延伸 5 min。扩增产物经琼脂糖凝胶电泳鉴定,并切胶回收PCR产物,获得GST-RPLP0-6*His融合基因片段。
1.2.2质粒载体的构建及鉴定 采用BamH Ⅰ和Xho Ⅰ分别对PCR扩增产物以及PET41a质粒进行双酶切;酶切产物经琼脂糖凝胶电泳后切胶分别回收,再将两者以T4 DNA连接酶4℃连接过夜。以连接产物转化感受态OverExpress C41(DE3)菌,在LB平板(卡那霉素50 μg/ml,氯霉素34 μg/ml)上进行初步筛选,挑取平板上生长最佳的单个菌落,用质粒提取试剂盒提取质粒,以BamH Ⅰ和Xho Ⅰ双酶切后,进行琼脂糖凝胶电泳分析,同时对所提重组质粒进行测序分析。
1.2.3重组RPLP0蛋白的诱导表达 将鉴定正确的重组质粒pET41a-GST-RPLP0-6*His转化至OverExpress C41(DE3)菌,挑取单克隆菌落接种入5 ml LB液体培养基(卡那浓度50 μg/ml,氯霉素浓度34 μg/ml),37℃培养12~14 h。次日以1∶ 100接种,37℃培养至A600 nm达0.4~0.6 左右,加入浓度为0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),20℃诱导表达6 h,8 000 r/min、4℃离心1 min,收集菌体。加入1 ml破碎液[50 mmol/L Tris-HCl(pH8.0),5 mmol/L EDTA,0.2 mg/ml溶菌酶]进行超声波裂解。裂解条件:冰浴、功率400 W、超声2 s、间隔6 s、时间5 min。超声波裂解后,12 000 r/min、4℃离心1 min,收集上清液(IPTG诱导后裂解上清)和沉淀(IPTG诱导后包涵体)进行SDS-PAGE分析蛋白表达情况。
1.2.4重组RPLP0蛋白的纯化及复性
1.2.4.1重组RPLP0蛋白的纯化 采用50 ml包涵体洗涤缓冲液[20 mmol/L Tris-HCl(pH8.0),150 mmol/L NaCl,10 mmol/L EDTA,0.5% (v/v) TritonX-100]充分重悬沉淀(IPTG诱导后包涵体),直至溶液呈均质悬浊液。于4℃ 13 000 r/min离心15 min,收集上清(包涵体洗脱液),将洗涤后的沉淀(IPTG诱导后包涵体)加入适量2 mol/L尿素溶液震荡溶解,溶解后的悬浊液于4℃ 13 000 r/min离心15 min,收集上清(2 mol/L尿素溶液洗脱液);未溶解的沉淀加入适量8 mol/L尿素溶液震荡溶解,溶解后的液体于4℃ 13 000 r/min离心15 min,收集上清(8 mol/L尿素溶液洗脱液)。将收集的包涵体洗脱液、2 mol/L尿素溶液洗脱液和8 mol/L尿素溶液洗脱液进行SDS-PAGE分析蛋白溶解情况。
1.2.4.2重组RPLP0蛋白的复性 将8 mol/L尿素溶液洗脱液用8 mol/L尿素溶液稀释到2 mg/ml,装入透析袋,透析袋放入复性缓冲液1(2 mol/L尿素溶液,20 mmol/L Tris,500 mmol/L NaCl,10 mmol/L DTT,0.5 mol/L L-Arginine) (pH8.0)中,常温透析复性12 h。然后更换为复性缓冲液2(20 mmol/L Tris,500 mmol/L NaCl,10 mmol/L DTT)(pH8.0)中,继续透析复性,完全去除尿素。将蛋白溶液从透析袋中取出,离心收集复性上清液和复性沉淀进行SDS-PAGE分析蛋白表达情况。
1.2.5重组RPLP0蛋白的免疫原性验证 采用复性的重组RPLP0蛋白免疫BALB/c雌性小鼠,60 μg/(次·只),腹腔注射。第一次免疫使用弗氏完全佐剂,第二次和第三次免疫使用弗氏不完全佐剂。第三次免疫后第7天采集小鼠血清,以Diarect公司的重组RPLPO蛋白为上样蛋白,采用Western blot方法来检测小鼠血清中抗重组RPLPO蛋白抗体。
Diarect公司的重组RPLP0蛋白5、10、20 ng分别上样;蛋白样品经SDS-PAGE分离后转膜至PVDF膜,以封闭液室温封闭2 h后,加入一抗(1∶1 000 稀释的小鼠血清);4℃孵育过夜后TBST洗膜3次,然后加入二抗(1∶5 000稀释的HRP标记羊抗小鼠抗体);室温下孵育2 h后TBST洗膜3次,然后加ECL发光液显影。
1.2.6重组RPLP0蛋白用于ELISA检测抗核糖体P蛋白抗体 采用复性的重组RPLP0蛋白、Diarect公司的重组RPLP0蛋白分别包被酶标板,然后加入不同浓度的抗核糖体P蛋白抗体人血清样品,100 μl/孔,37℃孵育1 h;洗涤后加入HRP标记的羊抗人IgG抗体,100 μl/孔,37℃孵育1 h;洗涤后加入TMB显色液,100 μl/孔,37℃孵育30 min;加入2 mol/L 硫酸,50 μl/孔,终止反应后,酶标仪上测定A450值。
1.2.7重组RPLP0蛋白特异性验证 采用1.2.6方法建立的ELISA反应体系检测常见自身抗体阳性的血清样本,以样本OD450 nm/(0.10+阴性对照OD450 nm)<1.00,即S/CO<1.00作为阴性判读标准。
1.3统计学处理 采用SPSS18.0软件进行统计分析。以Diarect公司的重组RPLP0蛋白包被酶标板,检测患者血清中抗核糖体P蛋白抗体的OD值为因变量(x);以纯化重组RPLP0蛋白包被酶标板,检测患者血清中抗核糖体P蛋白抗体的OD值为自变量(y);采用一元线性回归分析两者关系。P<0.05为差异有统计学意义。
2 结果
2.1PCR扩增产物鉴定 将PCR扩增产物经SDS-PAGE电泳,得到一条明显的目的条带,如图1A所示。其大小与设计的预期片段大小相符。
2.2质粒的构建及鉴定 重组RPLP0蛋白基因与pET41a质粒经BamH Ⅰ和Xho Ⅰ双酶切、胶回收后,用T4 DNA连接酶连接过夜;然后将连接产物转化感受态大肠杆菌,然后对LB平板上生长的单个菌落进行菌落PCR扩增,扩增产物经SDS-PAGE电泳显示,成功克隆出重组RPLP0蛋白基因,大小为954 bp;结果如图1B所示。经测序证实序列与设计序列完全相符。表明重组原核表达质粒 pET41a-GST-RPLP0-6*His构建成功。
2.3重组RPLP0蛋白的表达 表达菌体经超声波裂解后,收集上清液和沉淀,进行SDS-PAGE电泳鉴定蛋白表达方式。结果如图2A所示,包涵体沉淀电泳带出现一条表达条带,与预期融合蛋白大小一致,分子量为61 kD。
2.4重组RPLP0蛋白的纯化及复性 采用包涵体洗脱液、2 mol/L尿素溶液、8 mol/L尿素溶液对重组RPLP0蛋白进行洗脱;电泳结果显示:包涵体洗脱液和2 mol/L尿素溶液均不能将重组蛋白洗脱;该重组蛋白主要在8 mol/L尿素溶液中溶解,蛋白主带清晰,总体纯度大于85%,结果如图2B。
将重组RPLP0蛋白复性后,采用SDS-PAGE电泳对复性上清液和复性沉淀进行分析,发现复性后的蛋白90%为可溶性状态,蛋白纯度>90%;结果如图2C。
2.5重组RPLP0蛋白的免疫原性分析 复性的重组RPLP0蛋白免疫BALB/c小鼠后,小鼠血清中产生抗重组RPLP0蛋白的抗体。采用Western blot方法,用免疫后的小鼠抗血清来检测Diarect公司的重组RPLP0,结果显示,重组RPLP0蛋白免疫小鼠的抗血清能够与Diarect公司的RPLP0蛋白发生反应,在Mr 的35 kD附近出现明显条带,提示重组RPLP0蛋白具有足够的免疫原性。结果如图3所示。
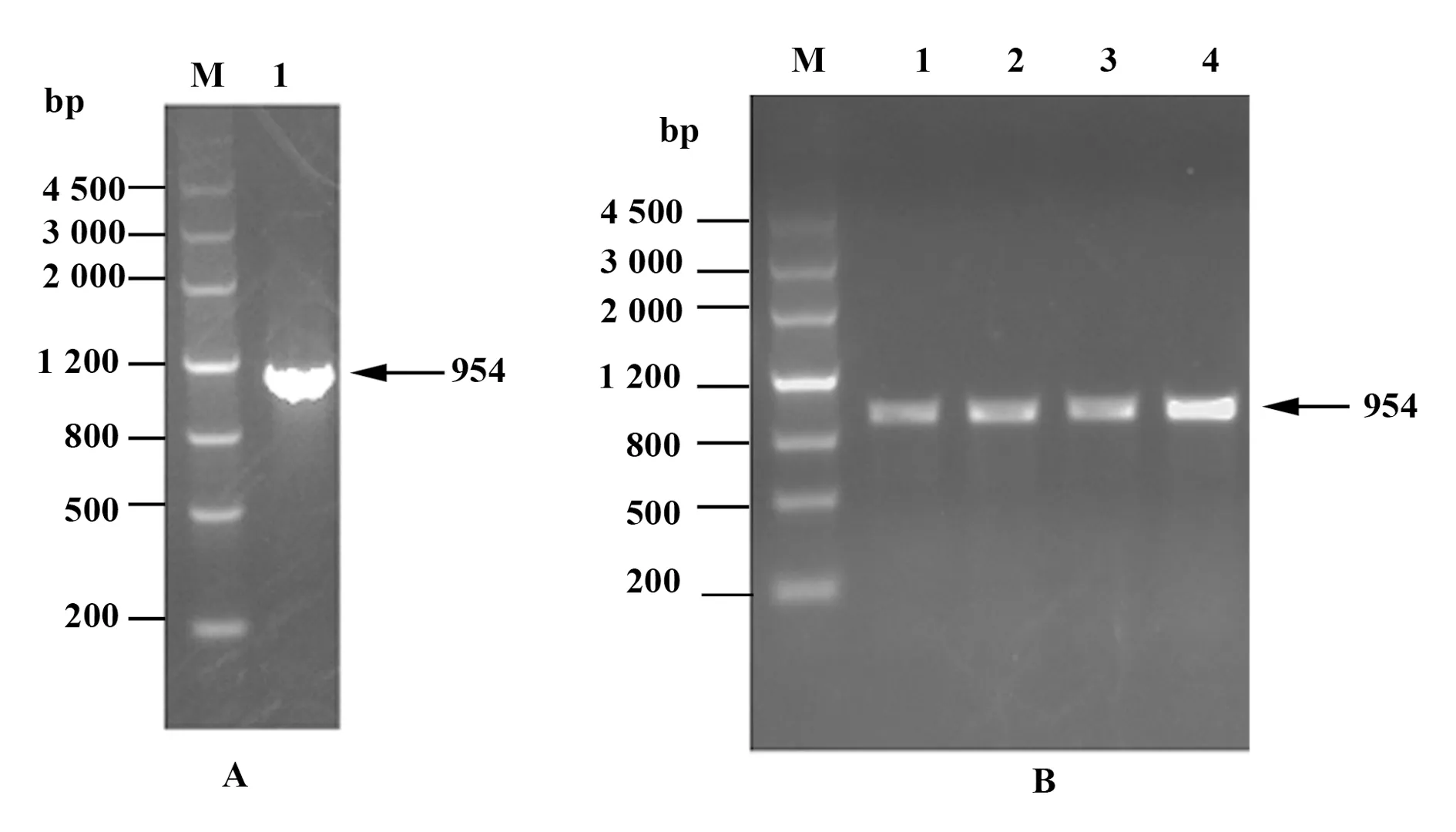
图1 重组RPLP0蛋白的基因PCR扩增产物与质粒鉴定电泳图Fig.1 Electrophoretic map of PCR amplified product and identification of recombinant plasmidNote: A.Amplification of recombinant RPLP0 protein gene by PCR (M.Marker,1.Recombinant RPLP0 protein gene);B.Identifica-tion of recombinant plasmid (M.Marker,1-4.Positive colonies).
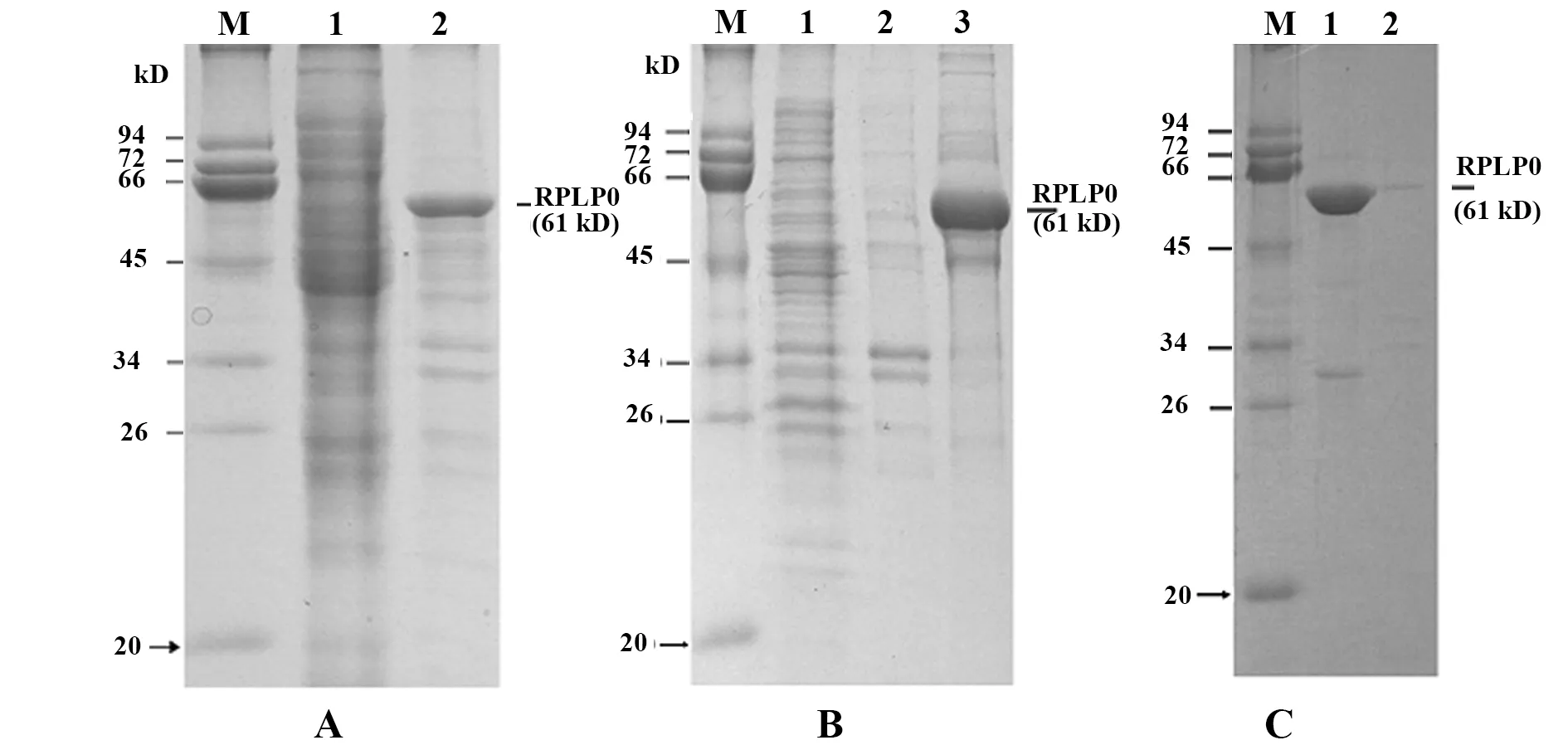
图2 重组RPLP0蛋白的表达、纯化及复性的SDS-PAGE电泳图Fig.2 Expression,purification and renaturation of recom-binant RPLP0 proteinNote: A.Expression of recombinant RPLP0 protein (M.Marker,1.Liquid supernatant,2.Inclusion bodies);B.Purification of recombinant RPLP0 protein (M.Marker,1.Inclusion body eluent,2. 2 mol/L urea solution,3. 8 mol/L urea solution);C.Renaturation of recombinant RPLP0 protein (M.Marker,1.Refolding supernatant,2.Refolding precipitation).

图3 重组RPLP0蛋白的免疫原性分析Fig.3 Immunogenicity of recombinant RPLP0 proteinNote: 1.20 ng RPLP0(Diarect);2.10 ng RPLP0(Diarect);3.5 ng RPLP0(Diarect).
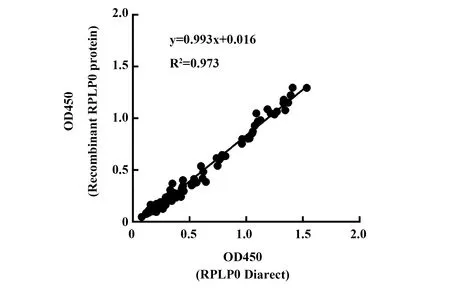
图4 两种RPLP0蛋白检测血清抗核糖体P蛋白抗体的相关性分析Fig.4 Correlation analysis of serum anti-ribosomal phosphoprotein which was detected by two kinds of RPLP0 protein
表1 重组RPLP0蛋白与常见自身抗体交叉反应情况
Tab.1 Specificity of recombinant RPLP0 protein
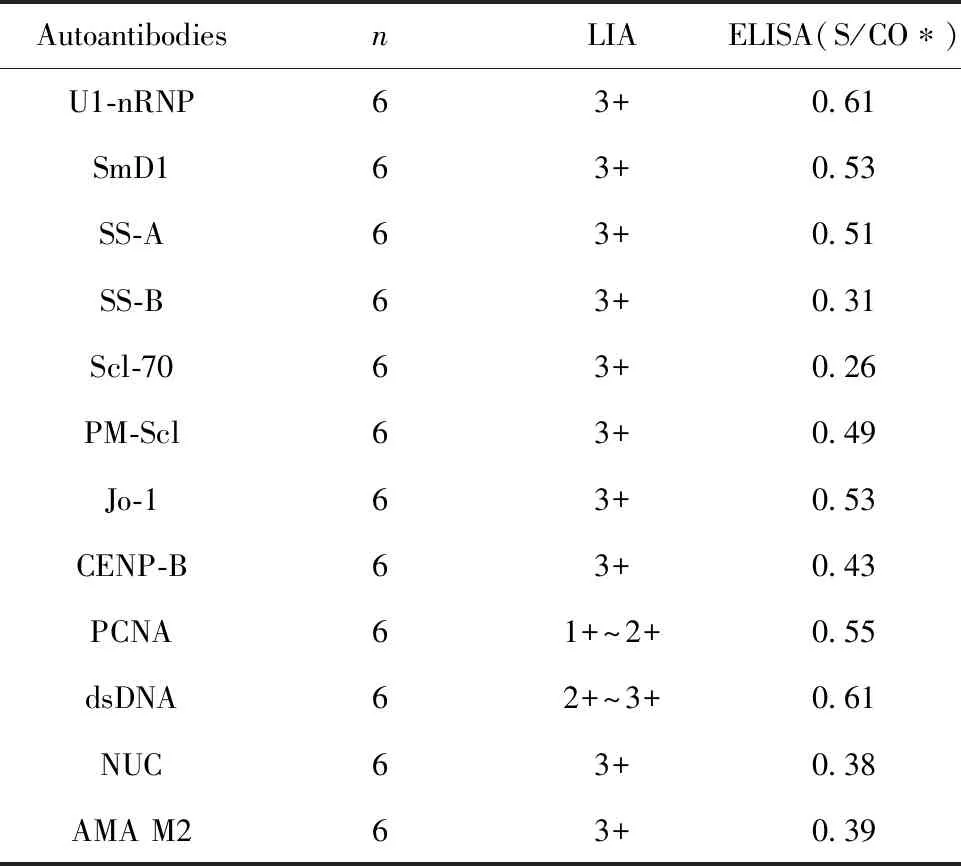
AutoantibodiesnLIAELISA(S/CO∗)U1-nRNP63+0.61SmD163+0.53SS-A63+0.51SS-B63+0.31Scl-7063+0.26PM-Scl63+0.49Jo-163+0.53CENP-B63+0.43PCNA61+~2+0.55dsDNA62+~3+0.61NUC63+0.38AMA M263+0.39
Note:S/CO* was the mean of test for samples.
2.6重组RPLP0蛋白的抗体结合性分析 如图4所示,以Diarect公司的RPLP0蛋白包被酶标板,检测患者血清中抗核糖体P蛋白抗体的OD值为因变量(x);以复性的重组RPLP0蛋白包被酶标板,检测患者血清中抗核糖体P蛋白抗体的OD值为自变量(y);进行一元线性回归分析发现,重组RPLP0蛋白包被酶标板检测血清抗核糖体P蛋白抗体的OD值与Diarect公司的RPLP0存在线性关系(F=6 175.000,P<0.000 1),一元线性回归方程为:y=0.993x + 0.016,R2= 0.973。这表明重组RPLP0蛋白具有良好的抗体结合性。
2.7重组RPLP0蛋白的特异性分析 用复性的重组RPLP0蛋白包被建立的ELISA反应体系检测抗U1-nRNP、SmD1、SS-A、SS-B、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC和AMA M2等常见自身抗体阳性血清样本,结果均为阴性。具体结果见表1。
3 讨论
核糖体P蛋白是核糖体的主要组成部分,位于核糖体的活性部位;在蛋白质的翻译合成过程发挥重要调节作用[1]。核糖体P蛋白分为P0、P1、P2三个亚单位;核糖体P1、P2蛋白通过P0锚定在核糖体上,这就构成了核糖体活跃区的横向“柄”结构。在1994年Santos等[5]敲除酵母细胞中P1、P2而保留P0蛋白,细胞仍可存活,但敲除P0蛋白而保留P1、P2蛋白,细胞立即死亡。因此,相对P1、P2蛋白而言,核糖体P0蛋白对于维持生命活动更重要。
自1985年Elkon等[6]在研究系统性红斑狼疮(SLE)患者时发现了抗核糖体P蛋白抗体以来,对抗核糖体P蛋白抗体的研究得到了人们的广泛关注。很多研究表明,抗核糖体P蛋白抗体主要见于SLE;且早在SLE被确诊前的1.7年就能检测到抗核糖体P蛋白抗体的存在[7]。故抗核糖体P蛋白抗体作为SLE的特异性诊断指标,或预示SLE疾病的发生。有研究发现[8],使用重组RPLP0蛋白检测抗核糖体P0蛋白抗体,比直接使用P蛋白检测抗核糖体P蛋白抗体敏感性更高,这就提示抗RPLP0蛋白抗体的检测对SLE诊断具有更高的敏感性,作为临床上辅助诊断SLE的一项重要指标,对SLE诊断具有重要意义。近年来的研究发现[2,9-12],RPLP0蛋白与肿瘤的发生发展密切相关,在鼻咽癌、肝癌、胃癌、直肠癌及妇科肿瘤患者体内RPLP0蛋白的mRNA表达明显上调,提示RPLP0蛋白与肿瘤的发生存在着一定的相关性;且赵强等[11]研究还观察到鼻咽癌发生淋巴结转移患者中RPLP0 蛋白表达阳性率高,这进一步提示RPLP0蛋白可能与肿瘤发生生物侵袭有关。此外,RPLP0蛋白还是一个凋亡相关蛋白,在凋亡过程中起重要作用[9,12]。
利用基因重组技术获取目的蛋白是目前最常用的方法,而亲和标签融合技术不仅便于重组蛋白的纯化和检测,还可提高重组蛋白的表达量,增加重组蛋白的可溶性和稳定性。本研究构建了pET41a-GST-RPLP0-6*His原核表达载体,在大肠杆菌中成功表达重组RPLP0蛋白。蛋白表达形式鉴定时发现重组RPLP0蛋白属于包涵体表达;包涵体表达具有表达量高,易纯化的优点;但包涵体表达产物一般不具有生物学活性,需要对包涵体进行溶解,并对其进行复性,才能进行表达产物的活性和生物学方面研究。因此,在本研究中我们采用降低变性剂浓度的方法,使重组蛋白复性。
将复性得到的重组RPLP0蛋白免疫小鼠,所得到的小鼠抗血清能与Diarect公司的重组RPLP0蛋白发生反应;且重组RPLP0蛋白也能与自身免疫性疾病患者血清中的抗核糖体P蛋白抗体结合。这表明该重组蛋白具有足够的免疫原性和良好的免疫反应性;同时重组蛋白与其他常见的自身抗体之间不存在交叉反应,具有很好的特异性,其所携带的亲和标签未对重组蛋白的蛋白活性、生物学功能产生影响,因而无需切除标签。
综上所述,RPLP0蛋白是生命体不可或缺的蛋白质,通过体外基因拼装技术重组构建表达RPLP0蛋白,为进一步探讨RPLP0蛋白的功能调节及基因表达调控奠定基础。