淫羊藿苷和淫羊藿次苷Ⅱ对气管切开大鼠T细胞亚群及细胞因子的影响①
2019-09-03谭人千姚金茜彭玲玲黄宗轩潘宇政韦进新
鞠 静 谭人千 姚金茜 彭玲玲 黄宗轩 潘宇政 韦进新
(广西医科大学第一附属医院,南宁 530021)
气管切开术是临床抢救危急重症患者采取的必要手段,但是气管切开后易并发肺部疾病,结合中医理论及现代医学研究,应重视肺病从肾论治的研究[1,2]。补肾阳中药淫羊藿(Herba epimedii)是小檗科多年生的草本植物,其有效化学成分主要有黄酮类和木脂素类化合物。淫羊藿苷(Icariin,ICA)是淫羊藿中主要的活性成分,属于黄酮类化合物。淫羊藿次苷Ⅱ(Icariside Ⅱ,ICS-Ⅱ)又名宝藿苷Ⅰ,是ICA的主要肠道代谢产物之一。我们前期实验研究发现淫羊藿水提取物对气管切开大鼠具有提高免疫的作用[3]。本实验将从T细胞亚群、细胞因子IL-6及大鼠分泌型免疫球蛋白A(sIgA)角度,继续探讨温肾阳治肺病的分子机制,旨在找到淫羊藿发挥作用的有效单体成分,为临床治疗气管切开后引起的肺部疾病提供有力的实验依据。
1 材料与方法
1.1材料 ICA、ICS-Ⅱ(上海源叶生物科技有限公司,HPLC 98%),sIgA、大鼠IL-6酶联免疫检测试剂盒(武汉华美生物工程有限公司),荧光标记单克隆抗体(美国BD公司),流式细胞仪(美国BD公司FACSCalibur型)。
1.2方法
1.2.1实验动物与分组 SD大鼠,体重(250±20)g,雄性,SPF级[广西医科大学实验动物中心提供,合格证号:SCXK(桂)2014-0002]。随机分成正常对照组(A)、模型对照组(B)及模型治疗组(C、D),每组18只。饲养环境温度为(20±2)℃,湿度60%,自由进水,普通饲料喂养。
1.2.2模型制备与给药 参照文献[4]制备B、C、D组大鼠气管切开插管模型。动物模型制作成功后6 h进行给药干预。C组给予ICS-Ⅱ4 mg/(kg·d)、D组给予ICA 30 mg/(kg·d)灌胃,A、B 组给予等量0.9%生理盐水,每日1 次。
1.2.3取材 给药后第24、72、168小时,各组分别取材6只大鼠。用10%(0.35 ml/100 g)水合氯醛腹腔麻醉后,剖开腹腔,经腹主动脉分别采血2 ml置于肝素抗凝管中(用于测定T细胞亚群)、3~4 ml置于普通非抗凝管中(用于测定血清IL-6含量)。 采集完外周血后立即剖开胸腔,用止血钳夹闭右主支气管,用4℃预冷灭菌0.9%生理盐水3 ml反复灌洗肺部3次,共回收肺泡灌洗液约6 ml(用于测定sIgA、IL-6含量)。
1.2.4外周血T细胞亚群检测 严格按照试剂说明书加样后,上机检测。用专业流式数据分析软件 FlowJo 计算CD4+T、CD8+T细胞数量及CD4+/CD8+数值。
1.2.5肺泡灌洗液IL-6、sIgA及血清IL-6检测 均严格按照试剂盒说明书操作。 用专业软件CurveExpert 13.0计算每个样本的浓度。
2 结果
2.1大鼠外周血CD4+T细胞亚群 结果见图1、表1。 B组大鼠气管切开插管后外周血CD4+T细胞亚群数量无明显变化。C、D两组与B组相比,C组在168 h明显高于B组(P=0.043),D组在72 h、168 h明显高于B组(P=0.016、0.001)。D组在168 h明显高于C组(P=0.006),C、D两组组内各时段相比,C组无明显变化,D随着时间延长逐渐升高。这些结果提示,ICS-Ⅱ和ICA均可提高外周血CD4+T细胞亚群数量,且ICA效果优于ICS-Ⅱ,以168 h最显著。
2.2大鼠外周血CD8+T细胞亚群 结果见图1、表2。 B组气管切开插管大鼠CD8+T细胞亚群数量开始明显降低,168 h与A组相比无明显差异。C、D两组与B组相比,C组在72 h、168 h明显低于B组(P=0.034、0.006);D组与B组无明显变化。D组在72 h明显高于C组(P=0.030)。C、D两组组内各时段相比,C组以72 h降低最明显(P=0.001),D组各时段无明显差异。这些结果提示,ICA和ICS-Ⅱ均可降低外周血T细胞亚群CD8+含量。
2.3大鼠外周血CD4+/CD8+T细胞亚群 结果见图1、表3。B组气管切开大鼠外周血T细胞亚群CD4+/CD8+在24 h、168 h与A组相比无明显差异。C组在24 h明显高于A组(P=0.018),在168 h CD4+/CD8+值虽有降低,但差异无统计学意义;且与B组相比差异无明显统计学意义。D组在168 h明显高于A、B、C 3组(P=0.000、0.000、0.001)。C组组内各时段无明显差异;D组168 h明显高于24 h、72 h(P=0.001、0.005)。这些结果提示,ICA和ICS-Ⅱ均可提高气管切开大鼠外周血CD4+/CD8+T细胞亚群的比值,且ICA效果优于ICS-Ⅱ。
2.4大鼠外周血IL-6含量 结果见表4。B组气管切开插管后大鼠外周血IL-6含量在72 h明显降低(P=0.003)。C、D两组IL-6含量在3个时段均明显低于A、B组(P<0.05)。D组在168 h明显低于C组(P=0.031)。C、D两组组内各时段IL-6含量无明显变化。这些结果提示,ICS-Ⅱ和ICA均可抑制气管切开插管后大鼠外周血IL-6表达,且ICA效果优于ICS-Ⅱ,以168 h最显著。
2.5大鼠肺泡灌洗液IL-6含量 结果见表5。 B组气管切开插管后肺泡灌洗液IL-6含量在3个时段均明显高于A组(P=0.003、0.000、0.003)。 C、D两组与B组相比, 在72 h、 168 h时段明显低于B组,且呈逐渐降低趋势(P<0.05),D组与C组相比无明显差异。这些结果提示,ICS-Ⅱ和ICA均可抑制气管切开插管后大鼠肺泡灌洗液IL-6表达,且二者作用效果无明显差异。

图1 各组外周血CD4+、CD8+T细胞亚群Fig.1 Peripheral blood CD4+,CD8+T cells in each group
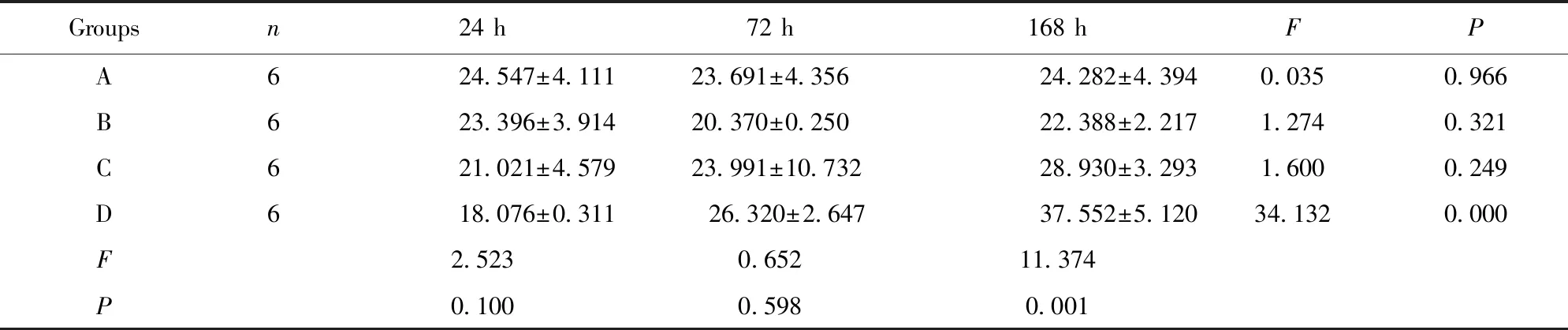
Groupsn24 h72 h168 hFPA624.547±4.11123.691±4.35624.282±4.3940.0350.966B623.396±3.91420.370±0.25022.388±2.2171.2740.321C621.021±4.57923.991±10.73228.930±3.2931.6000.249D618.076±0.311 26.320±2.64737.552±5.12034.1320.000F2.5230.65211.374P0.1000.5980.001
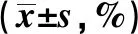
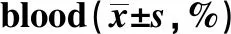
Groupsn24 h72 h168 hFPA613.511±2.03413.259±2.67313.786±1.9370.0350.966B69.501±2.2597.873±0.12414.700±2.9028.4280.011C68.283±1.5114.993±0.0969.095±0.53119.1830.000D69.280±1.2378.416±2.56211.559±1.0213.0340.105F8.15012.8897.230P0.0020.0010.009
2.6大鼠肺泡灌洗液sIgA含量 结果见表6。 B组气管切开插管后大鼠肺泡灌洗液sIgA含量24 h即明显升高(P=0.006),但在72 h后又降至正常组水平;C、D两组在72 h、168 h明显高于B组(P<0.05);D组在24 h、168 h两个时段明显高于C组(P<0.05)。这些结果提示,ICS-Ⅱ和ICA均可提高气管切开插管后大鼠肺泡灌洗液sIgA含量,且ICA效果优于ICS-Ⅱ,以24 h、168 h最显著。
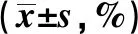
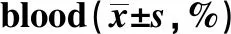
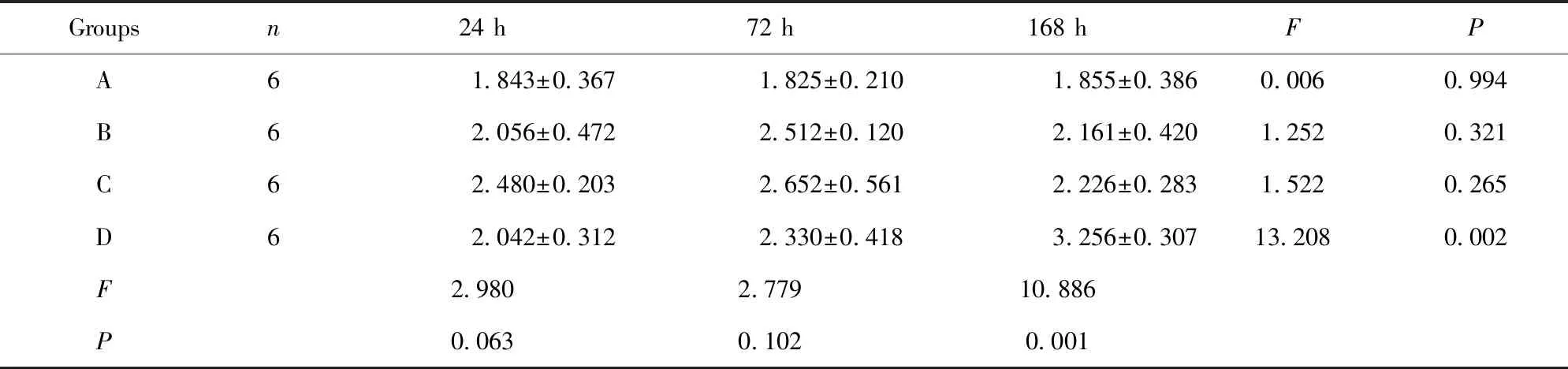
Groupsn24 h72 h168 hFPA61.843±0.3671.825±0.2101.855±0.3860.0060.994B62.056±0.4722.512±0.1202.161±0.4201.2520.321C62.480±0.2032.652±0.5612.226±0.2831.5220.265D62.042±0.3122.330±0.4183.256±0.30713.2080.002F2.9802.77910.886P0.0630.1020.001
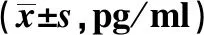
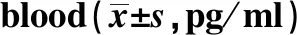
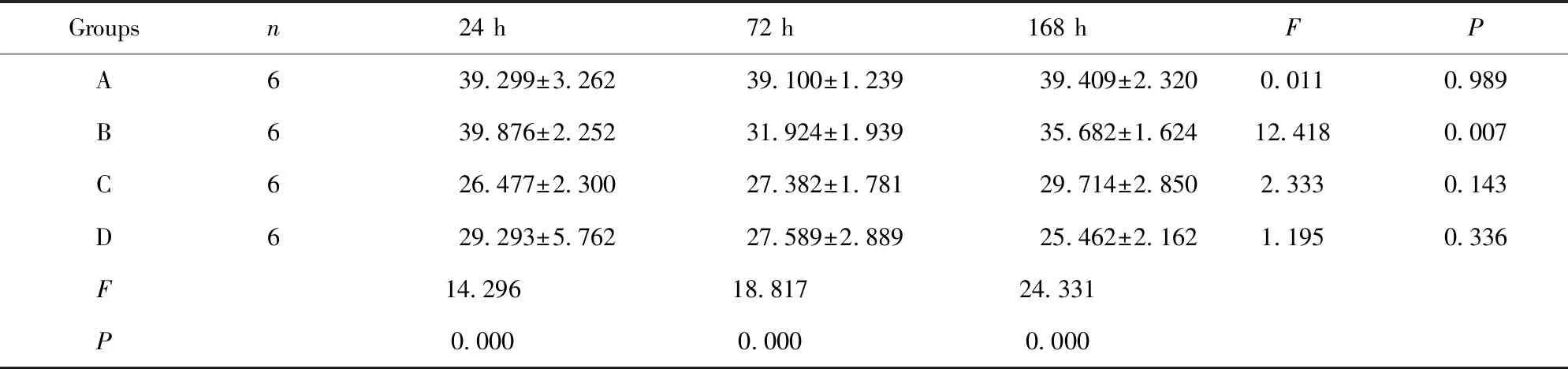
Groupsn24 h72 h168 hFPA639.299±3.26239.100±1.23939.409±2.3200.0110.989B639.876±2.25231.924±1.93935.682±1.62412.4180.007C626.477±2.30027.382±1.78129.714±2.8502.3330.143D629.293±5.76227.589±2.88925.462±2.1621.1950.336F14.29618.81724.331P0.0000.0000.000
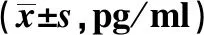
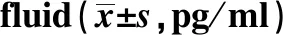
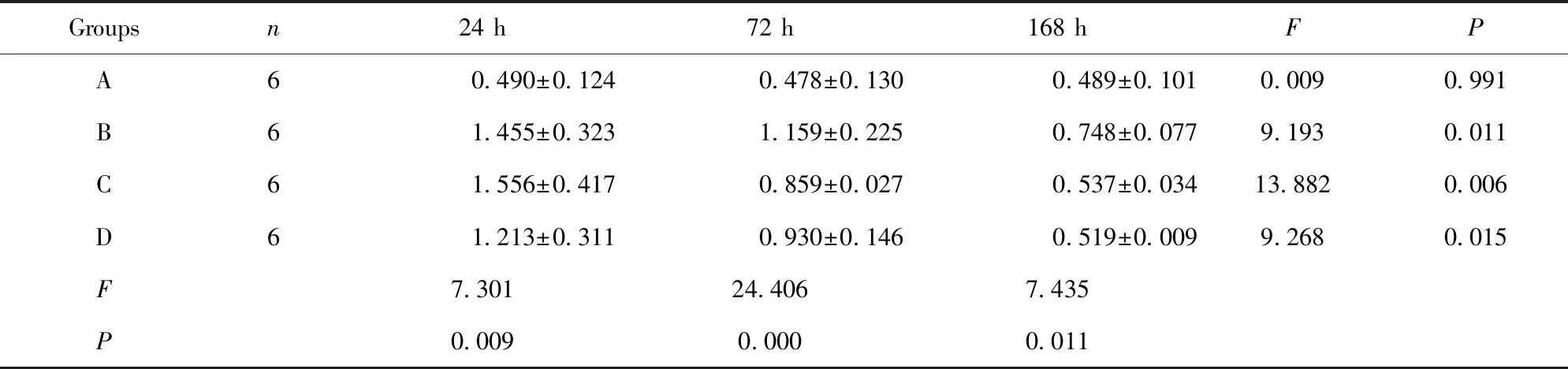
Groupsn24 h72 h168 hFPA60.490±0.1240.478±0.1300.489±0.1010.0090.991B61.455±0.3231.159±0.2250.748±0.0779.1930.011C61.556±0.4170.859±0.0270.537±0.03413.8820.006D61.213±0.3110.930±0.1460.519±0.0099.2680.015F7.30124.4067.435P0.0090.0000.011
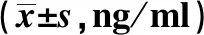
Groupsn24 h72 h168 hFPA63.886±1.6443.278±1.2383.641±1.0850.1540.861B68.328±2.2114.185±1.7843.243±1.1299.8980.005C69.561±1.56929.168±5.20811.232±5.26226.4860.000D618.240±6.63427.903±2.80618.530±1.6954.3600.059F10.32158.71421.180P0.0010.0000.000
3 讨论
《类证治裁》记载:“肺为气之主,肾为气之根,肺主出气,肾主纳气,阴阳相交,呼吸乃和。”说明肾脏在肺部疾病发生、发展过程中有着极其重要的影响。肾气不足,摄纳无权,肺之清气不能肃降以下通于肾,气之升降出入不利,肺肾两虚,从而导致肺系疾病的急性发作或病情进展。因此肾脏在肺部疾病发生、发展过程中有着极其重要的影响。气管切开插管易并发肺部疾病,既往我们研究发现补肾阳中药淫羊藿水提取物可改善气管切开大鼠免疫功能[3]。而中药淫羊藿发挥作用的主要活性成分是以ICA为代表的黄酮苷类化合物及其体内代谢产物[5]。ICS-Ⅱ为ICA经肠道菌群代谢后产生的主要代谢产物之一。故本实验基于ICA和ICS-Ⅱ探讨淫羊藿对气管切开大鼠发挥主要作用的有效成分。
细菌或病毒侵入机体后,可以引起体液免疫应答和细胞免疫应答,其中T细胞介导的细胞免疫应答在清除细菌或病毒等外源微生物中具有重要意义。T细胞根据其表达分子的不同可以分为CD4+T细胞和CD8+T细胞。CD4+T 细胞主要为辅助性T细胞(Th),又可分为Th1细胞和Th2细胞,其中Th2细胞可分泌IL-6、IL-10等细胞因子,主要为辅助体液免疫应答;而CD8+T细胞主要为抑制性T细胞和杀伤性T细胞,正常情况下,CD4与CD8细胞保持一定的比例,维持机体的细胞免疫功能。所以外周血CD4+和CD8+T细胞亚群的百分率以及CD4+/CD8+可作为评价机体免疫状态的指标[6,7]。本实验研究发现ICA和ICS-Ⅱ干预后,可明显提高各组CD4+T细胞数量及CD4+/CD8+,ICS-Ⅱ可降低CD8+T细胞数量而ICA对其无明显影响。表明ICA和ICS-Ⅱ可通过平衡各细胞亚群比例,提高CD4+/CD8+值,从而提高机体的免疫水平。且ICA效果优于ICS-Ⅱ,尤以168 h最显著。
细胞免疫除了与T细胞亚群及其比例有关,细胞因子的变化也在其中发挥重要作用[8]。而细胞因子则有调控T细胞分化的功能[9]。IL-6是一种由T细胞、单核细胞、成纤维细胞等产生的多效细胞因子。Sean等[10]用伯氏疏螺旋体感染C3H小鼠,然后注射IL-6,发现IL-6可抑制Th1细胞的分化。本实验研究发现,用ICA和ICS-Ⅱ干预后,C、D两组外周血及肺泡灌洗液IL-6含量均明显降低(P<0.05)。根据Sean等[10]研究提示,ICA和ICS-Ⅱ提高气管切开大鼠外周血CD4+T细胞数量与CD4+/CD8+值的机制,可能与抑制外周血及肺泡灌洗液IL-6表达有关,从而起到抑制炎症和增强细胞免疫的作用。
sIgA存在于体液免疫中,是呼吸道黏膜的主要保护性抗体,是黏膜免疫的第一道防线,可以阻止细菌和病毒吸附于上皮细胞表面不形成集落,发挥清除细菌、中和病毒和抑制病毒复制的作用[11]。Diebel等[12]向单核细胞中加入大肠杆菌和sIgA 并共同培养1 h,再与多形核中性粒细胞共培养,最后测定促炎因子IL-6、TGF-β和IL-8的含量。结果发现该方法与不加入sIgA 的培养方法相比,促炎因子 IL-6、TGF-β和IL-8的含量明显降低。本实验研究发现,用ICA和ICS-Ⅱ干预后,肺泡灌洗液sIgA含量明显升高(P<0.05),且ICA干预组在24 h、168 h两个时段明显高于ICS-Ⅱ干预组。结合Sean及Diebel等[10,12]研究结果可以推断,ICA和ICS-Ⅱ可以通过促进肺泡灌洗液sIgA表达,抑制外周血及肺泡灌洗液IL-6表达,并改善T细胞亚群失衡,从而提高肺部免疫水平,同时减轻炎性反应,且ICA效果优于ICS-Ⅱ。
本实验研究发现ICA对气管切开大鼠提高免疫和减轻炎症的效果优于ICS-Ⅱ,其机制可能与药物本身活性有关,Cheng等[13]研究发现ICA和ICS-Ⅱ具有不同药代动力学特性,具体药理活性作用机制,有待进一步研究。