HER2基因状态与晚期肺腺癌患者一线培美曲塞联合铂类化疗疗效的关系
2019-09-03李盼华李班班史云舒张凤鸣申淑景李醒亚
李盼华 李班班 史云舒 张凤鸣 申淑景 李醒亚
肺癌是发病率和死亡率最高的恶性肿瘤,全球每年约有180万的新发肺癌患者,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的85%[1,2]。NSCLC进一步分型为腺癌、鳞癌和大细胞癌,早期NSCLC患者可选择手术治疗,但大部分患者确诊时已属晚期,错失手术机会,因此化疗和分子靶向治疗是目前晚期NSCLC患者的主要治疗选择。
人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)属于HER蛋白家族之一,HER蛋白家族其他成员包括HER1、HER3和HER4[3]。HER2基因异常包括HER2激酶结构域突变、蛋白过表达和拷贝数增加。研究[4]表明,与HER2蛋白过表达和拷贝数增加相比,HER2突变是NSCLC的分子生物标记物之一。14年前Stephens等[5]首次报道了肺癌HER2激酶结构域突变,但HER2突变在NSCLC的预测意义及HER2突变与化疗疗效之间的关系存在争议。一项国内回顾性研究[6]显示,一线以培美曲塞为基础的化疗在晚期HER2突变NSCLC患者的无进展生存期(progression-free survival, PFS)劣于ALK/ ROS1重排的患者。本研究旨在进一步探讨在晚期肺腺癌患者中HER2基因状态和一线培美曲塞联合铂类化疗疗效及PFS之间的关系,为临床提供指导。
1 资料和方法
1.1 病例选择 入组标准:①根据第七版肺癌肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期标准证实的EGFR、ALK、ROS-1、KRAS、BRAF、RET、MET均为阴性的IV期肺腺癌患者,初治选用培美曲塞联合铂类的一线双药化疗;②化疗期间未接受同步或序贯放疗或其他抗肿瘤治疗;③根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1至少有1个可评价病灶,化疗期间至少2个周期进行一次影像学评估[胸加上腹部计算机断层扫描(computed tomography, CT)加或不加头颅磁共振成像(magnetic resonance imaging, MRI)]。
1.2HER2基因检测方法 使用Sanger测序或二代测序(next generation sequencing, NGS)方法确认HER2基因突变状态。
1.3 疗效评价与随访 应用化疗2个周期后评价,疗效根据RECIST 1.1标准判定,分为完全缓解(complete response,CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)=(CR+PR)/(CR+PR+SD+PD)×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。获得CR或PR的患者4周或以后确认。PFS定义为从化疗第一天至首次记录的疾病进展或死亡时间。采用电话和门诊方式进行随访,随访截止至2018年10月31日。
1.4 统计学方法 采用GraphPad Prism 7.0软件分析。分析HER2基因状态、临床特征与化疗疗效之间的关系采用卡方检验或Fisher精确检验。生存分析采用Kaplan-Meier法进行分析并进行Log-rank检验,采用Cox回归进行PFS的多因素分析。所有统计学检验均为双侧概率检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 回顾性分析2016年1月-2018年8月在郑州大学第一附属医院经组织学或细胞学确诊的125例EGFR、ALK、ROS-1、KRAS、BRAF、RET、MET均为阴性的IV期肺腺癌患者的临床资料。所有患者均进行了HER2基因检测。寡转移定义为治疗前转移灶数≤5个。培美曲塞均为国产用药,按500 mg/m2的剂量给予,联合铂类药物均为国产用药,包括顺铂、卡铂、奈达铂,分别按75 mg/m2、AUC 5×(GFR+25)mg和75 mg/m2的剂量给予,双药化疗4个-6个周期,每21天为1个周期。若无疾病进展,继续采用培美曲塞维持治疗,每28天为1个周期。为减少药物不良反应,所有患者接受叶酸、维生素B12和地塞米松预处理。排除随访丢失的患者,106例患者纳入此研究,其中男性63例,女性43例,年龄31岁-78岁,中位年龄为59岁;一线化疗中位化疗周期数为5个(1个-14个);其中35例患者接受了培美曲塞维持治疗,维持周期数为1个-8个。
2.2HER2基因状态与临床病理特征之间的关系HER2突变患者32例(30.2%),年龄31岁-71岁,中位年龄为55岁;HER2野生型患者74例(69.8%),年龄34岁-78岁,中位年龄为60岁。HER2突变状态与年龄、性别、吸烟史相关,与是否寡转移无关。HER2突变在<65岁、女性、不吸烟的患者中更多见(表1)。
2.3HER2基因状态与化疗疗效之间的关系 106例患者均有可评价病灶。其中CR 0例(0%),PR 24例(22.6%),SD 57例(53.8%),PD 25例(23.6%),ORR为22.6%,DCR为76.4%。HER2突变肺腺癌患者的ORR和DCR均高于HER2野生型患者(40.6%vs14.9%, χ2=8.464,P=0.004; 93.8%vs68.9%, χ2=6.327,P=0.012),差异有统计学意义(表1)。
2.4HER 2突变亚型与化疗疗效之间的关系 32例H E R 2突变肺腺癌患者的具体突变亚型包括:p.A775_G776insYVMA(n=17);p.M774_A775insAYVM(n=7);p.G776delinsVC(n=4);V659E(n=1);p.P780_Y781insGSP(n=1);p.L755A(n=1); p.L755P(n=1)。p.A775_G776insYVMA突变亚型患者的ORR和DCR均高于其他HER2突变亚型患者(52.9%vs26.7%,χ2=2.281,P=0.131; 94.1%vs93.3%, χ2=0.008,P=0.927),差异无统计学意义。
2.5HER2基因状态及突变亚型与PFS之间的关系 单因素分析结果显示,有无脑转移、有无维持化疗和HER2基因状态是影响PFS的重要因素,而PFS与年龄、性别、是否有吸烟史、是否寡转移、有无肝转移及铂的种类无关(表2)。将有无肝转移、有无脑转移、有无维持化疗和HER2基因状态纳入多因素分析研究对象,结果显示PFS与有无肝转移、有无脑转移、有无维持化疗均无关,HER2突变是PFS的正性独立预后因素(P=0.038)(表3、图1)。对HER2突变亚型进行单因素分析结果显示,p.A775_G776insYVMA突变患者的中位PFS为8.2个月,其他突变亚型的PFS为7.2个月,二者PFS差异无统计学意义(χ2=0.557,P=0.455)(图1)。
3 讨论
HER2突变在NSCLC中发生率为1%-4%,在EGFR、ALK、KRAS均为阴性的选择人群中HER2突变率为6%,多数HER2突变在20号外显子发生插入突变,最常见的突变亚型是p.A775_G776insYVMA突变,该突变亚型是在20号外显子的第776位密码子YVMA序列处重复或插入12个碱基对,导致PI3K-AKT和MEK-ERK通路的下游活化,从而促进细胞的增殖[7-9]。本研究中,HER2突变在EGFR、ALK、ROS-1、KRAS、BRAF、RET、MET均为阴性的患者中占30.2%,国内外尚未有研究报道HER2突变在上述7种基因均为阴性的患者中的发生率。考虑该研究属于小样本研究,可能存在抽样偏差等因素,这一结果有待未来的大样本、多中心研究进一步证实。HER2突变在本研究中显示出独特的临床特征,多见于年轻、不吸烟的女性患者,与之前研究[6,8-10]报道相符。
虽然HER2突变未来可能成为NSCLC靶向治疗的新靶点,但近20年来的研究仍未确定疗效确切的抗HER2分子靶向治疗药物。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南因为曲妥珠单抗和阿法替尼治疗缓解率低,已将二者从HER2突变NSCLC患者的治疗建议中删除[11]。拉帕替尼、来那替尼和达克替尼则在多项研究中显示出了更差的治疗效果[12-15]。近期有数据[16,17]显示阿多曲妥珠单抗依酯(ado trastuzumabemtansine, T-DM1)和波齐替尼在HER2突变晚期NSCLC患者中有较好的治疗效果,TDM-1靶向治疗HER2突变患者的ORR为44%,中位PFS为5个月;波齐替尼的ORR为54.5%,中位PFS为6.2个月。但目前TDM-1和波齐替尼均未在中国上市,患者获得药物有一定难度,且一线使用TDM-1或波齐替尼或化疗孰优孰劣尚不明确,因此大多数HER2突变肺腺癌患者一线治疗以化疗为主,其中最常见的化疗方案为培美曲塞联合铂类。

表 1 HER2基因状态与临床特征的关系Tab 1 Relationships between HER2 gene status and clinical characteristics
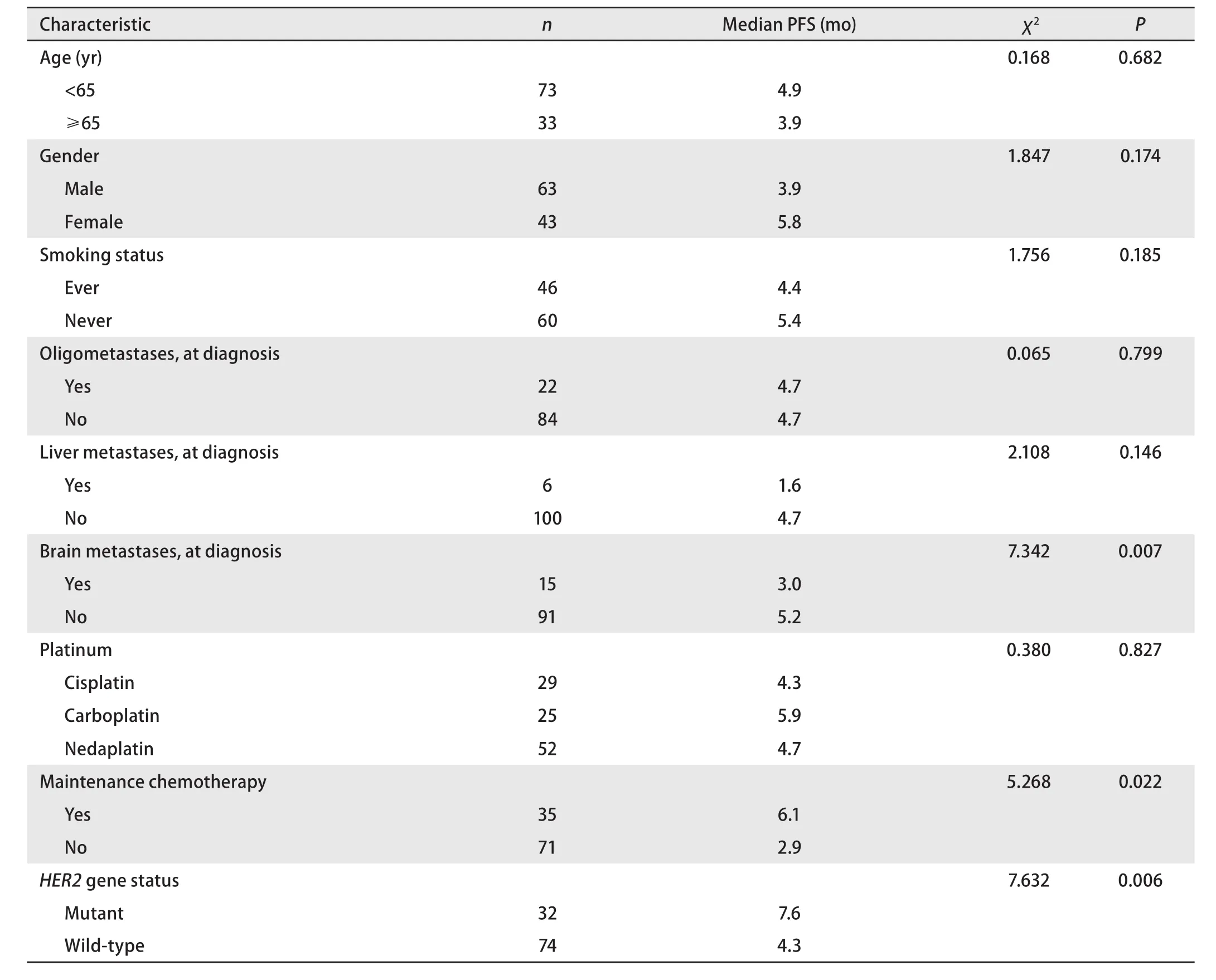
表 2 106例患者临床特征与预后关系的单因素分析Tab 2 Single factor analysis of the relationship between clinical features and prognosis-free survival (PFS) of 106 cases
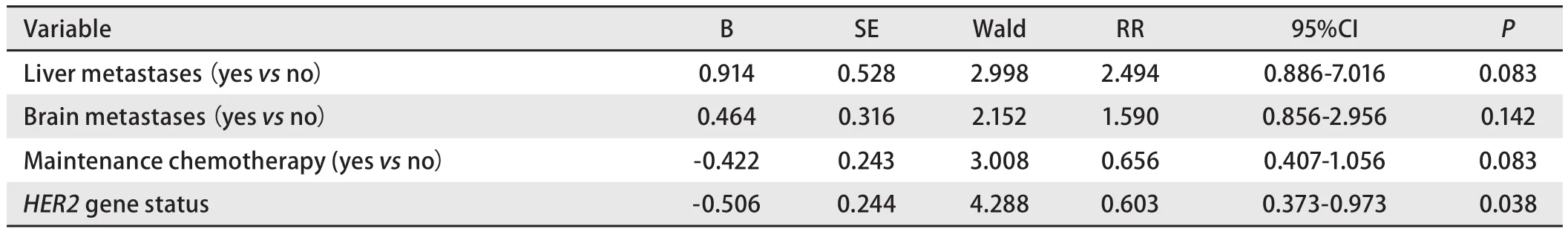
表 3 多因素生存分析Tab 3 Multivariate survival analysis

图 1 生存曲线。A:HER2突变与HER2野生型肺腺癌患者PFS曲线比较;B:p.A775_G776insYVMA与其他突变亚型PFS曲线比较。Fig 1 Survival curve of the patients.A: Comparison of PFS in HER2-mutatant with HER2 wild-type lung adenocarcinoma patients; B: Comparison of PFS in the p.A775_G776insYVMA group with the other variants group.PFS: progression-free survival.
Tsai等[18]通过Northern印记分析发现,HER2基因过表达的NSCLC与多种化疗药物的原发性耐药相关。之后国内一项研究[19]显示,肺腺癌培美曲塞的继发性耐药可能与HER2表达上调有关,耐药机制可能是通过增强DNA修复活性、促进细胞增殖和抗凋亡发挥作用。而HER2突变状态是否影响培美曲塞化疗的疗效尚不明确。2016年,Eng等[20]研究报道18例携带HER2突变的IV期肺腺癌患者应用含培美曲塞方案一线化疗的中位持续时间为8.8个月。与Eng等研究不同的是,本研究通过评估患者影像学的改变并根据RECIST 1.1进行疗效判定,排除了由于化疗无法耐受或患者主观意愿而中止化疗等影响,从而获得较为客观的疗效评价结果和PFS数据。Wang等[6]在晚期肺腺癌患者一线使用含培美曲塞化疗疗效的研究中发现,HER2突变患者的PFS与KRAS突变的PFS相似(5.1个月vs5个月,P>0.05),劣于ALK/ROS1重排患者(5.1个月vs9.2个月,P<0.05)和EGFR突变患者(5.1个月vs6.5个月,P>0.05)。本研究中,HER2突变患者的ORR和DCR分别为40.6%和93.8%,PFS为7.4个月,均优于Wang等[6]的研究结果,分析可能与Wang等[6]的研究中部分患者初始使用培美曲塞单药化疗,且多数患者未进行后续维持化疗相关。本研究也对HER2突变亚组间进行了分析,结果显示p.A775_G776insYVMA突变者的PFS优于其他突变亚型患者,与Wang等[6]研究报道不符,有待进一步研究探索。本研究评价远期化疗疗效时只对PFS数据进行了分析,未分析这一人群的总生存时间(overall survival, OS)数据,原因在于患者的二线及后续治疗情况各异,鉴于回顾性研究本身存在的局限性,HER2基因状态是否与接受一线培美曲塞联合铂类化疗患者的OS相关,需要进一步前瞻性研究进行深入探讨。
综上所述,在晚期肺腺癌患者的一线培美曲塞联合铂类化疗中,HER2突变患者的ORR、DCR和PFS均优于HER2野生型患者,提示相比HER2野生型肺腺癌患者,HER2突变患者一线应用培美曲塞联合铂类的化疗有更大的临床获益。
