良性前列腺增生与前列腺慢性炎症的相关性研究进展*
2019-09-03薛晓文李嘉宾
蒋 茂,薛晓文,程 伟,李嘉宾**
中国药科大学 1理学院;2药学院,南京 211198;3萧山第一人民医院 泌尿外科,杭州 311200
良性前列腺增生(BenignProstaticHyperplasia,以下简称BPH)是中老年男性中最常见的泌尿系统疾病之一,在50多岁的男性中患病率为42%,在80岁以上的男性中患病率达到80%[1]。BPH是一种慢性疾病,开始于微小结节增生,演变为肉眼可见的小结节增大,在临床上逐渐发展为良性前列腺肥大(BPE)或梗阻(BPO),是男性下尿路症状(LUTS)的最常见病因[2]。BPH会导致男性排尿功能异常,生活质量下降,尿路感染(UTI)和急性尿潴留(AUR)的风险增加,病情严重时需要手术治疗[2]。尽管前列腺增生组织的形成机制在细胞及分子水平上尚未阐明,但交感神经活动的增加、激素水平的改变以及与衰老相关的组织重构等变化,已被认为是前列腺内稳态失调的关键因素[3]。此外,一些证据也强调了代谢综合征在BPH-LUTS发病机制和进展中可能发挥的作用[4,5]。自1937年以来,许多研究者试图揭示良性前列腺增生与前列腺慢性炎症之间的联系。研究发现,细胞、生长因子复杂网络的改变与前列腺慢性炎症有关,并由此引起组织的损伤和缓慢愈合,这一过程可能会持续刺激前列腺上皮和基质细胞的增殖,进而导致BPH[5]。由此一些研究者认为,BPH可能是一种免疫介导的炎症疾病[6]。
本文通过总结良性前列腺增生与前列腺慢性炎症的相关性的临床研究,分析前列腺免疫细胞对其病理生理机制的影响,以及抗炎药物对BPH-LUTS的作用,以期BPH-LUTS的药物研发提供新参考。
1 相关性的临床证据
临床研究表明,BPH与前列腺慢性炎症之间存在着显著的相关性。DeNunzioC等[7]在调研了多组有关BPH临床研究报告后发现,在不同程度的BPH患者的前列腺活体组织检查和手术标本中,都发现了慢性组织炎症的存在。为了说明前列腺慢性炎症的广泛性,及其与BPH的相关性,Zlotta AR等[8]对100名亚洲男性和320名白种人男性的尸体进行解剖研究,结果显示,在两个群体中,超过70%的尸检标本都能观察到慢性炎症;而在多变量分析中,慢性炎症患者患BPH的概率比未见炎症浸润的患者患病率高出近7倍。此外,RoehrbornC等[9]研究发现,与慢性炎症患者相比,没有慢性炎症的BPH患者的临床病理进展较为缓慢。
上述临床研究结果表明,BPH和前列腺慢性炎症之间确实存在关联,有必要从细胞水平和分子水平,对两者病理生理机制上的联系,开展进一步的研究。
2 病理生理机制的联系
BPH的发生和发展与前列腺慢性炎症密切相关,两者之间具体的作用机制尚未完全阐明。有研究指出,前列腺免疫细胞在两者关联中起到关键作用[10]。以下分别从前列腺慢性炎症与前列腺免疫细胞、前列腺免疫细胞与BPH等两方面入手,阐释两者之间的内在关联。
2.1 前列腺慢性炎症与前列腺免疫细胞
在前列腺中存在着复杂的免疫系统。腺体内90%以上的免疫细胞是T淋巴细胞,一般以CD8+亚型居多。也存在少量的其他炎性细胞,如B淋巴细胞、巨噬细胞和肥大细胞[11]。这些免疫细胞的组成成分和分布情况,在慢性炎症状态与健康状态下,存在显著的差异,详见表1。
近期研究表明,前列腺上皮和基质细胞不仅表达细胞因子受体,而且作为抗原呈递细胞(APCs)积极参与局部免疫应答的调节[12]。前列腺上皮细胞广泛表达Toll样受体 (包括TLR-2、TLR-4、TLR-5、TLR-7 和 TLR-9), 并产生主要组织相容性复合体II类(MHC-II)分子,此外还分泌重要的促炎细胞因子,如单核细胞趋化蛋白-1(MCP-1)、缺氧诱导因子-1α(HIF-1α)、白细胞介素 IL-6和 IL-18等。前列腺基质细胞在其膜上除表达MHC-II分子以外,还产生共刺激分子(CD80、CD86、CD40、CD134L), 这些共刺激分子可以受炎症刺激而上调[13]。

表1 前列腺免疫系统在健康和慢性炎症两种状态下的区别[7]
研究表明,那些激活了不同分子途径的刺激物,是前列腺免疫系统调节异常和炎性浸润发生的诱因[12,14]。首先,病毒作为一类主要的刺激物,可能引发促炎症反应,如人乳头瘤病毒、2型单纯疱疹病毒、巨细胞病毒等。其次一些通过性传播的生物体,如沙眼衣原体、梅毒螺旋体、淋病奈瑟氏球菌,以及大肠杆菌等革兰阴性病原体,也会引起促炎症反应[12,15]。第三,是由尿液返流引起的化学刺激。尿液中含有由濒死细胞释放的尿酸结晶,尿液返流后,尿酸结晶可以直接刺激天然免疫细胞、广泛表达半胱天冬酶-1-活化冷联蛋白,并由此引起炎症反应。这一过程可能会导致腺泡内结晶的生成,从而产生腺管阻塞,进一步维持炎症[12,16]。最后,代谢综合征也可以诱导前列腺中的促炎细胞因子、炎症递质和生长因子的分泌,进而导致过度的增殖反应。无论引发炎症反应的机制如何,其结果是前列腺中免疫细胞的组织定位和组成成分发生了广泛改变[12,16,17]。
2.2 前列腺免疫细胞与BPH
前列腺免疫细胞的异常活跃及免疫系统的失调,与BPH-LUTS的发展之间存在显著相关性。为阐明该相关性的具体机制,已开展了许多研究工作,特别是:T-helper 1(TH1)和 T-helper 2(TH2)淋巴细胞的活化,以及一些重要的细胞因子和生长因子的释放,与BPH的发生和发展密切相关[18]。相关细胞因子、生长因子的分泌途径及其在BPH中的作用见表2。
IL-17是T细胞诱导的炎症反应的早期启动因子,可以通过促进释放前炎性细胞因子来放大炎症反应。在BPH的发展中IL-17是关键细胞因子,它的浓度在健康组织中可忽略不计,但在BPH患者的前列腺中浓度显著增大[18]。IL-17主要由T淋巴细胞和前列腺上皮细胞分泌。IL-17可以激活NF-κB通路,调节IL-6、IL-8和IL-1在上皮细胞、内皮细胞和基质细胞中的表达[19]。它能够引发BPH的T淋巴细胞释放肿瘤坏死因子 α(TNFα)、干扰素 c(IFNc)、IL-5 和 IL-10,并上调巨噬细胞和上皮细胞COX-2的表达[19]。此外,在小鼠模型中发现,IL-17的分泌也因氧化应激和衰老而增加,而这两个过程通常与BPH有关[20]。
转化生长因子β(TGFβ)家族在BPH基质细胞增殖和分化中具有重要作用。Descazeaud A 等[21]研究了231例BPH患者前列腺中的TGFβ受体Ⅱ蛋白(TGFBRⅡ)的表达,发现在基质和腺体中,TGFBRⅡ的表达与CD4+T淋巴细胞浸润有关,与前列腺体积无关,其数据还表明,细菌感染和前列腺炎症可诱导上皮细胞中雄激素反应基因的表达增加,并激活基质中的TGFβ-1级联基因。此外,在发炎的前列腺组织中观察到:巨噬细胞浸润会刺激上皮细胞分泌TGFβ-2[22]。TGFβ-2和HIF-1α均参与上皮间质转化(EMT)的生物学过程。EMT是一种生理过程,其中上皮细胞获得基质细胞的运动特征。在此过程中,上皮标志物(如E-钙粘蛋白)减少,基质标志物和转录因子(如N-钙粘蛋白、波形蛋白)增加。随后越来越多的基质细胞与浸润的巨噬细胞之间发生相互作用,CCL3分泌增加,从而促进基质细胞的进一步增殖。这种机制可以解释在BPH中观察到的基质:上皮细胞比例改变的现象(从健康前列腺中的 2∶1 到 BPH 中的 5∶1)[23]。

表2 BPH、LUTS中的细胞因子和生长因子[7]
前列腺上皮细胞能够响应几种炎性刺激的反应,分泌IL-18。由巨噬细胞和树突状细胞分泌的细胞溶质蛋白复合物(称为“炎性体”)响应不同的危险信号(例如细菌抗原、病毒蛋白、尿酸结晶、活性氧等),将pro-IL-18切割成成熟形式,并进一步增加免疫细胞的分泌[23]。此外,IL-18本身可以直接影响前列腺基质细胞增殖[24]。
IL-8和MCP-1在复杂的前列腺炎症细胞因子级联中也具有重要作用[18]。在BPH组织中,IL-8由上皮细胞和基质细胞主动分泌,用来响应由TH1和TH17细胞产生的促炎细胞因子IFNc和IL-17。反过来,IL-8会吸引表达趋化因子受体CXCR1和CXCR2的淋巴单核细胞进入前列腺中。IL-8可以刺激衰老上皮细胞的增殖,并使基质细胞获得肌成纤维细胞反应性表型,还会间接促进成纤维细胞生长因子(FGF-2)的分泌,从而诱导前列腺基质和上皮细胞的过度生长。
单核细胞趋化蛋白(MCP-1)是前列腺中分泌最多的蛋白质之一,主要由基质细胞分泌。此外,上皮细胞被IL-1b、IFNg和IL-2刺激后,也可以分泌高水平的MCP-1。目前研究发现,上皮细胞和基质细胞均表达MCP-1受体(CCR2)。MCP-1与其受体CCR2之间相互作用,反过来通过旁分泌或自分泌途径刺激上皮细胞的生长。在前列腺中,MCP-1浓度升高和促炎细胞因子(T-淋巴细胞、IL-6、IL-8和IL-5)的增加也可能进一步诱导炎症的发生,从而促成正反馈环,诱发BPH。当T淋巴细胞的密度达到某个阈值时,周围的细胞将成为CD8+细胞毒性T细胞的靶标而被杀死,留下被纤维肌性结节取代的空位[12]。
局部缺氧是炎症递质产生的进一步刺激,可产生低水平的活性氧(ROS),促进新血管生成和成纤维细胞向肌成纤维细胞的转化[12]。在体外低氧条件下的人体前列腺组织中,可以观察到生长因子如成纤维细胞生长因子 (FGF-7)、TGFβ、FGF-2和IL-8的分泌增加[25]。此外,作为对缺氧的反应,前列腺基质细胞会上调几种生长因子的分泌,特别是FGF-7、TGFβ、FGF-2 和 IL-8,这有助于前列腺的生长[12]。
概括而言,前列腺免疫细胞通过释放细胞因子、生长因子等免疫调节剂,在调控前列腺基质和上皮细胞对内、外部刺激的反应上具有重要作用。炎性细胞活性增加可能会导致基质和上皮细胞的过度增殖,炎性组织损伤与周期性创面修复可能会最终导致BPH结节的发生和发展。
2.3 小结
前列腺是具有免疫功能的器官,腺体内存在着复杂的免疫系统,可以确保泌尿生殖道的无菌状态并预防对自身抗原的免疫反应。如图1所示,第一部分,包括代谢综合征、衰老、尿液返流、感染因子在内的几种刺激,通过激活不同的分子途径引起前列腺免疫系统的失调,导致前列腺慢性炎症。第二部分,免疫细胞的持续激活,细胞因子和生长因子的复杂网络的改变与前列腺慢性炎症有关,随后的组织损伤、愈合和重塑的缓慢过程,可能会持续刺激前列腺上皮和基质细胞的增殖,导致BPH的发生和发展。由此可见,前列腺慢性炎症在BPH-LUTS的发生和发展中扮演着十分重要的角色,同时也提示人们能否从降低炎症反应入手来干预BPH-LUTS的疾病进展。
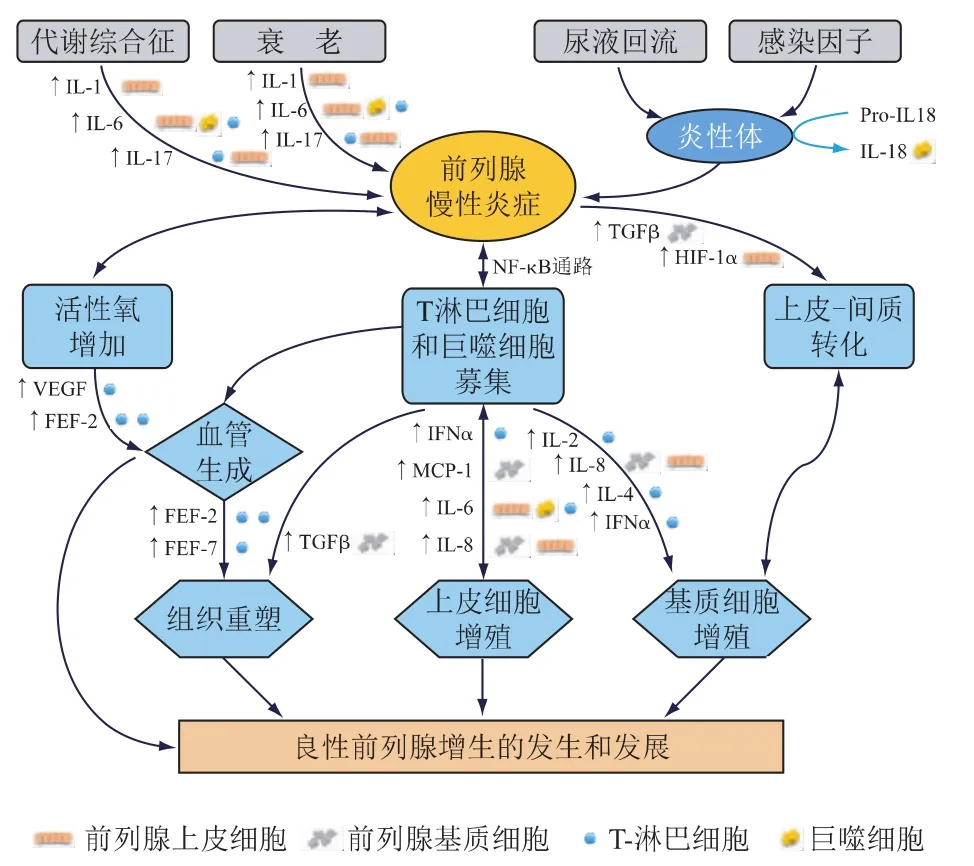
图1 前列腺慢性炎症导致良性前列腺增生的机制分析[7]
3 抗炎药物的应用
近几十年来,许多体外和体内研究发现,抗炎药物在控制BPH及其症状方面也有着一定的效果。目前已经发现了4种不同类别的药物:非甾体抗炎药(NSAIDs)、植物治疗剂、磷酸二酯酶抑制剂和维生素D受体激动剂。
3.1 NSAIDs
BPH患者的前列腺素水平一般偏高,前列腺素是由花生四烯酸经两种不同的COX(COX-1和COX-2)代谢产生的重要炎症递质。NSAIDs通过抑制COX-1和COX-2,降低前列腺的炎症水平。一项与前列腺癌相关的调查研究表明[26],在经常服用布洛芬、阿司匹林与BPH-LUTS症状变化之间或许存在弱相关性;在美国进行的一项针对2 447名白人男性的研究[27]显示,经常服用NSAIDs与BPH-LUTS症状的改善之间存在显著联系:患者服用NSAIDs的天数与中度或重度BPH症状发作、最大尿流速降低、前列腺体积增加和血清前列腺特异性抗原(prostate-specific antigen,PSA)升高之间呈负相关。此外,一些研究还评估了选择性COX-2抑制剂对BPH发生和发展的作用[28,29],研究者以黄酮氧化物为COX-2抑制剂在大鼠BPH模型中开展研究,结果发现,黄酮氧化物抑制前列腺增生达到了91%。2013年对三项随机对照试验的统计结果表明[29],COX-2抑制剂的使用均增大了尿流量、改善了患者的BPH症状。虽然这项统计分析的结果表明,COX-2抑制剂似乎值得广泛用于治疗BPH和LUTS,但长期使用COX-2抑制剂的安全性评价,仍有待于更多的研究和临床试验去确证。
3.2 植物提取剂
研究显示,植物疗法是治疗前列腺炎症的有效方法[30]。目前使用的植物提取剂是从南瓜、黑麦、锯棕榈和荨麻等植物或种子中提取的,其中锯棕榈(Serenoa repens,saw palmetto)的己酸提取物(简称HESr)具有良好的抗炎活性,已引起研究者的广泛关注。HESr的抗炎机制是通过拮抗COX-2和抑制5-LOX(5-脂氧合酶)代谢产物的生成;或者是抑制炎症递质,如MCP-1和VCAM-1(血管细胞粘附分子-1)的表达,从而产生抗炎作用。
Vela Navarrete R等[31]评估了HESr对前列腺炎症的影响,结果显示,在与BPH相关的炎症浸润下,腺体内B淋巴细胞数量略有下降,并且在治疗3个月后,炎症调节剂如TNFβ和IL-1α下降的更加明显。此外,一项随机对照试验研究表明,在分别使用HESr与坦索罗辛(tamsulosin)治疗后对慢性前列腺炎症标志物的影响[32],结果显示,治疗3个月后,HESr组检测到65.4%的标志物的表达降低,而坦索罗辛组为46.2%(P<0.05),特别是仅在 HESr组中报告了 MCP-1,巨噬细胞移动抑制因子(MIF)和CXCL10蛋白数量的减少。尽管这些研究表明是植物疗法,尤其是HESr在调节BPH免疫细胞和相关的炎症浸润中可能起到明显的作用,但HESr对前列腺炎症的确切治疗作用仍有待于进一步的研究和临床试验验证。
3.3 磷酸二酯酶抑制剂
2011年,美国FDA批准磷酸二酯酶5型抑制剂(PDE5i)用于治疗男性BPH-LUTS[3]。PDE5i通过抑制磷酸二酯酶5(PDE5)对cGMP的代谢降解,进而增强NO-cGMP信号通路,可以调节前列腺平滑肌、膀胱颈平滑肌以及阴茎海绵体平滑肌的张力大小。此外,PDE5i对前列腺还有直接的抗炎作用:Vignozzi L等[33]评估了他达拉非和伐地那非对体外前列腺细胞的影响,他们观察到这两种药物均显著降低IL-8的分泌。尽管这些数据仍需进一步临床试验验证,但它们已充分说明PDE5的阻断会对人前列腺成纤维细胞产生抗炎作用,这为前列腺炎症新的治疗靶标的发现提供了参考思路。
3.4 维生素D受体激动剂
维生素D受体激动剂是另一类潜在的BPH-LUTS的治疗药物。对候选药物BXL-628开展了体外BPH细胞实验和自身免疫性前列腺炎症的大鼠模型实验[34],实验结果表明,BXL-628通过减少由CD4+、CD8+、巨噬细胞和B淋巴细胞引起的细胞浸润,降低了IFNγ和IL-17的分泌,从而抑制前列腺的生长,控制了前列腺炎症的发展。目前,BXL-628用于BPH治疗的进一步研究仍在进行中。
上述四类药物,都涉及通过抑制前列腺免疫细胞中的一种或多种细胞因子的分泌,达到治疗BPH的目的。通过以前列腺慢性炎症的治疗为切入点,从而控制和缓解良性前列腺增生的方法,很可能是BPH治疗的新方向和策略。近年来相关药物的研发情况见表3。

表3 治疗前列腺疾病的相关药物的化学结构以及研发信息
4 结 语
当前研究表明,由前列腺慢性炎症导致BPH和LUTS的具体机制尚未在细胞和分子水平上达到足够清晰的阐释,但是前列腺免疫细胞在BPH-LUTS的发生和进展中确实发挥了重要作用。通过各种不同途径引发的前列腺慢性炎症,诱导机体对内、外部刺激作出免疫应答,引起组织损伤,随后创面反复愈合的慢性过程很可能导致了BPH的发生和进展。一些抗炎药物在BPH-LUTS的治疗中已表现出一定的辅助干预作用,虽然其广泛应用还有待进一步的临床研究加以验证,但是作为一种新的潜在的BPH治疗药物的方向和策略,应得到该领域新药研发人员的关注。在临床实践中,泌尿科医生要有能力认识和管控慢性前列腺炎及其常见的相关代谢综合征,要能更好地识别出有BPH和LUTS进展风险的患者并评估其相关的治疗结果。
