Pyk2磷酸化介导糖皮质激素反馈
2019-09-02朱婉蓉张建文
邓 琼, 朱婉蓉, 王 铸, 张建文, 梁 辉
(深圳市龙华区人民医院,广东 深圳 518109)
大脑皮层接收外界刺激后,刺激下丘脑分泌促肾上腺皮质激素释放激素(CRH)进入垂体门静脉循环,与垂体促肾上腺皮质激素(ACTH)细胞内的受体(CRHR)结合,促进细胞合成和分泌ACTH。ACTH可以刺激肾上腺皮质释放糖皮质激素。当糖皮质激素浓度升高至一定水平时,可以反馈作用于下丘脑和垂体,分别抑制CRH和ACTH的分泌,最后抑制糖皮质激素的分泌。因此,糖皮质激素的分泌就呈脉冲式分泌,约一小时一个周期,亦称为超日节律[1]。
有研究提出,糖皮质激素抑制垂体ACTH的分泌介导糖皮质激素分泌超日节律的形成,垂体是调控糖皮质激素分泌的中枢[2]。在我们的前期研究中,我们建立了大鼠垂体细胞灌注系统,持续灌注CRH和血管升压素,细胞的ACTH分泌亦呈脉冲式[3]。同时,应用大鼠垂体细胞灌注系统,我们研究发现,生理水平的糖皮质激素(10nM)可快速抑制垂体ACTH的分泌,不受转录抑制剂或蛋白翻译抑制剂阻断,且该抑制作用由糖皮质激素受体(GR)介导[4]。
有研究报道Pyk2(Proline-rich tyrosine kinase 2)磷酸化信号通路可能介导糖皮质激素在下丘脑神经元的快速反应[5]。Pyk2,属粘着斑激酶家族,广泛分布于多种组织和细胞。Yang等发现皮质酮能激活酪氨酸激酶Pyk2,刺激10min后显著提高402位点的磷酸化水平,并持续升高达60min或更长[5]。抗磷酸化Pyk2 Tyr-402的免疫染色也佐证了此实验结果。Pyk2磷酸化能进一步激活位于其信号通路下游的蛋白激酶Src,Src激酶与GR形成稳定的蛋白复合体。有研究发现地塞米松能快速诱导Pyk2 Tyr-402的磷酸化[6,7],在10min时达最高水平,而30min时降低至正常水平[6]。然而,Giles等人发现与对照组相比,地塞米松处理的巨噬细胞的Pyk2磷酸化水平要更低一些[8]。糖皮质激素激活Pyk2的具体机制仍有待进一步研究。
在本研究中,我们设计实验,应用大鼠垂体细胞灌注系统,研究Pyk2磷酸化是否通过GR,参与介导糖皮质激素反馈。该研究将进一步阐明糖皮质激素作用的分子机制,丰富糖皮质激素生理作用的内涵,为临床皮质醇增多症的诊治提供参考依据。
1 材料方法
1.1 实验动物及试剂
雄性SD(Sprague Dawley)大鼠购自广东省医学实验动物中心(中国佛山),ACTH浓度测定试剂盒来源于R&D systems(USA),细胞培养的试剂购自Gibco(Life Technologies,USA),垂体细胞的原代分离试剂来源于Sigma Aldrich(USA),小鼠垂体瘤细胞系AtT20细胞购自ATCC(CRL-1795)。
1.2 垂体细胞的分离培养及灌注
大鼠体重225-250g,自由采食,到达后16h白天/8h黑夜的条件下稳定饲养5天以上。CO2麻醉昏迷,断颈处死。取垂体前叶组织,PBS清洗两次,剪成1mm3的小块,胰蛋白酶37℃消化15min,加DNaseI沉降组织,胰蛋白酶抑制剂终止消化,以2mM和1mM EDTA溶液洗涤两次,将组织转移至15ml的离心管内,轻轻反复吹打,吸取云状上清到细胞筛过滤,反复重复此步骤。200g离心15min收集细胞,重悬后计数。将细胞稀释至1.5×106个/ml,加Cytodex珠子(GE Healthcare)。细胞培养箱中培养,每30min轻微摇匀混合,待大部分细胞粘附珠子后,加入10%马血清及双抗。37℃,5%CO2细胞培养箱中稳定培养48-72h。连接细胞灌注系统装置,将垂体细胞转移至细胞灌注系统中,37℃预热的培养液(无血清培养基,0.1%BSA)预跑排尽装置内空气。细胞在系统中平衡6h,在开始刺激前,收集30min的培养液作为基础水平参照,每5min收集的培养液作为一个样品。将培养液转换成含激素(CRH和皮质酮)的培养液,收集样品,记录添加的时间和对应的收集管号。实验结束后,清洗整个系统,灌入空气干燥。采用ACTH化学发光酶联免疫吸附测定试剂盒测定样品中ACTH的浓度。
1.3 蛋白免疫印迹
我们采用Pierce的培养细胞亚细胞蛋白分离试剂盒(Thermo Scientific,美国),根据说明书提取蛋白后,测定蛋白浓度,按20μg蛋白/孔准备样品,98℃水浴5min。上样电泳,120V,1h 45min。转膜,恒电流330mA 90min。5%TBST牛奶室温封闭1h。一抗4℃孵育过夜;所用的抗体及其稀释倍数见表1。次日TBST洗涤3次,每次5min;加入对应二抗常温孵育1h。TBST洗涤3次,每次10min。用Millipore化学发光液发光,Tanon-5520自动曝光仪器化学曝光。

表1 实验所用抗体
1.4 数据统计分析
数据以多个重复实验的平均值±标准误差表示,不同组之间的数据差异性检验是通过独立样本t检验或者One/Two-way ANOVA分析,后以Fisher配对检验。显著性差异P<0.05。
2 结 果
2.1 皮质酮和CRH对Pyk2磷酸化的作用
我们培养小鼠垂体瘤细胞系AtT20细胞,并对细胞进行皮质酮和CRH刺激。我们之前的数据表明,30pM的CRH能促使垂体细胞稳定地分泌ACTH,且10nM的皮质酮可以显著抑制ACTH的分泌[3]。蛋白免疫印迹结果显示,30pM的CRH刺激AtT20细胞,10min后Pyk2(Tyr402)磷酸化水平显著上升(1.82±0.06倍,P<0.01),随后慢慢回落;同样,单独使用皮质酮刺细胞10min,Pyk2磷酸化水平升高1.58±0.10倍(P<0.05),随后回复接近正常水平。同时采用CRH和皮质酮处理细胞时,10min后Pyk2磷酸化水平略有下降(P>0.05),20min后开始持续上升(2.33±0.35倍,P<0.01)。
2.2 Pyk2抑制剂PF对GR转运的影响
我们检测Pyk2抑制剂PF对GR转运的作用。经查阅资料和前期预实验结果表明,3μM的PF能显著抑制Pyk2磷酸化。细胞密度达70%-80%时,激素剥离血清过夜,次日无血清培养4h,加PF继续培养2h,随后以皮质酮刺激。蛋白免疫印迹(图2A)和数据统计(图2B)结果显示,PF能显著抑制GR向细胞核转运,但不影响GR向细胞膜的转运。
2.3 Pyk2抑制剂对糖皮质激素快速反馈的影响
垂体细胞在灌注系统中平衡6h,收取6个样本(30min)作为基础对照组;接着以30pM CRH刺激细胞1h,在处理组加入PF,10min后两组均加入皮质酮;皮质酮刺激30min后撤掉PF和皮质酮,换30pM CRH继续灌注1h。3次重复的实验结果均显示,PF不阻止皮质酮对CRH刺激ACTH分泌的快速抑制作用,PF引起了滞后的长时间的ACTH分泌的抑制(50-60min)。

A.蛋白质免疫印迹检测结果;B.3个重复实验的统计分析结果
图1 皮质酮和CRH对Pyk2磷酸化的作用
Fig.1 Effect of corticosterone and CRH on Pyk2 phosphorylation
A.Dection of western blot;
B.Statistical data from three repeated experiments
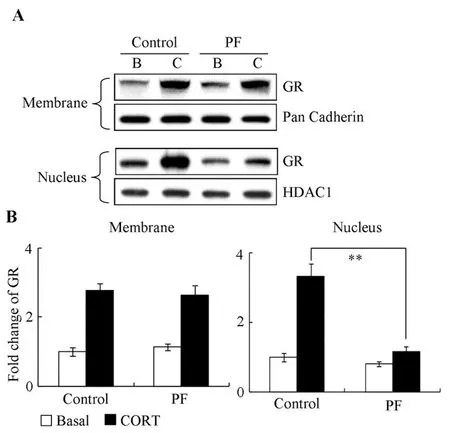
A.蛋白质免疫印迹检测结果;B.3个重复实验的统计分析结果
图2 PF对GR转运的影响
Fig.2 Effect of PF on GR trafficking
A.Dection of western blot;
B.Statistical data from three repeated experiments(**:p<0.01)
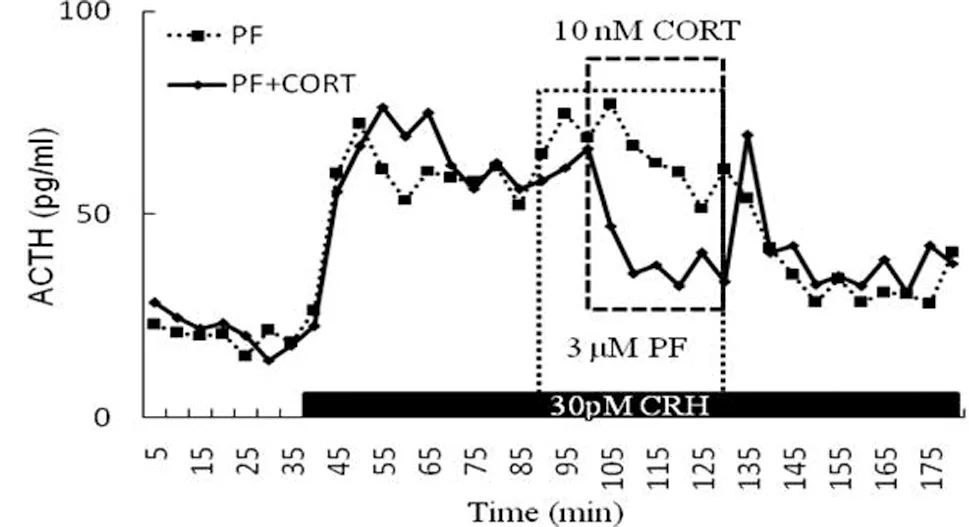
图3 PF对皮质酮抑制ACTH分泌的作用Fig.3 Effect of PF on corticosterone-inhibited ACTH secretion
3 讨 论
糖皮质激素是一类由肾上腺皮质分泌、具有广泛生理作用的类固醇激素,可调节机体的物质代谢、水盐代谢并影响器官系统的功能,增强机体在应激反应中的抵抗力,同时还具有抗炎、抗休克和免疫抑制作用。糖皮质激素主要通过经典途径(基因组作用)和非经典途径(非基因组作用)发挥生物学效应,其中,非基因组作用在机体生理和病理过程中具有重要的生物学意义,但是其分子机制尚不明了[9]。
Pyk2,属粘着斑激酶家族,广泛分布于多种组织和细胞[10]。Pyk2活化同时可以进一步引起MAPK-Erk1/2信号转导[11],还可以通过GSK3β-Wnt/β-catenin信号通过调控肿瘤的发生发展[12,13]。Pyk2作为一种活跃的非受体酪氨酸蛋白激酶,通过多种信号转导方式及信号通路,参与多种生理活动,实现其生物学效应[10,14]。Pyk2磷酸化能进一步激活位于其信号通路下游的蛋白激酶Src[15];Src激酶与GR形成稳定的蛋白复合体,且糖皮质激素可刺激激活Src磷酸化[5,16]。有研究指出Pyk2的活化可以不需要受体或其他激酶的参与即可完成[10],这与快速非基因组作用的方式一致。鉴于此,我们设计实验,研究Pyk2磷酸化是否介导糖皮质激素快速反馈。
蛋白免疫印迹结果显示,单独采用CRH,或者皮质酮刺激细胞,可引起Pyk2位点402的快速磷酸化(10min),这一反应与皮质酮快速抑制ACTH的分泌一致[4]。持续刺激时,磷酸化水平慢慢回落,接近正常生理水平。当同时添加CRH和皮质酮刺激时,Pyk2的磷酸化出现短期抑制趋势,随后快速升高(20min)。
我们的前期研究结果表明,GR介导了糖皮质激素的快速抑制作用[4]。我们应用了Pyk2抑制剂PF,研究PF对细胞内GR转运的作用。蛋白免疫印迹结果显示,PF不影响GR的细胞膜转运,表明抑制Pyk2并不影响糖皮质激素的快速非基因组作用;PF阻止了受体向细胞核的转运,表明Pyk2可能通过调控靶基因的转录激活或抑制,参与糖皮质激素的基因组作用。
我们进一步采用了垂体细胞灌注系统进行了验证,结果与蛋白免疫印迹结果一致。PF不影响糖皮质激素激素对ACTH的快速抑制作用,却引起了ACTH分泌延后的长期抑制,延后时间为50~60分钟,与基因转录的最快时间大致相当。因此,综合这些实验结果,我们可以得出,Pyk2可能通过抑制GR向细胞核转运,参与调控糖皮质激素的作用。但是,单独皮质酮或CRH刺激引起的Pyk2的快速磷酸化的机制,以及可能参与的作用,仍然需要进一步深入的研究和探讨。
