葛根素改善3T3-L1 脂肪细胞葡萄糖摄取和胰岛素抵抗*
2019-08-31杨维波韩福祥刘振明董红昌张建华
杨维波,韩福祥,刘振明,董红昌,张建华
(1.山东省阳信县中医医院 阳信 251800;2.北京大学第一医院核医学科 北京 100034)
随着居民生活方式改变和老龄化进程的加速,我国糖尿病的患病率正在迅速增长,2002年糖尿病的患病率为2.7%[1],2007 年增长到9.7%[2],2010 年一项涵盖全国31个省市自治区的9.8万18岁以上的人群调查显示,我国成人糖尿病患病率已上升到11.6%,糖尿病前期患病率为50.1%[3],糖尿病已经成为继心脑血管、肿瘤后又一个严重危害人民健康的重要慢性非传染性疾病。糖尿病的主要类型是2 型糖尿病,其主要病理生理机制为胰岛β细胞功能受损造成的胰岛素分泌不足和胰岛素抵抗(Insulin resistance,IR)。
在祖国传统中医学中,糖尿病典型的临床症状属于“消渴病”的范畴,几千年来,中药在治疗“消渴病”的方面积累了很多宝贵经验。近些年来,从中药中提纯的药物有效成分应用于临床,在治疗糖尿病方面发挥了不可替代的作用,葛根素是中药葛根中活性物质异黄酮类物质的主要成分[4],在临床实践中发现其有改善2型糖尿病患者糖代谢的作用。本实验旨在观察葛根素对3T3-L1 脂肪细胞葡萄糖摄取及对IR 的影响,探讨其作用机制,为临床上治疗糖尿病提供新的思路。

表1 Real-time PCR引物序列
1 材料与方法
1.1 实验材料
小鼠前脂肪细胞(3T3-L1)(中国科学院上海生命科学研究院);3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX,美国Sigrna 公司);DMEM 高糖培养基(赛默飞世尔生物化学制品有限公司);SDSPAGE凝胶配制试剂盒(上海碧云天生物技术研究所);抗体GLUT4、PI3K、AKT、AMPK、PPARγ(Santa Cruz 公司);葛根素标准品(中国药品生物制品检定所);Revertaid First Strand cDNA Synthesis Kit(美国Fermentas 公司);引物和内参GAPDH(上海生工生物工程技术服务有限公司);Rotor-Gene荧光定量PCR仪(Corbett Research 公司);凝胶成像分析系统(Bio-Rad);高速台式冷冻离心机(Thermo Fisher)。
1.2 实验方法
1.2.1 3T3-L1细胞的诱导分化
将3T3-L1 前脂肪细胞置于含10%胎牛血清的DMEM高糖培养基中,37℃、5%CO2培养,传至第三代细胞状态良好时,加人含0.5 mmol‧L-1IBMX、10-6mol‧L-1胰岛素、1 μmmol‧L-1地塞米松、10%胎牛血清的DMEM高糖培养基培养48 h后,换为含10 ug‧mL-1胰岛素的培养基48 h,最后在10%胎牛血清的DMEM 高糖培养基继续培养,每2天换培养液1次,诱导分化9天的3T3-L1细胞经油红O染色鉴定,90%以上呈脂肪细胞表型用于试验。
1.2.2 3T3-L1脂肪细胞胰岛素抵抗模型建立
参照文献报道方法[5]3T3-L1脂肪细胞诱导分化成熟后,给予1 μmmol‧L-1地塞米松在10%胎牛血清的DMEM高糖培养基中继续培养,以葡萄糖氧化酶-过氧化物酶法分别在48、72、96、120 h测每孔培养液中葡萄糖的含量,与未接种细胞的空白孔葡萄糖相减,计算葡萄糖消耗量,当两组间葡萄糖的消耗量差异有统计学意义时(P <0.05),为造模成功。葡萄糖消耗差值比例最大的时间点作为建立胰岛素抵抗模型最佳作用时间。
1.2.3 细胞分组
取诱导分化成熟的3T3-L1脂肪细胞,将其分为空白组、模型组、葛根素10 mg‧L-1组、葛根素100 mg‧L-1组和葛根素200 mg‧L-1组。其中空白组不建模型,以含10%胎牛血清的DMEM 高糖培养基培养;模型组为建立模型但不加药物干预;其它3 组为建立模型后分别用不同浓度的葛根素干预。
1.2.4 检测培养基上清中葡萄糖浓度及细胞活力测定
确定造模成功后,在葛根素干预组细胞培养体系中加入葛根素液180 μL,使其终浓度分别为10、100、200 mg‧L-1,空白组、模型组加入等体积的培养液,共同孵育24 h。分别取每组的上清液1 mL 置于Eppendorf管中,高速离心,按葡萄糖测定试剂盒的操作说明书,用葡萄糖氧化酶-过氧化物酶法检测各组培养基上清中葡萄糖OD值。
各组按5x104/孔接种于96 孔,每孔加入20 μLMTT(5 g·L-1),孵育4 h,吸去上清,加入DMSO溶液150 μL/孔,震荡10 min 充分溶解结晶,用酶标仪测OD 值,波长570 nm,以此代表细胞活力。
1.2.5 3T3-L1脂肪细胞RNA提取及Real time PCR分析
用1 mL TRIzol 提取细胞总RNA,设计GLUT4、PI3K、AKT、AMPK、PPARγ mRNA 和3-磷酸甘油醛脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物(表1),按照Real time PCR 试剂盒说明书进行逆转录为cDNA,PCR反应条件为95℃变性15 s,55℃退火20 s,72℃延伸20 s,共45个循环,反应结束后确认Real-Time PCR 的扩增曲线和溶解曲线,以GAPDH 为内参,计算mRNA 相对表达量,进行均一化处理后,再进行统计分析,引物序列(表1)。
1.2.6 Western blot法检测蛋白表达
用含1%PMSF 的RIPA 裂解细胞,离心取上清液,用BCA法检测蛋白浓度,取20 μL蛋白样品,以10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,结束后转印至PVDF 膜上,用含5%脱脂奶粉的TBST 室温下封闭1 h 后,加入一抗,4℃孵育过夜后,PBST洗膜3次,每次10 min;加入辣根过氧化物酶标记的二抗,室温轻摇1 h;用ECL法成像。
1.2.7 统计学方法
2 结果
2.1 地塞米松作用后不同时间细胞培养基上清葡萄糖浓度
脂肪细胞诱导分化成熟后,给予地塞米松作用,分别测48、72、96、120 h空白组及模型组细胞培养基上清葡萄糖浓度,用模型组葡萄糖浓度与空白组葡萄糖浓度的差值反映细胞IR程度。结果显示,各点模型组葡萄糖浓度高于空白组(P <0.01),提示48 h后可构建稳定的胰岛素抵抗模型;96 h 时差值显著高于其它时间组,证实96 h时IR达最佳(表2)。
2.2 葛根素作用于胰岛素抵抗细胞后葡萄糖浓度测定
3T3-L1脂肪细胞胰岛素抵抗模型诱导成功后,加入不同浓度的葛根素共同培养,测得各组细胞培养上清葡萄糖含量(表3)。与空白组比较,模型组培养基上清葡萄糖OD 值明显升高,差异有统计学意义(P <0.01);葛根素干预后,模型组细胞葡萄糖利用增加,葡萄糖OD 值与模型组比较明显降低,差异有统计学意义(P <0.01)。葛根素100 mg‧L-1组和葛根素200 mg‧L-1组相比,差异无统计学意义(P >0.05)。
2.3 葛根素对脂肪细胞活力及分化的影响
MTT 结果显示,各组吸光度值与空白组相比较,差异无统计学意义(P >0.05),提示各浓度的葛根素对3T3-L1脂肪细胞增殖活力无影响(表4)。
2.4 各组GLUT4、PI3K、AKT、AMPK、PPARγ mRNA Real-Time PCR结果比较
结果显示,与空白组比较,模型组GLUT4、PI3K、AKT、AMPK、PPARγ mRNA 水平均降低,差异有统计学意义(P <0.01);与模型组比较,葛根素10 mg‧L-1、葛根素100 mg‧L-1、葛根素200 mg‧L-1组GLUT4、PI3K、AKT、AMPK、PPARγ mRNA 水平升高,差异有统计学意义(P <0.05);葛根素200 mg‧L-1组与葛根素100 mg‧L-1组比较GLUT4、PI3K、AKT、AMPK、PPARγ mRNA水平无明显变化,差异无统计学意义(P >0.05)(表5)。
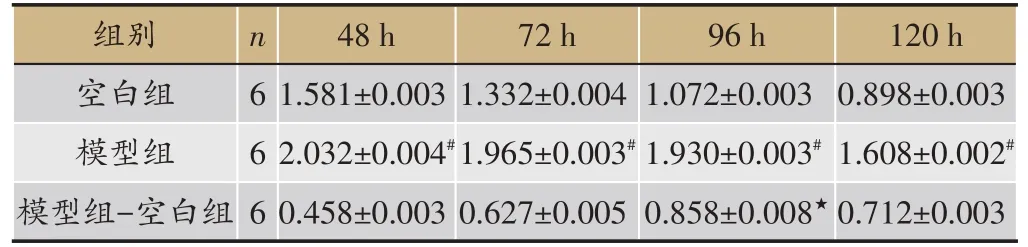
表2 地塞米松作用后不同时间细胞上清葡萄糖浓度(OD)值
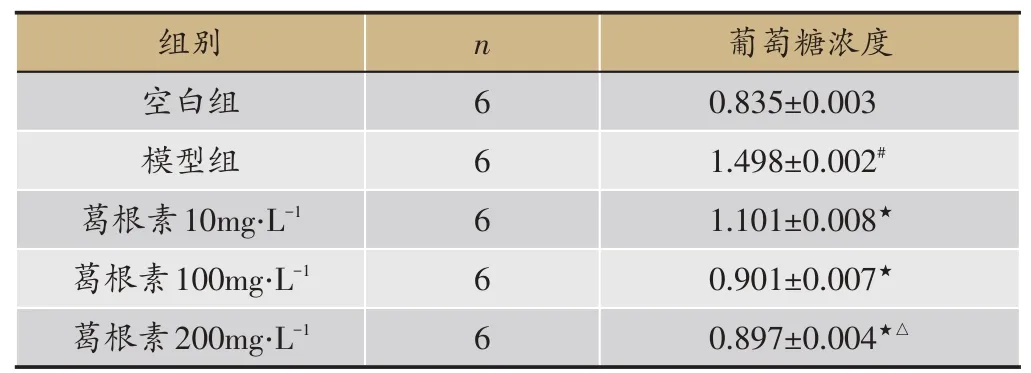
表3 不同浓度葛根素对细胞培养上清葡萄糖浓度的影响(OD值)
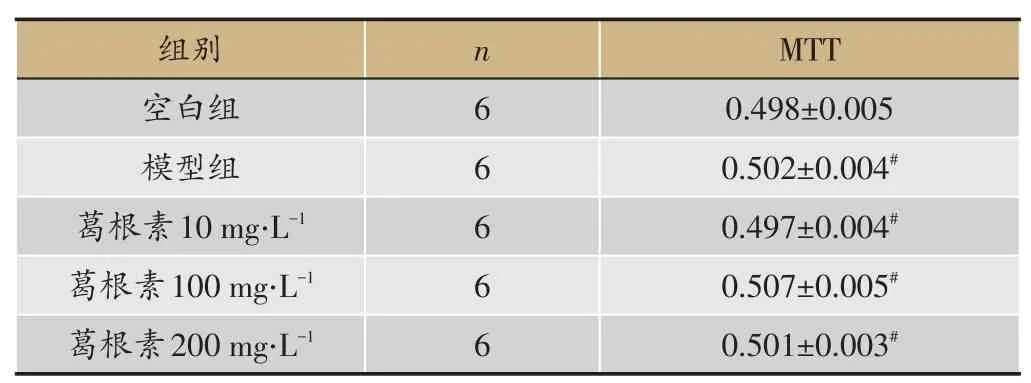
表4 不同浓度葛根素对细胞增殖的影响(OD值)
2.5 Western blot 法 检 测 各 组GLUT4、PI3K、AKT、AMPK、PPARγ蛋白表达
结果比较显示,与空白组比较,模型组GLUT4、PI3K、AKT、AMPK、PPARγ蛋白表达显著降低,差异均有统计学意义(P<0.01);与模型组比较,葛根素10 mg‧L-1、葛根素100 mg‧L-1、葛根素200 mg‧L-1组GLUT4、PI3K、AKT、AMPK、PPARγ蛋白表达升高,差异均有统计学意义(P<0.05),葛根素200 mg‧L-1组与葛根素100 mg‧L-1组比较,GLUT4、PI3K、AKT、AMPK、PPARγ蛋白表达无明显变化,差异无统计学意义(P>0.05)(表6,图1)。
3 讨论
中医认为,脾胃为后天之本,气血生化之源,饮食通过胃的受纳腐熟、脾的运化升清化生水谷精微,内养五脏六腑,外养四肢百骸、皮毛筋骨,如饮食不节、过食肥甘醇酒厚味、安逸少动,可损伤脾胃功能;脾失健运,脾不能升清、胃不降浊,气机不畅,不能散精上输于肺,肺失津液则化燥,故口渴多饮,虚火内生,则消谷善饥。明代赵献可《医贯·消渴论》云:“脾胃既虚,则不能敷布津液故渴”,可见,糖尿病的发生于脾胃功能关系密切。
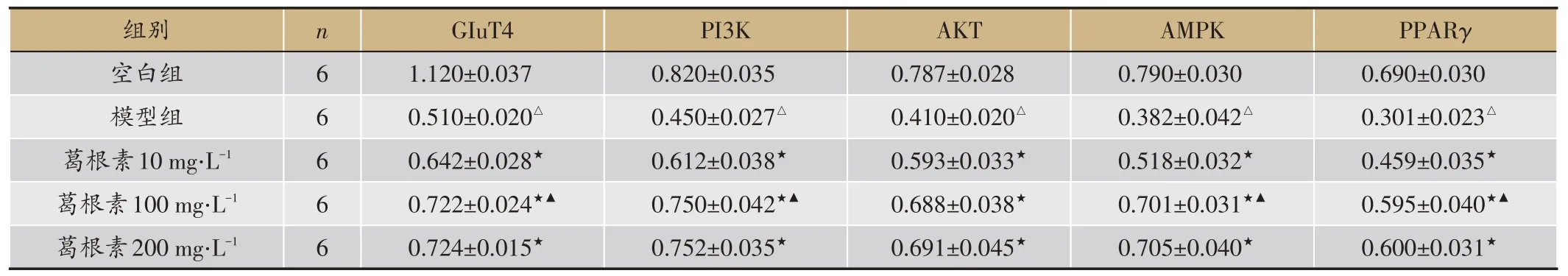
表5 各组GLUT4、PI3K、AKT、AMPK、PPARγ mRNA Real-Time PCR结果比较
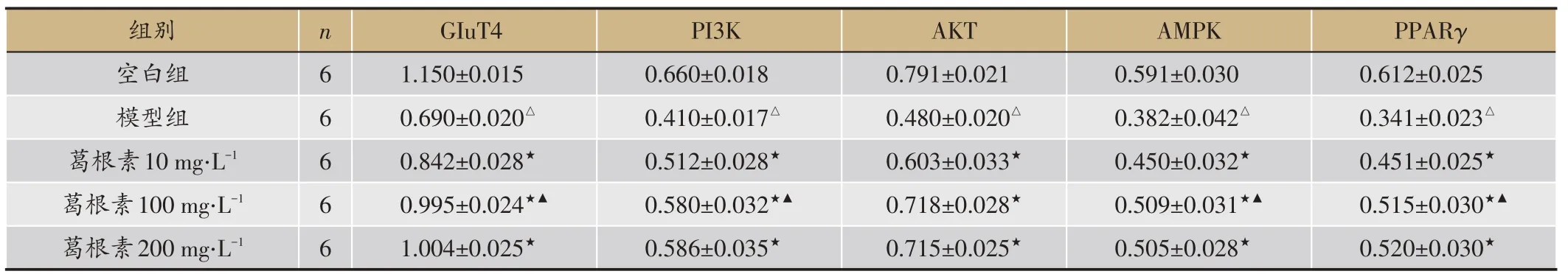
表6 各组GLUT4、PI3K、AKT、AMPK、PPARγ蛋白表达结果(蛋白灰度值)比较
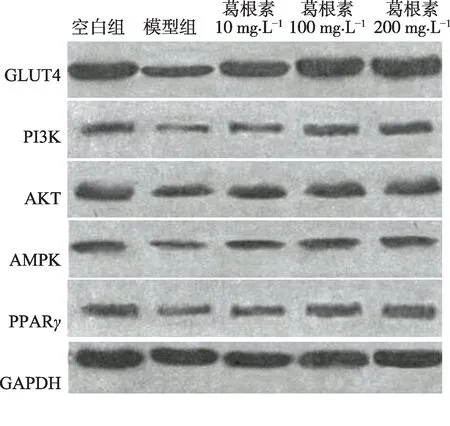
图1 Western blot法检测各组蛋白表达
葛根为豆科植物野葛的干燥根,是调理脾胃功能的传统中药,其性味甘、辛、凉,归脾、胃经,具有解肌退热、生津止渴、升阳止泻之功效[6],《神农本草经》记载葛根“主消渴,身大热,呕吐,诸痹,起阴气,解诸毒,葛谷,主下利”提示葛根有治疗“消渴病”的作用。以葛根为主药,配伍黄芩、黄连、甘草组成葛根芩连汤,临床上可用于治疗肥胖型2型糖尿病胃肠湿热证。有研究显示[7],葛根芩连汤激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator- activated receptor gamma,PPARγ),从而上调脂联素和细胞葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)mRNA 和蛋白质表达水平,认为葛根芩连汤有调节糖尿病大鼠模型糖代谢改善脂肪IR的作用。
葛根素是中药葛根主要有效成分之一,近年来也有很多研究,杨蕾[8]等用葛根素对链脲佐菌素诱导糖尿病模型小鼠干预4 周后,发现葛根素降低了模型小鼠空腹葡萄糖。本实验用不同浓度的葛根素干预3T3-L1细胞胰岛素抵抗模型后,细胞培养基中葡萄糖浓度均较模型组降低(P <0.01);提示葛根素有改善3T3-L1细胞糖代谢的作用。
IR 是胰岛素作用的靶器官、组织(如肝脏、肌肉、脂肪组织等)对胰岛素的敏感性和反应性降低,是正常剂量的胰岛素产生低于正常生物学效应的一种状态[9],是2型糖尿病的重要标志。2型糖尿病IR主要体现在以下3 个水平[10]:(1)受体前水平,包括胰岛素基因的异常、胰岛素拮抗物质影响、胰岛素降解加速等;(2)受体水平,包括胰岛素受体基因突变、胰岛素丝氨酸/苏氨酸磷酸化、胰岛素受体抗体等;(3)受体后水平,包括胰岛素受体后信号转导和葡萄糖摄取的各个环节障碍,如葡萄糖转运体合成和转运障碍等,其中以GLUT4尤为重要。
GLUT4 是主要的葡萄糖运载体,分布于胰岛素敏感的骨骼肌、心肌和脂肪细胞,主要存在于细胞内,而细胞膜上的量很少,在胰岛素的刺激下细胞膜上的GLUT4大量增加而实现葡萄糖的运转,胰岛素刺激的GLUT4转运是通过PI3K/Akt信号通路实现的[11]。
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)由调节亚基p85 和催化亚基p110 所组成的异二聚体,有Ⅰ、Ⅱ、Ⅲ型3个家族成员,具有磷脂酰肌醇激酶和Ser/Thr(丝氨酸/苏氨酸)蛋白激酶的双重活性[12]。调节亚基p85 包含1 个SH3 区域、2 个富含脯氨酸区域、2 个被一非编码区分开的Src 同源结构域(SH2)和p110 与p85 相互作用的非编码区,其中2 个SH2 可与磷酸化的酪氨酸残基结合,引起催化亚基的活化,从而传导酪氨酸激酶信号[13]。研究表明[14],如果采用基因敲除等技术,造成PI3K调节亚基p85和催化亚基p110的基因功能缺陷均可导致糖、脂代谢紊乱,说明PI3K对调节糖,脂代谢具有重要作用。
AKT 又称蛋白激酶B(proteinkinaseB,PKB),为Ser/Thr 激酶,是PI3K 信号通路下游的重要靶蛋白,目前发现AKT有3个亚型,由不同基因编码,具有80%的同源性,分布于不同组织。AKT 由N 端PH 结构域、中间催化域和C端调节结构域组成,PH结构域介导脂质与蛋白质及蛋白质与蛋白质之间的相互作用,中间催化域可催化Ser/Thr 残基磷酸化,C 端调节域含有磷酸化位点Ser473,此位点是AKT完全活化所必需的[15,16]。
当细胞外胰岛素与细胞膜胰岛素受体结合,引起酪氨酸蛋白激酶活化时,后者又使胰岛素受体底物发生磷酸化并与PI3K 调节亚基p85 的SH2 结构域结合,招募并激活催化亚基p110,从而催化质膜上磷脂酰肌醇磷酸化,与AKT 的PH 结构域结合并定位于磷酸肌醇依赖性蛋白激酶1 附近,活化的AKT 从质膜转移至细胞质、线粒体和细胞核内,促使GLUT4 囊泡前移与细胞膜融合,介导葡萄糖转运入细胞,增加葡萄糖摄取[17];激活PI3K和AKT分子,可启动整个PI3K/AKT 信号通路的传导,增加GLUT4转运,调控血糖,减少肝糖原的合成,减轻胰岛β细胞损伤[18],如果胰岛素受体后PI3K/AKT 信号通路障碍及下游靶蛋白功能异常均可引发糖、脂代谢障碍,继而导致IR的发生。
本实验结果显示:地塞米松诱导的3T3-L1脂肪细胞胰岛素抵抗模型中GLUT4、P13K、AKT mRNA、蛋白表达较空白组下降,提示实验细胞模型有明显的糖代谢障碍和IR;加入葛根素处理后以上指标明显升高,呈剂量依赖性,但200 mg‧L-1组与100 mg‧L-1相比差异无统计学意义(P>0.05),推测葛根素能通过P13K/AKT信号途径升高GLUT4表达,改善脂肪细胞IR。
腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)途径也是胰岛素信号转导的重要通路,AMPK 是一种参与调节细胞机体能量代谢、信号转导的蛋白激酶,广泛存在于肝脏、骨骼肌和脂肪组织中。AMPK 一种异源三聚体蛋白,由α、β、γ3 个亚单位组成,AMPK 在调节肌体能量代谢的平衡方面起总开关作用,其活性受AMP/ATP 比值调控,参与多种代谢过程,能调节糖、脂肪和蛋白质代谢,运动、组织缺血、缺氧等,都可以激活AMPK通路,活化的AMPK使脂肪酸氧化作用、肝糖原的转化、骨骼肌对葡萄糖的摄取增强,并通过诱导GLUT4 向质膜转移,并通过磷酸化转录因子开启GLUT4基因的表达,增加脂肪组织中葡萄糖的利用,从而使得机体对葡萄糖的摄取增强[19,20]。
PPARγ是核受体过氧化物酶体增殖物激活受体的一个亚型,人体很多组织都能分泌PPARγ,但以脂肪组织最多,动物实验表明,激活脂肪细胞中PPARγ,可诱导内脏和皮下大脂肪细胞较少,小脂肪细胞数目增加,从而增加胰岛素的敏感性[21]。PPARγ激活后,主要通过以下方式提高胰岛素敏感性[22],改善IR:①促进白色脂肪细胞分化,使其数量增多、体积减小,并增加胰岛素受体的数目。抑制脂肪细胞的肥大和脂肪分解,诱导大脂肪细胞的凋亡;②调控脂肪细胞的分泌功能,增强脂联素等细胞因子的合成;③促进与胰岛素信号转导有关的多种基因的转录:通过上调PI3K 亚单位p85、CAP增加GLUT4的表达,进而促进胰岛素信号转导;④激活AMPK,通过非胰岛素依赖机制促进外周组织细胞的葡萄糖转运,抑制糖诱导的胰岛素释放,以改善葡萄糖代谢和高胰岛素血症。本实验检测到地塞米松诱导的3T3-L1脂肪细胞胰岛素抵抗模型中AMPK、PPARγmRNA、蛋白表达较空白组下降,加入葛根素处理后明显升高,推测葛根素改善脂肪细胞糖代谢和IR可能与AMPK、PPARγ升高有关。
研究显示[23],P13K/AKT 和AMPK 信号通路存在复杂的交互作用,一方面,AMPK 的激活可以促进P13K和AKT 等多种P13K/AKT 信号通路分子的活性增加,抑制胰岛素受体底物-1 调控的负反馈回路,还可以通过调节PI3K 来激活AKT;PPARγ活化也能促进PI3K的亚单位P85 的表达,促进胰岛素信号转导;另一方面,PI3K/AKT 能调节AMPK 活性,也可通过调节C/EBPα、PPARγ的表达,在3T3-L1前脂肪细胞的分化中发挥重要作用[24]。
肥胖可引起IR,进而引起糖尿病,目前的研究显示随着身体质量指数和脂肪组织增加,糖尿病的发病率会升高[25]。脂肪组织是IR 发生的重要的靶组织,增加脂肪细胞的胰岛素敏感度和葡萄糖摄取是治疗2型糖尿病的手段之一。3T3-L1前脂肪细胞是Swiss小鼠胚胎成纤维细胞,能在诱导剂作用下分化为脂肪细胞,被广泛应用于糖、脂代谢相关的基础和实验研究。本实验选择用地塞米松诱导建立3T3-L1 脂肪细胞胰岛素抵抗模型,从细胞水平研究葛根素对IR 的作用机制,结果显示,3T3-L1 脂肪细胞发生IR 后,葡萄糖摄取能力明显下降,而葛根素能增加其对葡萄糖的摄取,改善IR,其机制可能与上调P13K、AKT、AMPK、PPARγ基因和蛋白表达有关。
