聚丙烯腈基钛酸钾球形复合吸附剂的制备及其对Sr2+的吸附性能研究
2019-08-29杜志辉贾铭椿王晓伟门金凤
杜志辉,贾铭椿,王晓伟,门金凤
(海军工程大学 核科学技术学院,湖北 武汉 430033)
核工业发展过程中产生了大量放射性废水,与其他工业产生的废水相比,核工业产生的放射性废水的妥善处理显得尤为迫切,这是因为放射性废水中含有多种放射性核素,而放射性核素一旦泄漏进入环境将给人类及环境带来严重危害[1-2]。90Sr是放射性废水中常见的一种高释热放射性核素,是一种典型的裂变产物,来源于235U裂变,具有裂变产额高、放射强度大且半衰期长(28.8 a)等特点[3]。由于锶与钙互为同主族元素,其化学性质也与钙相似,90Sr被人体吸收后,将会参与钙的代谢过程,沉积在骨骼内,给人体带来持久的危害,为此,含90Sr放射性废水的处理尤为重要[4]。
许多物理化学方法可去除放射性废水中的90Sr,这些方法包括离子交换、膜分离、化学沉淀、吸附、萃取等,其中,吸附是最为有效且经济的方法之一。国内外学者研究了多种有机、无机吸附剂对废水中90Sr的吸附性能,如合成沸石、多层碳纳米管、钛酸盐、活性炭、高岭土等[5]。其中,钛酸盐对锶的吸附效果较好,与废水中共存的Na+、K+、Ca2+、Mg2+等非放射性离子相比,钛酸盐对锶的选择性较高。但钛酸盐是微晶状结构,机械性能较差,不适于工业规模的柱操作[6]。
本文将钛酸钾(KTiO)作为吸附废水中锶的有效成分,以聚丙烯腈(PAN)作为基体,制成便于工程应用的聚丙烯腈基钛酸钾球形复合吸附剂(PAN-KTiO),并研究其对废水中锶的吸附性能,旨在为含90Sr放射性废水的高效处理提供一种新材料。
1 实验
1.1 主要仪器与试剂
实验所用试剂均为分析纯,实验用水为去离子水。
实验所用主要仪器包括S4800型冷场发射扫描电镜、D/MAX-RB转靶X射线衍射仪、3H-2000PS1型静态容量法比表面及孔径分析仪、contrA 700型原子吸收分光光度计、SevenCompact型pH计、AL204型电子天平、SHA-C恒温振荡箱、DZ-1BC真空干燥箱。
1.2 吸附剂制备
首先,参考相关文献[6],采用水热法,以氢氧化钾、四异丙醇钛为原料,制备得到KTiO,并将其研磨成粒径小于160目的细小粉末。之后,采用双嘴法[7],以KTiO为有效成分、PAN为基体,制备得到KTiO含量为80%的PAN-KTiO。
1.3 实验方法
采用静态法进行实验,在一系列100 mL具塞三角烧瓶中移入100 mL锶溶液,加入20 mg PAN-KTiO,30 ℃下置于水浴恒温振荡器中振荡一定时间后,取上清液用原子吸收分光光度法测定锶含量,计算吸附量qt(mg/g)。
qt=(C0-Ct)V/m
式中:C0为吸附前Sr2+的初始浓度,mg/g;Ct为吸附后Sr2+的浓度,mg/g;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 吸附剂的表征

图1 PAN-KTiO的SEM照片Fig.1 SEM image of PAN-KTiO
图1为PAN-KTiO的SEM照片。可见,PAN-KTiO为粒径约1 mm的球形颗粒,大小不均且尺寸为μm级的细小颗粒KTiO被PAN粘结在复合吸附剂中;PAN-KTiO表面粗糙,存在大量孔洞及裂缝,这种结构有利于Sr2+向吸附剂内部扩散,便于吸附过程的快速进行。
图2为PAN-KTiO吸附Sr2+前后的XRD谱。PAN-KTiO吸附Sr2+前,在2θ为10.5°处有1个主峰,经与标准卡片比对,与Na2Ti3O7的衍射谱(JCPDs No.720148)吻合较好,此外在29.1°、48.2°等处也出现不同晶面的次峰。PAN-KTiO吸附Sr2+后,在29.1°、48.2°处的衍射峰明显减弱,这是因为处于TiO6八面体内层的K+被Sr2+交换后引起了KTiO结构的畸变[8]。

图2 PAN-KTiO吸附Sr2+前后的XRD谱Fig.2 XRD pattern of PAN-KTiObefore and after Sr2+ adsorption
KTiO的球棍模型结构如图3所示。可知,KTiO具有层状结构,由TiO6八面体通过共用角、边、面组成,这种结构使其更易与目标离子进行交换[9]。

图3 KTiO的球棍模型结构Fig.3 Ball and stick model of KTiO
PAN-KTiO的N2吸附-脱附等温线示于图4。可看出,PAN-KTiO的吸附-脱附等温线属于Ⅳ型,为典型的介孔结构吸附-脱附等温线,在分压为0.50~0.98时出现滞后环,属于H3型滞后环,说明样品中存在大量介孔结构[10]。BET多点法比表面积为198.954 m2/g,BJH法脱附孔体积为0.410 mL/g,BJH法脱附平均孔直径为7.850 nm。
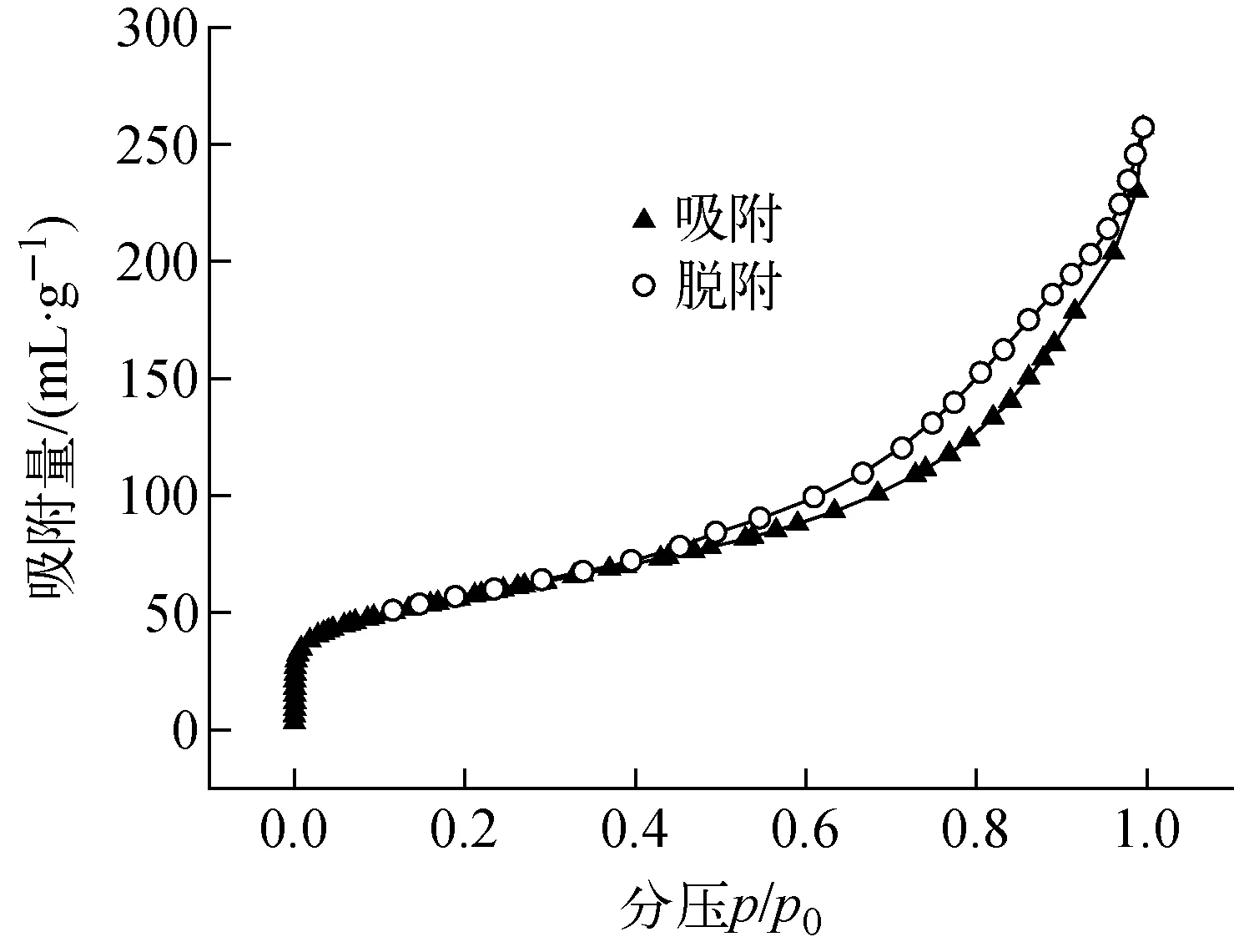
图4 PAN-KTiO的N2吸附-脱附等温线Fig.4 N2 adsorption-desorption isotherm of PAN-KTiO
2.2 PAN-KTiO吸附锶的影响因素
1) 接触时间
在溶液温度30 ℃、Sr2+初始浓度5 mg/L、接触时间1~40 h的条件下,考察PAN-KTiO对Sr2+的吸附量,结果如图5所示。

图5 接触时间对PAN-KTiO吸附Sr2+的影响Fig.5 Contact time vs Sr2+ adsorption on PAN-KTiO
由图5可得,PAN-KTiO对Sr2+的吸附是一先快、后慢、最终趋于平衡的过程。吸附开始阶段,吸附量随接触时间显著增大,此时Sr2+主要被吸附在吸附剂外表面;之后,随接触时间的增长,吸附量的增加速度逐渐减小,这是因为吸附剂外表面吸附位达到饱和后,Sr2+开始沿吸附剂表层孔径向内部扩散,同时内表面吸附发生;约24 h后吸附量基本不变,吸附趋于平衡,平衡吸附容量约为21.49 mg/g,因此之后的静态实验振荡时间选取24 h,以确保吸附达到平衡。
2) 溶液pH值
溶液pH值是影响吸附过程的重要因素之一,其对吸附剂本身及离子在溶液中的存在状态都会产生影响。当溶液pH值在1~11时,锶在溶液中主要以Sr2+的形式存在,而pH值大于12时,Sr(OH)+为主要存在形态[4]。在溶液温度30 ℃、Sr2+初始浓度5 mg/L、pH值2~12的条件下,考察溶液pH值对PAN-KTiO吸附Sr2+的影响,结果如图6所示。

图6 溶液pH值对PAN-KTiO吸附Sr2+的影响Fig.6 pH value of aqueous solution vs Sr2+ adsorption on PAN-KTiO
从图6可看出,溶液pH值为2.78时,PAN-KTiO对Sr2+的吸附容量仅约1 mg/g;pH值由2.78升至6.55时,PAN-KTiO对Sr2+的吸附容量显著增加,最高达到约22 mg/g;之后,pH值继续升高导致PAN-KTiO对Sr2+的吸附容量有所下降。这可能是因为在酸性条件下,pH值越低则H+浓度越高,而H+与Sr2+存在强烈的竞争,以争夺PAN-KTiO上的吸附位;在碱性条件下,随pH值的升高,Sr2+转变为其水解形式(Sr(OH)+、Sr (OH)2)的量增多[11],而Sr(OH)+和Sr(OH)2不能被PAN-KTiO吸附。由以上分析可知,溶液pH值在6.55附近,PAN-KTiO对Sr2+具有较高的吸附容量。
3) 竞争离子

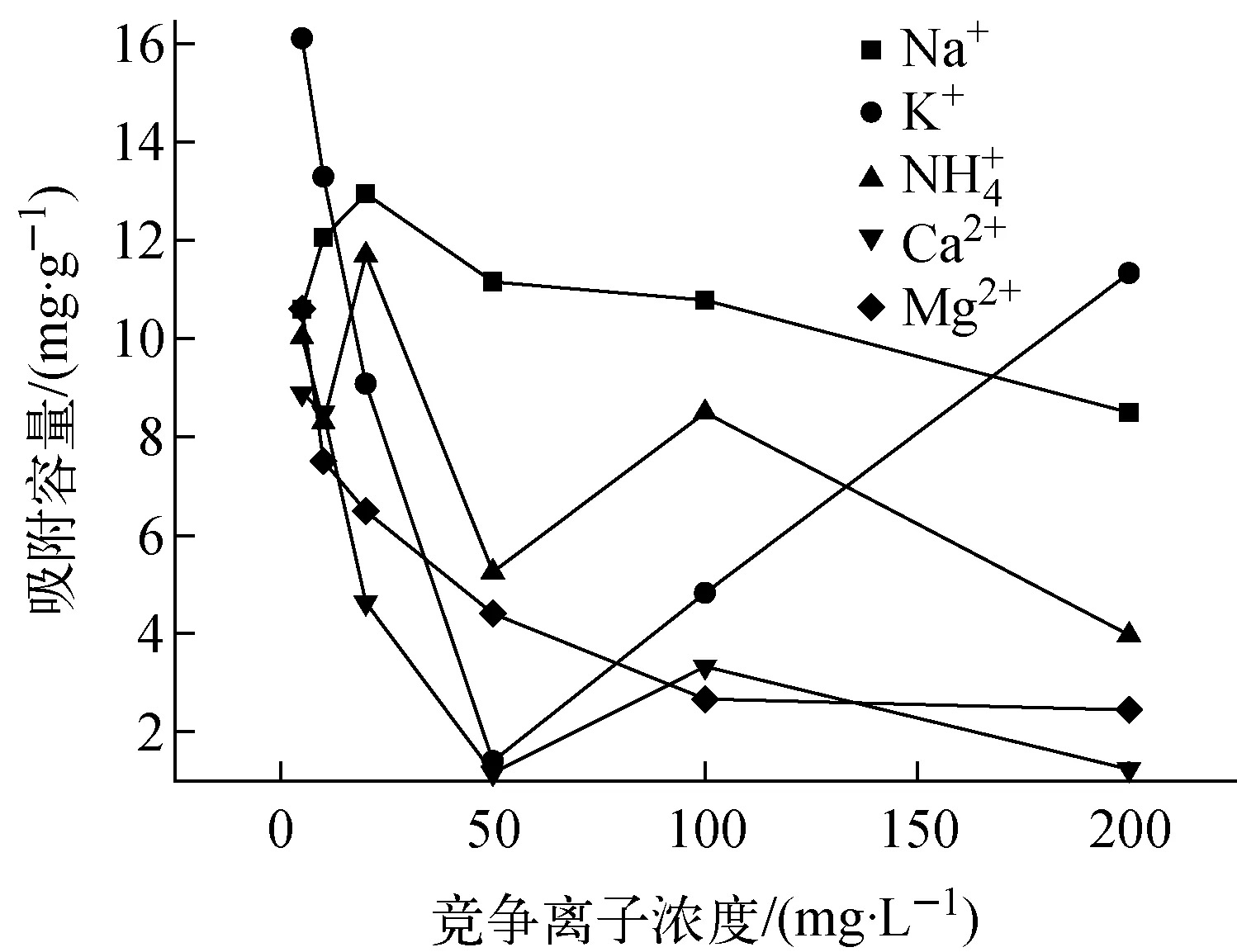
图7 竞争离子对PAN-KTiO吸附Sr2+的影响Fig.7 Competition ion vs Sr2+ adsorption on PAN-KTiO
4) 锶初始浓度

图8 锶初始浓度对PAN-KTiO吸附Sr2+的影响Fig.8 Initial Sr2+ concentration vs Sr2+ adsorption on PAN-KTiO
在溶液温度30 ℃、Sr2+初始浓度5~223 mg/L的条件下,考察PAN-KTiO对Sr2+的平衡吸附容量,结果如图8所示。
由图8可知,Sr2+初始浓度由5 mg/g增加到100 mg/g时,PAN-KTiO对Sr2+的平衡吸附容量随溶液中Sr2+初始浓度的增加而增大,Sr2+初始浓度较低时平衡吸附容量增大较快,Sr2+初始浓度较高时平衡吸附容量增大较慢,当Sr2+初始浓度大于100 mg/L时平衡吸附容量达到最大,约为53.60 mg/g。这可能是因为Sr2+初始浓度较低时,增大Sr2+浓度,能显著提高Sr2+与吸附位的接触概率,使吸附剂上的吸附位得到充分利用,但吸附剂上的吸附位数量有限,当Sr2+初始浓度达到一定值后,Sr2+浓度继续增大导致吸附逐渐趋于饱和。
2.3 PAN-KTiO对锶的吸附动力学
为更好地研究PAN-KTiO对Sr2+的吸附过程,分别采用准一级动力学方程和准二级动力学方程对PAN-KTiO吸附Sr2+的吸附动力学进行研究。
准一级动力学方程[13]为:
ln(qe-qt)=lnqe-k1t
准二级动力学方程[14]为:
式中:qe为平衡吸附容量,mg/g;qt为吸附t时间后的吸附量,mg/g;k1为准一级速率常数,h-1;k2为准二级速率常数,g/(mg·h)。k2可用于计算初始吸附速率h(mg/(g·h)),初始吸附速率为t→0时的吸附速率,其计算式[15]如下:
此外,还可由k2计算得到半吸附时间t1/2,半吸附时间为吸附量达到平衡吸附容量的一半所需的时间。通常可根据半吸附时间来衡量吸附速率,其计算方法[16]如下:
分别利用准一级动力学方程和准二级动力学方程对实验数据进行拟合,结果如图9所示,计算得到的相关动力学参数及h和t1/2列于表1。

图9 PAN-KTiO对Sr2+的准一级动力学(a)及准二级动力学(b)拟合Fig.9 Pseudo-first-order (a) and pseudo-second-order (b) kinetic plots for Sr2+ adsorption on PAN-KTiO

准一级动力学方程准二级动力学方程qe/(mg·g-1)k1/h-1R2qe/(mg·g-1)k2/(g·mg-1·h-1)t1/2/hh/(mg·g-1·h-1)R2qe实验值/(mg·g-1)15.8900.1310.91823.4410.013 33.2087.3080.99321.490
从图9及表1可看出,准二级动力学方程能更好地描述PAN-KTiO对Sr2+的吸附过程,其相关系数R2高达0.993,且由准二级动力学方程计算的平衡吸附容量与实验值更为接近,表明PAN-KTiO对Sr2+的吸附过程是以化学吸附为主[17]。
2.4 PAN-KTiO对锶的吸附等温线
采用Langmuir和Freundlich及Dubinin-Radushkevich(D-R)模型描述PAN-KTiO对Sr2+的等温吸附过程。Langmuir模型方程[18]为:
式中:Ce为平衡浓度,mg/L;Q0为饱和吸附容量,mg/g;KL为与吸附能力有关的Langmuir常数。PAN-KTiO对Sr2+的Langmuir吸附等温线如图10所示,相关参数列于表2。
由Langmuir常数KL可计算分离因子RL,并由此判断吸附剂与吸附质的亲和性,RL=0为不可逆吸附,0
RL随Sr2+初始浓度的变化曲线如图11所示。由图11可知,RL随Sr2+初始浓度的增大而减小,说明Sr2+初始浓度的增大有利于吸附的进行;在所考察的Sr2+初始浓度范围内,RL位于0.005 17~0.189之间,表明PAN-KTiO对Sr2+的吸附为有利吸附。

图10 PAN-KTiO对Sr2+的Langmuir吸附等温线Fig.10 Langmuir adsorption isotherm for Sr2+ adsorption on PAN-KTiO

表2 PAN-KTiO对Sr2+的吸附等温线参数Table 2 Adsorption isotherm parameter for Sr2+ adsorption on PAN-KTiO
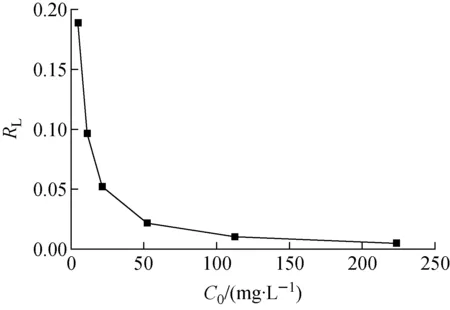
图11 PAN-KTiO对Sr2+的分离因子RLFig.11 RL for Sr2+ adsorption on PAN-KTiO
Freundlich模型方程[20]为:

图12 PAN-KTiO对Sr2+的Freundlich吸附等温线Fig.12 Freundlich adsorption isotherm for Sr2+ adsorption on PAN-KTiO
式中:KF为Freundlich常数,(mg/g)(L/mg)1/n,与吸附容量有关;1/n为非均相因子,与吸附强度有关。PAN-KTiO对Sr2+的Freundlich吸附等温线如图12所示,相关参数列于表2。
由表2可知,n为6.955,明显大于1,说明吸附质Sr2+容易被吸附剂PAN-KTiO所吸附[21]。
D-R模型线性形式[22]为:
lnqe=lnqm-KDε2
式中:qm为理论饱和吸附容量,mol/g;KD为D-R模型常数,mol2/kJ2;ε为Polanyi电位。
式中:R为理想气体常数,8.314 J/(mol·K);T为绝对温度,K。
PAN-KTiO对Sr2+的D-R吸附等温线如图13所示,相关参数列于表2。此外,由KD可计算得到吸附平均自由能E(E=(2KD)-1/2)[23]。
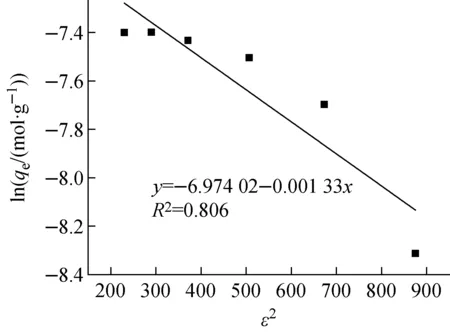
图13 PAN-KTiO对Sr2+的D-R吸附等温线Fig.13 D-R adsorption isotherm for Sr2+ adsorption on PAN-KTiO
由KD计算得到的E列于表2。由表2可知,E为19.389 kJ/mol,表明PAN-KTiO对Sr2+的吸附可能为化学吸附[24],这与2.3节中动力学分析所得结果一致。另外,KD<1.0,表明吸附剂表面粗糙且含有大量孔洞[23],这与PAN-KTiO的SEM表征结果一致。
由图10~13及表2可知,在所考察的吸附等温线模型中,Langmuir模型能更好地描述PAN-KTiO对Sr2+的吸附等温线,拟合所得相关系数最高,表明PAN-KTiO对Sr2+的吸附过程为单分子层吸附,PAN-KTiO对Sr2+的饱和吸附容量可达53.850 mg/g。
3 结论
1) PAN-KTiO表面粗糙,存在大量孔洞及裂缝,内部存在大量介孔结构,比表面积高达198.954 m2/g。KTiO具有层状结构,PAN-KTiO及KTiO所呈现的结构特点利于对Sr2+的快速吸附。
2) PAN-KTiO对Sr2+的吸附平衡时间约为24 h;PAN-KTiO吸附Sr2+时,溶液最佳pH值约为6.55;Ca2+、Mg2+对Sr2+在PAN-KTiO上的吸附存在较强的抑制作用,且抑制作用随溶液中Ca2+、Mg2+浓度的增加而增大;PAN-KTiO对Sr2+的平衡吸附容量随溶液中Sr2+初始浓度的增加先快速增大,之后趋于平缓,当溶液中Sr2+初始浓度大于100 mg/L时平衡吸附容量达到最大,约为53.60 mg/g。
3) 准二级动力学方程能更好地描述PAN-KTiO对Sr2+的吸附动力学过程,而Langmuir模型能更好地描述PAN-KTiO对Sr2+的吸附等温线;PAN-KTiO对Sr2+的吸附过程是以化学吸附为主的单分子层吸附,PAN-KTiO对Sr2+的饱和吸附容量可达53.850 mg/g。
