新辅助化疗对乳腺癌组织中HER-2、Ki-67表达的影响及其临床意义
2019-08-28王西礼
王西礼
新辅助化疗不单只是1种乳腺癌治疗方案,更是1种理想的体内药敏模型,为研究者提供了1个观察肿瘤生物标志物与药物敏感性或药物反应的途径,使得进一步研究肿瘤生物标志物对疾病患者治疗预后的预测能力成为可能。乳腺癌组织中HER-2、Ki-67是乳腺癌治疗方案的重要肿瘤生物标志物[1-5]。因此,有必要了解新辅助化疗对乳腺癌组织中HER-2、Ki-67表达的影响及其临床意义。为此,我院开展本研究,现报告如下。
1 资料与方法
1.1 一般资料
本研究经我院伦理学委员会批准,选取2016年7月至2017年6月我院术前通过活体组织检查确诊为 Ⅱb~Ⅲb 期乳腺癌并行保乳手术或改良根治术联合新辅助化疗患者120例。均为女性;均无化疗禁忌证;均无恶性肿瘤病史;均无并发其他恶性肿瘤;均签署知情同意书;均经新辅助化疗前影像学检查证实无远处转移;均在前未接受过任何正式治疗;年龄25~65岁,平均(48.25±5.81)岁;组织学分型:浸润性导管癌92例,浸润小叶癌9例,单纯癌8例,髓样癌6例,乳头状癌5例;TNM 分期:Ⅱb期42例,Ⅲa期37例,Ⅲb期41例。
1.2 新辅助化疗方案与临床疗效评价
手术前给予TP 方案或 T 方案治疗,手术后序贯 EC 方案治疗。TP 方案:75 mg/m2多西他赛(生产单位:四川美大康佳乐药业有限公司,批准文号:国药准字H20123223)静脉滴注,75 mg/m2顺铂(生产单位:云南个旧生物药业有限公司,批准文号:国药准字H53021677)静脉滴注,连用14 d 为1个周期,共4个周期;T 方案:100 mg/m2多西他赛静脉滴注,连用14 d 为1个周期,共4个周期;EC 方案:100 mg/m2表柔比星(生产单位:辉瑞制药(无锡)有限公司,批准文号:国药准字H20000497)静脉滴注,600 mg/m2环磷酰胺(生产单位:浙江海正药业股份有限公司,批准文号:国药准字H20093392)静脉滴注,连用14 d 为1个周期,共4个周期。根据实体肿瘤疗效评价标准将新辅助化疗对乳腺癌的临床疗效分为[6]:完全缓解(clinical complete response,CR):临床检查不到肿瘤,其中有淋巴结转移且原发肿瘤无浸润性病灶为原发灶完全缓解(tumorpathologic complete response,tp CR),原发肿瘤及淋巴结无浸润性病灶残留为病理完全缓解(pathologiccomplete response,p CR);部分缓解(partial response,PR):肿瘤最大长径总和缩小 30%以上;进展(progressive disease,PD):与最小值相比肿瘤最大长径总和增加20%以上;稳定(stable disease,SD):既不能满足 PR 又不能满足 PD 定义为 SD。疗效有效率(response rate,RR)=(CR+PR)/总例数×100%。
1.3 免疫组织化学检测与结果判定
新辅助化疗前后均行空芯针穿刺活检,常规病理标本处理。采用免疫组化 SP 法检测病理标本 HER-2、Ki-67 表达,试剂盒购自北京义翘神州科技有限公司,操作步骤按照试剂盒说明书进行。每批均设阳性对照及阴性对照,用已知阳性切片作为阳性对照,用磷酸缓冲盐溶液代替一抗作为空白对照。二氨基联苯胺显色,苏木精复染,树胶封片,病理科医生读片。
根据美国临床肿瘤学会和美国病理学家协会(ASCO/CAP)指南推荐的评分系统将 HER-2 分为阴性(0、+)和阳性(++、+++)[7]。根据StGallen国际乳腺癌会议专家共识的相关标准将 Ki-67 分为低表达(Ki-67<14%)和高表达(Ki-67≥14%)[8]。
1.4 统计学方法
所有数据均应用SPSS 20.00统计学软件进行统计学处理。计数资料采用配对资料卡方检验,以n(%)的形式表示,检验水准α=0.05。
2 结果
2.1 新辅助化疗的临床疗效
本组新辅助化疗RR 92例(76.66%),其中CR 16例(13.33%),PR 26例(63.33%),SD 24例(20.00%),PD 4例(3.33%)。
2.2 新辅助化疗前后乳腺癌组织中HER-2、Ki-67表达比较
新辅助化疗前后 HER-2 的阳性表达率,差异无统计学意义(P>0.05);新辅助化疗后Ki-67 的高表达率显著低于化疗前(P<0.05)。见表1。
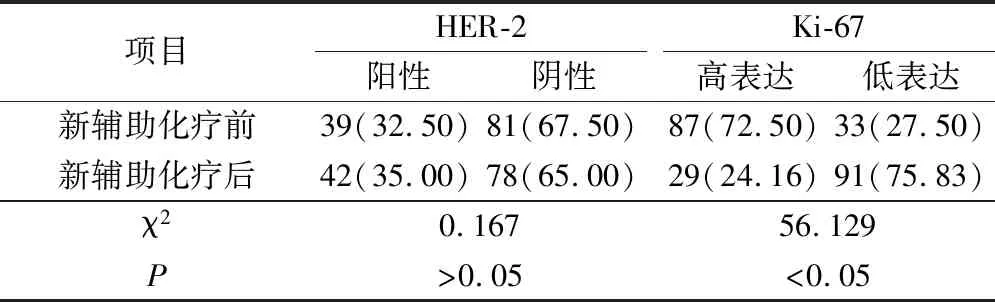
表1 新辅助化疗前后乳腺癌组织中HER-2、Ki-67表达比较(例,%)
2.3 新辅助化疗前乳腺癌组织中HER-2、Ki-67表达与新辅助化疗疗效的关系
新辅助化疗前 HER-2 阳性表达患者的新辅助化疗疗效显著优于阴性表达患者(P<0.05);新辅助化疗前Ki-67高表达患者的新辅助化疗疗效显著优于低表达患者(P<0.05)。见表2。

表2 新辅助化疗前乳腺癌组织中HER-2、Ki-67表达与新辅助化疗疗效的关系(例,%)
3 讨论
目前,新辅助化疗被广泛应用于乳腺癌患者的初始治疗,为局部晚期乳腺癌患者提供了手术机会,改善了行保乳手术或改良根治术的乳腺癌患者预后,具有较为优异的临床疗效。本组新辅助化疗的临床RR为76.66%,其中CR为 13.33%,PR 为63.33%,SD为 20.00%,PD 为3.33%,与张崇建等[9-11]研究者报道一致。
本研究结果显示,新辅助化疗后乳腺癌组织中 Ki-67 高表达率明显降低。提示,新辅助化疗改变了肿瘤生物学信息造成生物标志表达的改变。许雪宁等[12]研究者指出,Ki-67 高低表达的Ⅱ~Ⅲ期乳腺癌患者之间新辅助化疗疗效具有显著差异性,因此Ki-67 的表达情况可用于预测新辅助化疗疗效。本研究结果显示,新辅助化疗前 Ki-67 高表达患者的新辅助化疗疗效显著优于低表达患者。有研究报道,Ki-67 表达程度与肿瘤增殖活性呈正相关。提示,新辅助化疗前 Ki-67 高表达患者对化疗敏感性更高,Ki-67 表达情况可以预测新辅助化疗药物的敏感性。这种结局的形成可能是因为 Ki-67 高表达者肿瘤细胞增殖活跃,且细胞毒性药物对增殖活跃的肿瘤细胞具有更强的杀伤力有关。而蒋程凤等[13]研究者则有不同发现,指出新辅助化疗前后乳腺癌患者 Ki-67 的表达情况无明显变化,同时认为 Ki-67 不能预测新辅助化疗疗效。笔者认为,腺癌组织中 Ki-67 表达异质性问题所致[14]。
本研究结果显示,新辅助化疗前后 HER-2 的阳性表达率无明显变化,这可能与 HER-2 过表达和基因扩增的改变较晚有关。樊新咏等[15]研究者指出,HER-2 阳性表达可用于预测新辅助化疗药物的敏感性。本研究结果显示,新辅助化疗前 HER-2 阳性表达患者的新辅助化疗疗效显著优于阴性表达患者。有研究报道,HER-2 表达程度与肿瘤增殖活性呈正相关。提示,新辅助化疗前 HER-2 阳性表达患者对化疗敏感性更高,HER-2 表达情况可以预测新辅助化疗药物的敏感性。这种结局的形成可能是因为 HER-2 阳性表达肿瘤细胞增殖活跃,且细胞毒性药物对增殖活跃的肿瘤细胞具有更强的杀伤力有关。
综上所述,本研究探讨了新辅助化疗对乳腺癌组织中HER-2、Ki-67表达的影响及其临床意义。
