蓝莓叶内芦丁含量的检测
2019-08-27武玉祥万合锋封天洪李永霞文光琴聂飞
武玉祥 万合锋 封天洪 李永霞 文光琴 聂飞

摘要 [目的]充分利用蓝莓叶资源,研究蓝莓叶内药效活性物质芦丁的含量,建立一种检测蓝莓叶内芦丁含量的方法。[方法]采集裁剪后的蓝莓叶经清洗、水分晾干、低温预冷冻、真空冷冻干燥、甲醇回流提取、过滤、甲醇定容后,采用高效液相色谱法测定芦丁含量,色谱柱为Diamonsil RP-18e(250 mm×4.0 mm,5 μm),以乙腈-四氢呋喃磷酸水溶液(四氢呋喃/磷酸水溶液的体积比为5∶95,pH 3.0)为流动相,流速1 mL/min,柱温35 ℃,检测波长350 nm,进样量20 μL。[结果]10个品种的蓝莓裁剪叶内芦丁的平均含量为11.52 mg/g,其中芦丁含量最高的品种蓝雨为12.837 mg/g,芦丁含量最低的品种芭尔德温为10.600 mg/g。芦丁量在0.402 8~4.028 0 μg范围内与峰面积呈现良好的线性关系。芦丁平均回收率为98.41%,RSD为1.59%。[结论]裁剪后的蓝莓叶内芦丁含量丰富,该方法操作简便、结果准确、精密度高、重现性好,可用于蓝莓叶内芦丁的含量检测。
关键词 蓝莓叶;芦丁;含量;检测
中图分类号 TS255.7文献标识码 A
文章编号 0517-6611(2019)13-0188-04
doi:10.3969/j.issn.0517-6611.2019.13.058
开放科学(资源服务)标识码(OSID):
Abstract [Objective]In order to make full use of the resources of blueberry leaves and research the content of rutin in blueberry leaves,a method for the determination of rutin in abandoned blueberry leaves was established.[Method]Gathering the cut blueberry leaves,and then cleaning,air drying,low temperature prefreezing;vacuum freeze drying,methanol circumfluence extraction,filtration,methanol constant volume,rutin content was determined by HPLC.The column was Diamonsil RP18e(250 mm×4.0 mm,5 μm),the mobile phase was acetonitriletetrahydrofuran phosphoric acid solution (the volume ratio of tetrahydrofuran/ phosphoric acid solution was 5 μm,pH 3.0),the flow rate was 1mL/min,the column temperature was 35 ℃,the detection wavelength was 350 nm,the injection dose was 20 μL.[Result]The average content of rutin in cut leaves of 10 varieties of blueberry was 11.52 mg/g.The highest rutin content was 12.837 mg/g in Bluerain,and the lowest was 10.6 mg/g in Biloxi.There was good linear relationship when the content of rutin was in the range of 0.402 8-4.028 0 μg,respectively.The average recovery ratio of rutin was 98.41% and RSD was 1.59%.[Conclusion]The cut blueberry leaves are rich in rutin content.The method is simple,accurate,high precision and reproducible.It can be used to detect the quality of rutin in blueberry leaves.
Key words Blueberry leaves;Rutin;Content;Detection
基金項目 贵州省重大科技专项“山地蓝莓产业关键技术研究与应用”(黔科合重大专项字〔2015〕6013);贵州省平台建设“贵州蓝莓工程技术研究中心建设”(黔科合平台人才〔2016〕5202号);贵州省院合作专项“高丛蓝莓产业化高效栽培技术研究及示范”(黔科院SY字〔2016〕03-1);贵州科学院青年基金项目(黔科J合字〔2017〕14号)。
作者简介 武玉祥(1985—),男,山东临沂人,硕士,助理研究员,从事分子生物学研究。 *通信作者,研究员,从事小浆果种质资源培育、繁殖与栽培研究。
收稿日期 2019-01-10
蓝莓,英文名:blueberry(Vaccinium Spp),双子叶植物,属杜鹃花科(vacciniaceae)越桔属(Vaccinium),多年生落叶或常绿灌木[1],其成熟果实为蓝色,因富含多种营养物质和花青素等生物活性物质而备受广大消费者喜爱,被联合国粮农组织(Food and agriculture organization of the united nations)誉为“人类五大健康食品之一”[2]。目前对蓝莓的研究主要集中在蓝莓栽培、品种繁育、果实花青素及果实深加工等方面[3]。
近年来,随着我国蓝莓产业的迅速发展,对蓝莓叶的研究也逐渐增多[2],蓝莓叶内富含多糖、原花青素、花色苷、黄酮类等多种生物活性物质和微量元素[4],对蓝莓叶的研究主要集中在叶内生物活性物质的提取、功能性饮料研发、蓝莓叶鞣制茶等[5-6],这些产品进入市场后反响较好[7]。但由于蓝莓叶开发的产品主要以蓝莓嫩叶、嫩芽作为原料,就蓝莓而言[8],为增加产量及果实质量(果粉厚度、果实颜色等),大多在定株时只保留3~5个主枝,树心中空以保证透光性,目的是增加果实的产值,没有过多的嫩叶、嫩芽可用于采摘[9-10]。嫩叶、嫩芽的采摘期主要集中在春季和夏季,这2个季节正是蓝莓生长旺盛期,大部分的营养物质、养分等都是经光合作用、蒸腾作用等产生[11],在这一时期采集嫩芽、嫩叶会减少植株整体叶片数量,进而降低光合作用速率和蒸腾作用能力,对植株生长和果实的发育造成不良影响[12]。每年蓝莓采摘后1个月左右进入蓝莓裁剪季节,大量的蓝莓枝叶被丢弃或被焚烧,造成了资源浪费和环境污染[4],被摒弃的蓝莓枝上大多是健康的蓝莓叶,可利用资源(生物活性物质)较多,其中黄酮类化合物芦丁(Rutin)、芸香苷等含量丰富,在蓝莓叶内含量可达13.12 mg/g[1],芦丁及其合成物曲克芦丁具有广泛的药理活性,可降低毛细血管的通透性和脆性,保持和恢复毛细血管弹性,临床主要用于防治高血压、脑溢血、糖尿病、视网膜出血和出血性紫癜等心脑血管疾病,也可用作食品抗氧化剂和色素[8]。
笔者对裁剪丢弃的蓝莓枝条上的叶片进行芦丁的提取并利用高效液相色谱法测定芦丁的含量,旨在为蓝莓叶的资源利用和蓝莓叶内芦丁药材质量检测方法的建立提供依据。
1 材料与方法
1.1 仪器
真空冷冻干燥机(LGJ-10N,北京亚星仪器科技有限公司);高效液相色谱仪(U3000, 德国赛默飞世尔公司);旋转蒸发仪(Re-205,上海予华公司);电子分析天平(ME104E,德国梅特勒托利多公司;ALC-210.4, 瑞士沙多利斯公司);优普超纯水仪(H03,成都优普有限公司);电子调温电热套(98-1-B,天津泰斯特仪器有限公司);循环水真空泵(SHB,郑州长城科技有限公司);超声波清洗器(KQ-1000DE,昆山舒美公司);電热鼓风干燥箱(101-AB,天津泰斯特公司);超低温冰箱(DW-86L102,澳柯玛公司);研钵、pH计(PHS-25,上海雷磁仪器厂)。
1.2 试药
蓝莓叶采自贵州省麻江县瑞蓝果业有限公司,采集时间为2018年9月中旬,采集裁剪蓝莓枝叶,品种共10个,分别为蓝雨(Blue-rain)、奥尼尔(ONeal)、密斯提(Misty)、夏普蓝(Sharpblue)、莱格西(Legacy)、顶峰(Climax)、芭尔德温(Baldwin-T-117)、早蓝(Earliblue)、灿烂(Britewell)、粉蓝(Powderblue),其中供试品是蓝雨品种叶片。采集无病害、新鲜健康叶片。对照品来源:芦丁对照品购自美国Sigma公司,纯度 ≥ 96%;甲醇、乙腈为色谱纯,其他试剂均为分析纯,水为去离子水(pH 7.2)。
1.3 方法
1.3.1 溶液的配制。
1.3.1.1 对照品溶液。
精密称取真空干燥至恒重的芦丁对照品10.07 mg,置于25 mL的灭菌后烘干容量瓶中,加分析甲醇至刻度线,充分摇匀,得质量浓度为0.402 8 mg/mL的芦丁标准品溶液,备用。
1.3.1.2 供试品溶液。将采摘的新鲜蓝莓叶用灭菌去离子水冲洗干净,在灭菌15 min后的超净工作台上晾干叶片表面水分,置于-60 ℃的超低温冰箱中预冻12 h,然后转入真空冷冻干燥机,真空度10 Pa,冷阱温度-50 ℃,隔板加热温度25 ℃,连续干燥24 h至恒重,取出后迅速放入预冷研钵(研钵置于-20 ℃预冷30 min)快速研磨,粉末过50目筛,密封于50 mL离心管中再放入可封口样品袋中,-60 ℃保存备用。精密称量在干燥器中平衡过夜的蓝莓叶粉末0.501 5 g,置于索氏提取器中,加入甲醇100 mL,55 ℃水浴加热,回流提取3 h,将液体过滤,回收滤液,将滤液挥发,用甲醇定容到10 mL,摇匀,经0.45 μm微孔滤膜过滤,滤液作为供试品溶液备用。
1.3.2 方法学试验。
1.3.2.1 色谱条件及系统适应性试验。
选用 Diamonsil RP-18e(250 mm×4.0 mm,5 μm)色谱柱;以乙腈/四氢呋喃磷酸水溶液(四氢呋喃∶磷酸水溶液=5∶95,V/V,pH 3.0)为流动相,流速1.0 mL/min;进样量 10 μL;柱温35 ℃;检测波长350 nm。在选定条件下,芦丁与杂质峰基线分离,分离度(R)>1.5,芦丁塔板数 >3 000。
1.3.2.2 芦丁标准曲线的绘制。取质量浓度为0.402 8 mg/mL对照品溶液,按“1.3.2.1”色谱条件分别进样1、2、4、6、8、10 μL测定峰面积,以峰面积(mAU)为纵坐标(y),以质量浓度为横坐标(x),绘制标准曲线,计算线性回归方程。
1.3.3 精密度试验。
取对照品溶液,连续进样5次,每次10 μL,均按照“1.3.2.1”色谱条件测定峰面积,根据5次对照品峰面积计算相对标准偏差(RSD),要求RSD<3%。
1.3.4 稳定性试验。取对照品溶液、供试品溶液各1份,室温下分别放置0、2、4、12、24、48 h后,依“1.3.2.1”色谱条件测定峰面积,计算芦丁峰面积的相对标准偏差(RSD),要求RSD<3%。
1.3.5 重复性试验。
取蓝莓叶6份,按照“1.3.1.1”样品处理方法,按照“1.3.2.1”色谱条件,每份进2针,每针20 μL,计算芦丁的含量及相对标准偏差(RSD),要求RSD<3%。
1.3.6 加样回收率试验。
根据线性范围设计芦丁含量高、中、低3种水平,精密吸取已测知芦丁含量的蓝莓叶适量,分低、中、高3个水平,每水平3份,再分别按要求精密加入一定量的对照品,按“1.3.2.1”测定芦丁含量,计算回收率。
2 结果与分析
2.1 方法学试验结果
2.1.1 系统适应性。由图1可知,芦丁对照品在16.310 3 min处出现最大吸收峰,主峰峰形尖锐无杂峰;样品密斯提在16.500 min处出现最大吸收峰,且主峰峰形尖锐,无杂峰;样品蓝雨、奥尼尔分别在16.510 2和16.620 2 min出现最大吸收峰,主峰峰形尖锐无杂峰。各样品与对照品最大吸收峰时间十分接近,都在16.5 min左右,对照品和样品分别进样2针,峰形重叠良好。
2.1.2 芦丁标准曲线绘制。按“1.3.2.1”色谱条件分别进样1、2、4、6、8、10 μL,获得芦丁标准曲线方程为y=1 185.3 x+22.383,R2=0.999 9,表明芦丁含量在0.402 8~4.0280 μ g范围内线性关系良好,可用外标法进行测定和计算,标准曲线见图2。
2.1.3 精密度。按照“1.3.2.1”色谱条件操作,芦丁的RSD=1.36%(n=5),表明仪器精密度良好。
2.1.4 稳定性。按照“1.3.2.1”色谱条件,获得芦丁的RSD=0.809%,表明样品供试液在48 h内稳定。
2.1.5 重复性。按照“1.3.5”进行操作,获得芦丁RSD=1.48%,表明该方法具有较好的重复性。
2.1.6 加样回收率。由表1可知,芦丁的加样平均回收率为98.41%,RSD值为1.59%,表明加样回收率符合要求。
2.2 样品中芦丁含量的测定结果
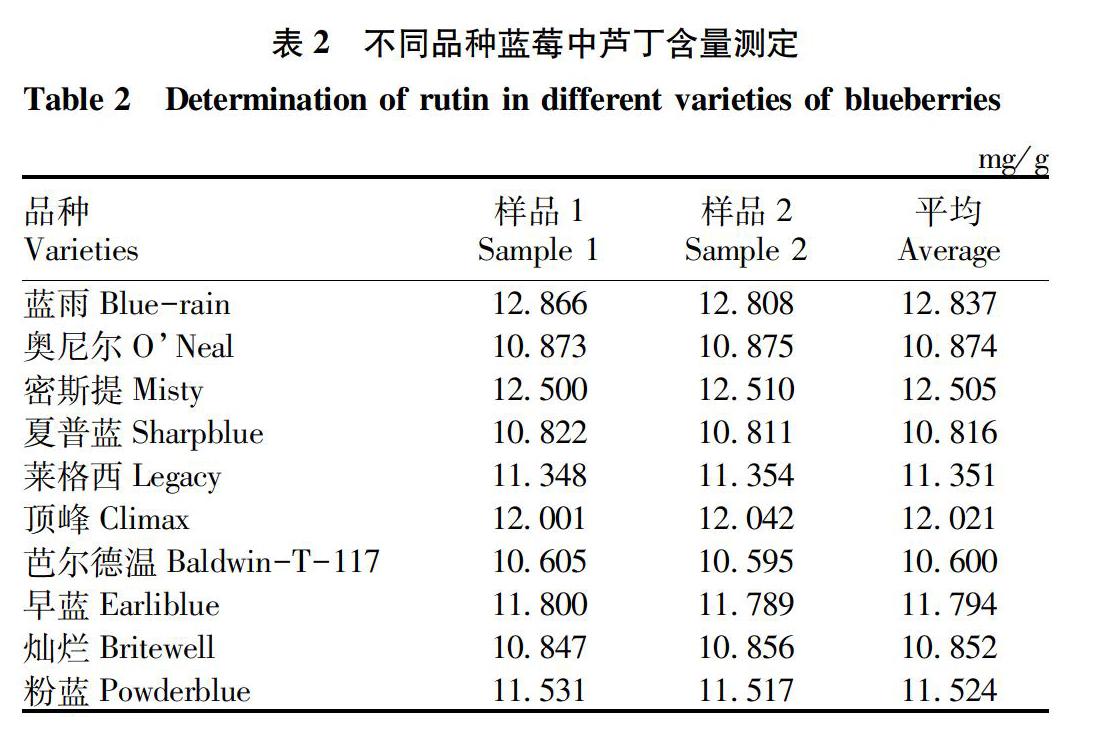
取10个品种的蓝莓叶,按照供试品溶液制备方法操作,每批平行操作2份,结果见表2。由表2数据可以计算得出,10个品种的蓝莓裁剪叶内芦丁的平均含量为11.517 5 mg/g。
3 结论与讨论
蓝莓富含多种营养成分和花青素、多酚、黄酮等生物活性成分,具有保护视力、提高免疫力、预防抑制癌症等多种保健功效,因而备受广大消费者欢迎[2]。截止到2018年,贵州省蓝莓栽培总面积超过1.33万hm2[13],占全国蓝莓种植面积的1/3,年产量3万t,均居全国首位;产值20亿元,带动农民增收10亿元,带动旅游、运输、冷藏、包装等多行业发展,产业链总产值超过30亿元。蓝莓在贵州省经济中占较大比重,是农民脱贫、致富的重要支撑产业[13]。
每年蓝莓采摘后(9月份)进入蓝莓修剪期,这一时期蓝莓枝叶生长旺盛,近年来课题组调查发现,随着贵州省蓝莓种植规模扩大,大量的蓝莓枝叶被堆积、丢弃、焚烧,造成了资源浪费和环境污染等问题,给蓝莓种植户和种植企业造成极大困扰,是目前蓝莓产业中亟待解决的问题。芦丁因具有较强的药理活性,毒性低,具有抑制出血、治疗轻度腹泻、保护血管等作用[14],在自然界植物中广泛存在[15],其中越桔属植物蓝莓,其叶内芦丁含量丰富[2],我国东北地区民间常用野生蓝莓叶煮水治疗腹泻。
不同品种的蓝莓枝叶中芦丁的含量存在差异[11,16-17],该试验选取贵州地区主要栽培蓝莓品种中的南高丛品种密斯提(Misty)、奥尼尔(O' Neal)、夏普蓝(Sharpblue),北高丛蓝莓品种早蓝(Earliblue)、莱格西(Legacy),兔眼蓝莓粉蓝(Powderblue)、芭尔德温(Baldwin-T-117) 、顶峰(Climax)、灿烂(Britewell)[5,18],杂交品种蓝雨(Blue-rain)為研究对象,测定不同品种蓝莓叶内芦丁含量,为开发蓝莓叶芦丁提供重要依据。研究表明:不同的干燥方式(热风干燥、真空干燥、微波干燥、真空冷冻干燥等)对蓝莓叶内芦丁分离含量和抗氧化活性影响较大[8,19-21],其中真空冷冻干燥获得的芦丁含量最高(10.20 mg/g),抗氧化活性最强。利用微乳液相色谱法分离测得蓝莓叶内的芦丁含量较高,达13.12 mg/g。该试验选取最佳干燥方式中低温、低氧分压的真空冷冻干燥法分离蓝莓叶内的芦丁,保证了芦丁的活性,采集裁剪后的蓝莓叶,避免了资源的浪费和焚烧等不当处理带来的环境污染。再采用索氏甲醇回流提取的方法,将温度上限设置至55 ℃,减少芦丁活性损失。经多次试验,发现以乙腈/四氢呋喃磷酸水溶液(四氢呋喃/磷酸水溶液=5∶95,V/V,pH 3.0)为流动相,流速1.0 mL/min,进样量 10 μL,柱温35 ℃,检测波长350 nm时,出峰最多,峰形最佳[22]。
采用高效液相色谱法测定了10个品种蓝莓叶内的芦丁含量,平均值为11.52 mg/g,其中含量最高的品种蓝雨为12.837 mg/g,含量最低的品种芭尔德温为10.600 mg/g。通过该方法处理后,发现蓝莓叶HPLC共有峰6个,可为蓝莓叶HPLC指纹图谱建立提供一定依据。该方法操作简便、结果准确、灵敏,重现性、回收率均符合要求,可用于蓝莓叶药材质量的控制。
参考文献
[1] 李晓英,薛梅,樊汶樵,等.不同干燥方式对蓝莓叶中酚类物质及其抗氧化活性的影响[J].中国农业科学,2018,51(13):2570-2578.
[2] 马田田.笃斯越桔叶营养成分分析[J].特产研究,2001(1):19-21.
[3] 王彦章,孙丽娜,赵志亮,等.蓝莓的研究概况[J].农村经济与科技,2018,29(8):37,39.
[4] 李颖畅,吴笳笛,孙建华,等.化学发光法测定蓝莓叶黄酮提取物对氧自由基的清除作用[J].中国调味品,2009,34(12):102-105.
[5] 谢国芳,刘潇,田永林,等.贵州主栽蓝莓果实大小品质特性分析[J].食品与发酵工业,2018,44(3):165-169.
[6] 孙英新,白孝明,王丹丹.蓝莓种质资源遗传多样性的EST-SSR分析[J].辽东学院学报(自然科学版),2018,25(1):31-35.
[7] 严红光,程江华,姚平伟,等.蓝莓叶红茶活性成分分析[J].安徽农业科学,2016,44(34):73-75,149.
[8] 李茂星,谢景文,葛欣.芦丁的药效学研究进展[J].华西药学杂志,2000,15(6):450-451.
[9] 朱亮环,王海鹏,郭文英,等.蓝莓幼树修剪技术[J].河北果树,2018(2):59.
[10] 邓婧.种植蓝莓收益丰[J].农家致富,2018(4):6-7.
[11] 王少希,杨伟,周丽恒.蓝莓的生物学特征及水肥一体化栽培技术[J].现代农业科技,2018(2):75-76,78.
[12] 赵金海,王雷,黄国庆,等.蓝莓的营养成分测定及保健功能研究[J].黑龙江科学,2018,9(9):26-27.
[13] 任春光,杨丰,黄振兴,等.贵州省蓝莓主栽区真菌病害调查初报[J].中国森林病虫,2018,37(2):22-27.
[14] 林靜.芦丁的临床药理特点[J].中国临床药理学杂志,2009,25(3):256,263.
[15] 李玉山.芦丁的资源、药理及主要剂型研究进展[J].氨基酸和生物资源,2013,35(3):13-16.
[16] 熊操.蓝莓的营养保健功能及其开发利用[J].双足与保健,2018(8):55,57.
[17] 矫馨瑶,李恩惠,王月华,等.蓝莓多酚稳定性及热降解动力学研究[J].中国食品学报,2018,18(1):81-87.
[18] 管旭芳,于晓云,王英华,等.进口蓝莓有害生物风险分析及风险管理措施[J].浙江农业科学,2018,59(4):613-616.
[19] 赵丹,苏宁,郑洪艳,等.微乳液相色谱法对蓝莓叶黄酮类化合物的分离和测定[J].食品科学,2015,36(14):91-95.
[20] 韩宝来,李元元,张玲玲,等.芦丁的光谱分析[J].化学与黏合,2017(1):72-76.
[21] CHU W J,GAO H Y,CAO S F,et al.Composition and morphology of cuticular wax in blueberry (Vaccinium spp.) fruits[J].Food chemistry,2017,219:436-442.
[22] 武玉祥,王小平,王虹,等.HPLC法检测光枝勾儿茶内芦丁和槲皮素方法的建立[J].安徽农业科学,2016,44(13):164-166.
