维管束发育相关基因sm-Nvas对水稻稻瘟病抗性分析
2019-08-27张俊卢卫谭艳平刘学群王春台
张俊 卢卫 谭艳平 刘学群 王春台
摘要 [目的]探究烟草维管束发育相关基因sm-Nvas对水稻稻瘟病的抗性。[方法]构建pCAMBIA1305.1-sm-Nvas双元表达载体,利用农杆菌介导的愈伤转化法转化水稻YTB,对转基因阳性植株接种稻瘟病菌后进行抗性观察。[结果]成功构建了pCAMBIA1305.1-sm-Nvas双元超表达载体,获得了转sm-Nvas YTB植株。离体接种稻瘟病菌后转基因植株的病斑比受体品种YTB的小。 [结论]转sm-Nvas基因水稻具有稻瘟病抗性。
关键词 维管束;sm-Nvas;稻瘟病;抗性
中图分类号 S188文献标识码 A
文章编号 0517-6611(2019)13-0090-02
doi:10.3969/j.issn.0517-6611.2019.13.029
开放科学(资源服务)标识码(OSID):
Analysis on Resistance of Tobacco Vascular Bundle Related Gene smNvas to Rice Blast
Abstract [Objective]To investigate the resistance of tobacco vascular bundle related gene smNvas to rice blast. [Method]A plant binary expression vector pCAMBIA1305.1smNvas was constructed, and transformed to recipient variety YTB by Agrobacteriummediated callus transformation. The resistance of the transgenic positive plant was investigated after inoculation with the rice blast fungi. [Result]The pCAMBIA1305.1smNvas binary overexpression vector was successfully constructed, and the transgenic YTB with smNvas was obtained. The scab of the transgenic plant was smaller than that of the receptor variety YTB after inoculation of rice blast fungi in vitro. [Conclusion]The transgenic rice with smNvas gene is resistance to rice blast.
Key words Vascular bundle;smNvas;Rice blast;Resistance
植物维管束是植物体内一种相互连通的系统,连接植物地下部和地上部,在支撑植物向上生长以及水分和营养物质的运输上起到了关键作用[1]。许多病虫害也能利用维管束系统在植物体内传播,影响植物的生长发育[2]。维管束相关基因在维管束系统中特异表达,从而调节维管束生长发育,增强植物维管束病虫害的防控能力[3-5]。杨泽峰等[6]发现水稻TAL基因在维管组织中特异表达,RNA干涉该转基因植株水稻后,表型出现矮化和叶片卷曲易染病的特征。马玲[7]发现水稻AVB基因启动子在水稻维管束韧皮部特异表达,可应用于维管束疾病的防治。Singer 等[8]发现脐橙蔗糖合成酶1(CsSUS1p)启动子可以驱动外源基因在维管束韧皮部表达,可应用于防治维管束疾病。Liu等[9]采用差異显示技术,从烟草中分离得到一个受甲基茉莉酸和水杨酸双重诱导的基因序列,该基因启动子使外源基因在维管束组织中特异表达[10],命名为sm-Nvas。为了研究sm-Nvas基因在水稻中是否与病害的抗性相关,笔者以pCAMBIA1305为骨架构建sm-Nvas基因的超表达载体,并转入水稻品种粤泰B(YTB)中,考察水稻中超表达sm-Nvas对水稻稻瘟病抗性的影响,以期为揭示该基因的生物学功能提供证据。
1 材料与方法
1.1 材料
稻瘟病菌race007、水稻粤泰B(YTB)、W38型烟草、根瘤农杆菌EHAI05、载体pCAMBIA1305、载体PUD18-T均由中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室提供。rTaq酶、DNA分子质量Marker购买于TaKaRa公司;DNA引物合成由擎科生物技术有限公司(武汉部)完成。
1.2 仪器
FC5515R微型高速冷冻离心机(美国);C1000 touch thermal cycler PCR仪(美国Bio-Rad);Universal Hold Ⅱ凝胶成像系统(美国);SBD50-1 Heto-Holten水浴锅(丹麦);Nikon SMZ1500 Microscop荧光体式显微镜(日本)。
1.3 方法
1.3.1 植株表达载体的构建。
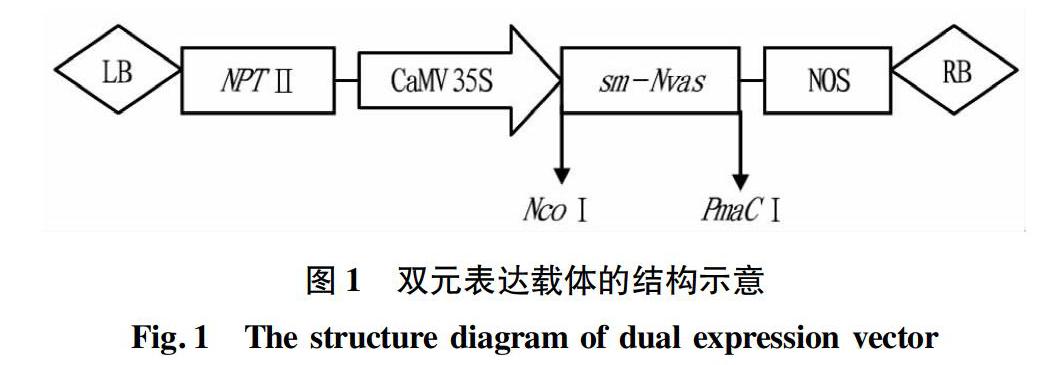
维管束发育相关基因sm-Nvas全序列参考文献[9],通过软件分析并利用具有PmaC I和Nco I酶切位点引物扩增sm-Nvas基因全长。用PmaC I和Nco I双酶切sm-Nvas基因PCR扩增产物和pCAMBIA1305.1载体质粒DNA,经过电泳及回收,用T4 DNA连接酶连接质粒与目的片段(图1),然后转化到大肠杆菌中,提取质粒DNA用载体引物进行菌落PCR检测,大小正确的质粒进一步进行测序鉴定。
1.3.2 根瘤农杆菌介导的遗传转化。
将构建成功的双元表达载体电击转化农杆菌EHA105,筛选阳性农杆菌,用MS培养基将转化成功的农杆菌悬浮培养到菌液浓度OD600约为0.5,将受体品种YTB种子诱导的愈伤组织在浸染液中浸染30 min,将干燥的愈伤组织转移到共培养基上暗培养3 d,在筛选培养基暗培养20 d,转移到分化培养基上光培养30 d左右,最后移到生根培养基上继续培养15 d左右,炼苗并种植。
1.3.3 阳性植株的鉴定。
采用CTAB法进行DNA样品抽提。取转基因水稻叶片,加液氮后迅速研磨成粉末状,加入65 ℃预热的CTAB提取液并充分混匀,放入水浴锅中1 h后至室温,加入等体积氯仿∶异戊醇(24∶1),混匀离心取上清液,加入2倍体积无水乙醇,混匀后冰浴。离心弃上清,用75%乙醇洗涤沉淀,沉淀自然风干后加TE溶解,-20 ℃保存。
利用引物HPTF226(序列为5-GAAGTGCTTGACATTGGGGAGT-3)和HPTF697(序列为5-AGATGTTGGCGACCTCGTATT-3)进行潮霉素检测。15 μL PCR反应体系包括1.5 μL 10×rTaq buffer、引物F和R(10 μmol/L)各0.25 μL、1 μL dNTP Mix(2.5 mmol/L)、0.1 μL rTaq酶(5 U/μL)、1.5 μL DNA模板和10.4 μL去离子水。反应程序为94 ℃预变性3 min;94 ℃变性30 s,57 ℃复性30 s,72 ℃延伸1 min,34个循环;72 ℃延伸5 min。反应结束后用1%琼脂糖凝胶检测。
1.3.4 转基因水稻的种植及抗病性鉴定。
常规方法在温室盆栽转sm-Nvas水稻株系及对照品种粤泰B(YTB)。
取保存于-20 ℃的稻瘟病菌生理小种race007菌株于燕麦培养上活化后并扩大培养,待菌体覆盖整个燕麦培养基表面后,除去白色菌丝置于紫光灯下培养产孢,配制孢子悬浮液,取水稻剑叶置于苯并咪唑湿润滤纸上,将孢子悬浮液喷洒在水稻叶片上,保湿培养后观察发病情况。
2 结果与分析
2.1 sm-Nvas超表达双元载体构建
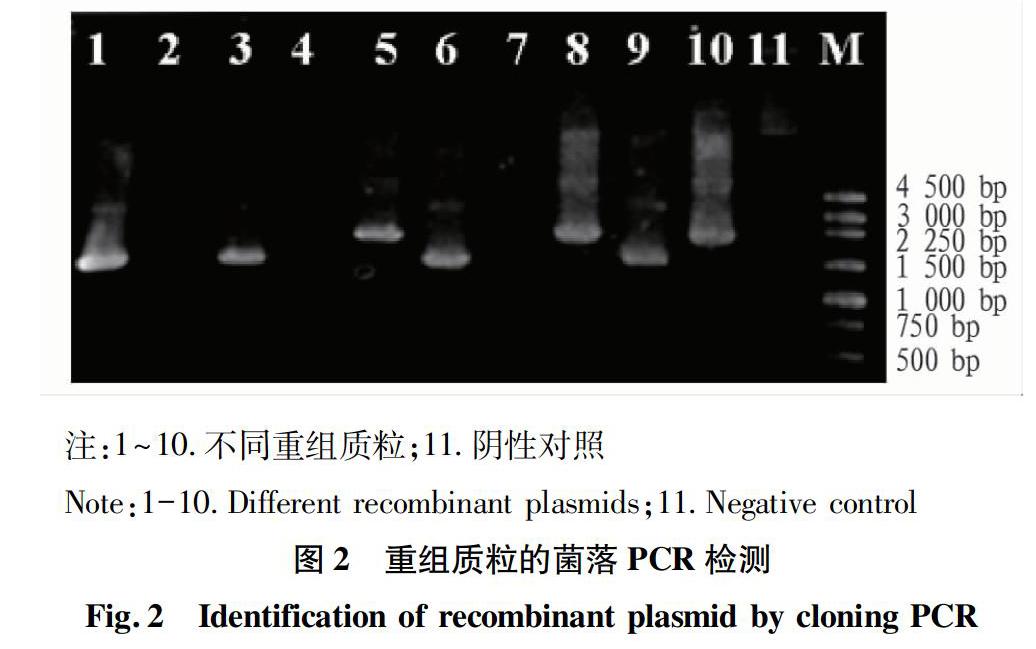
将构建好的表达载体进行菌落PCR检测,扩增出的目的条带与预期大小相符的有泳道3、6、9共3个阳性克隆(图2),进一步的测序结果表明超表达载体构建成功。
2.2 转基因植株阳性鉴定
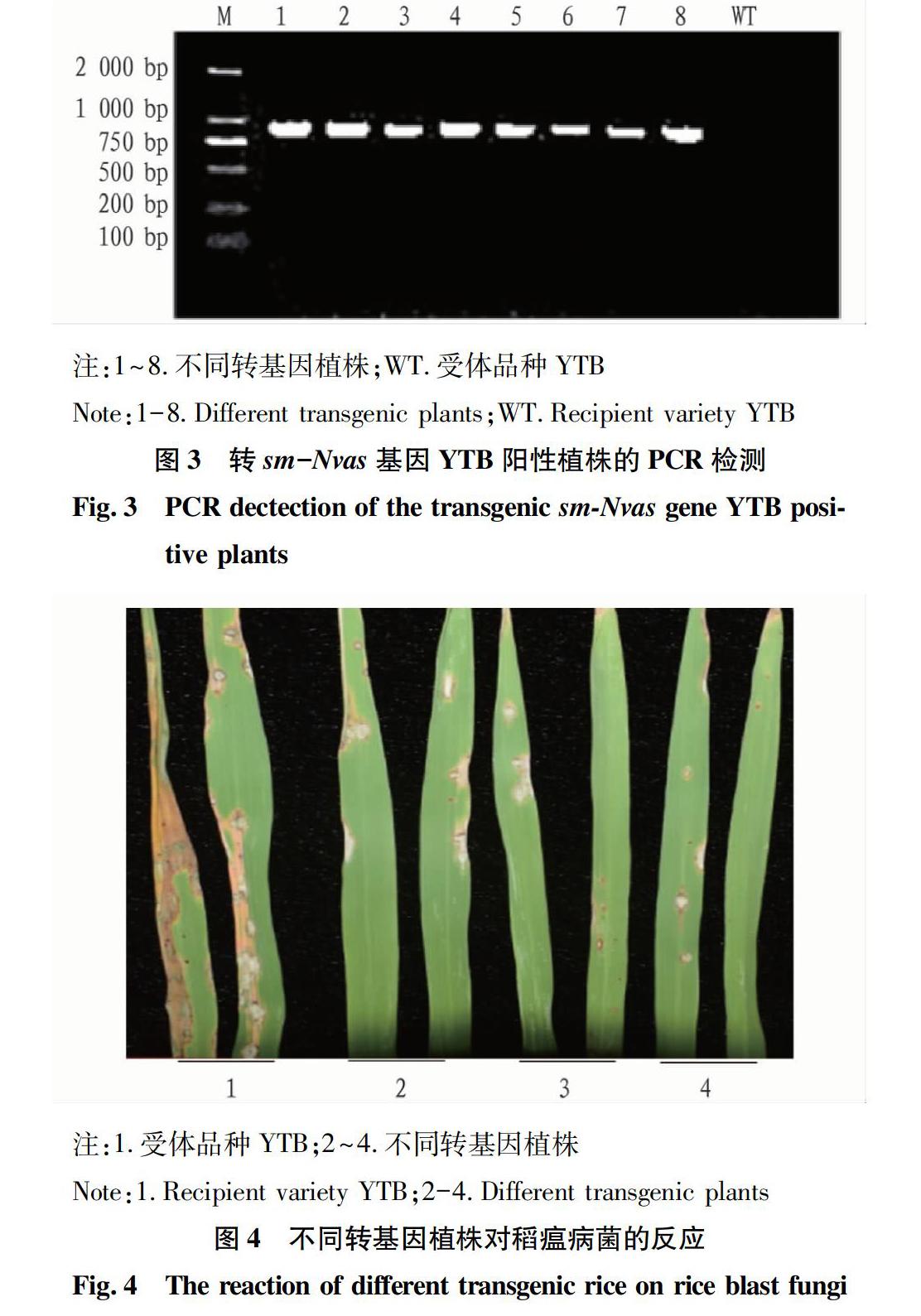
提取超表达sm-Nvas的转基因植株基因组DNA进行潮霉素抗性基因检测,阳性转基因植株能扩增出特异条带(800 bp左右),而对照组WT受体材料YTB没有,图3表明已成功获得转sm-Nvas的阳性植株。
2.3 转sm-Nvas基因水稻抗性鉴定
当转基因sm-Nvas水稻植株剑叶抽出来后,取剑叶与倒数第二叶进行稻瘟病菌race007离体接种,5 d后观察的结果显示阳性转基因植株与对照组YTB相比,染病的病斑面积、宽度和长度明显比对照组受体品种YTB的小(图4)。
3 讨论
越来越多的研究通过寻找合适的维管束相关基因来解决植物的病虫害问题,Chen等[11]研究发现GbaVd1和GbaVd2基因在拟南芥中提高了转基因株系维管束的木质化程度、增强了对大丽轮枝菌的抗性,表明GbaVd1和GbaVd2基因具有抗黄萎病功能。
该试验通过构建一个pCAMBIA1305.1-sm-Nvas双元表达载体,利用农杆菌介导成熟种子胚愈伤转化水稻。在研究转基因sm-Nvas水稻植株的抗性时,发现转基因sm-Nvas在水稻中具有水稻叶瘟抗性特征,其抗性机理正在研究中。该研究结果为弄清sm-Nvas基因在植物体内的生物学功能提供了重要参考。
参考文献
[1] ELO A,IMMANEN J,NIEMINEN K,et al.Stem cell function during plant vascular development[J].Semin Cell Dev Biol,2009,20(9):1097-1106.
[2] 杨郁文,张保龙,陈天子,等.棉花PGHNBS 启动子维管束特异表达元件的分离及功能研究[J].江苏农业学报,2012,28(6):1223-1228.
[3] 张明菊,王红梅,王书珍,等.植物对维管束病原菌的防卫反应机制研究进展[J].植物生理学报,2015,51(5):601-609.
[4] ZHANG B L,OUYANG Y N,XU J Y,et al.Cadmium remobilization from shoot to grain is related to pH of vascular bundle in rice[J].Ecotoxicol Environ Saf,2018,147:913-918.
[5] 李梦阳,彭冠云,邓彪,等.水稻维管束的研究进展[J].植物生理学报,2017,53(9):1586-1590.
[6] 杨泽峰,周勇,梁国华,等.陆生植物TAL基因的水平转移起源及对水稻维管束发育和产量性状的作用[C]//内蒙古民族大学、浙江省生物信息学学会.“农业健康与环境”组学大数据整合生物信息学研讨会论文集.杭州:浙江省科学技术协会,2017.
[7] 马玲.水稻维管束发育相关基因AVB的图位克隆与功能分析[D].重庆:西南大学,2016.
[8] SINGER S D,HILY J M,COX K D.The sucrose synthase1 promoter from Citrus sinensis directs expression of the βglucuronidase reporter gene in phloem tissue and in response to wounding in transgenic plants[J].Planta,2011,234(3):623-637.
[9] LIU X Q,XU X,WANG C T,et al.A novel family of gene expression induced by methyl Jasmonate in tobacco(Nicotiana tabacum)[C]//The international conference on status of plant,animal & microbe genome research XI.San Diego:[s.n],2003:833.
[10] 譚艳平,叶莲,何福收,等.烟草维管束发育相关基因Nvas启动子顺式作用元件鉴定[J].中南民族大学学报(自然科学版),2018,37(2):31-35.
[11] CHEN J Y,LI N Y,MA X F,et al.The ectopic overexpression of the cotton Ve1 and Ve2homolog sequences leads to resistance response to verticillium wilt in Arabidopsis[J].Front Plant Sci,2017,8:844.
