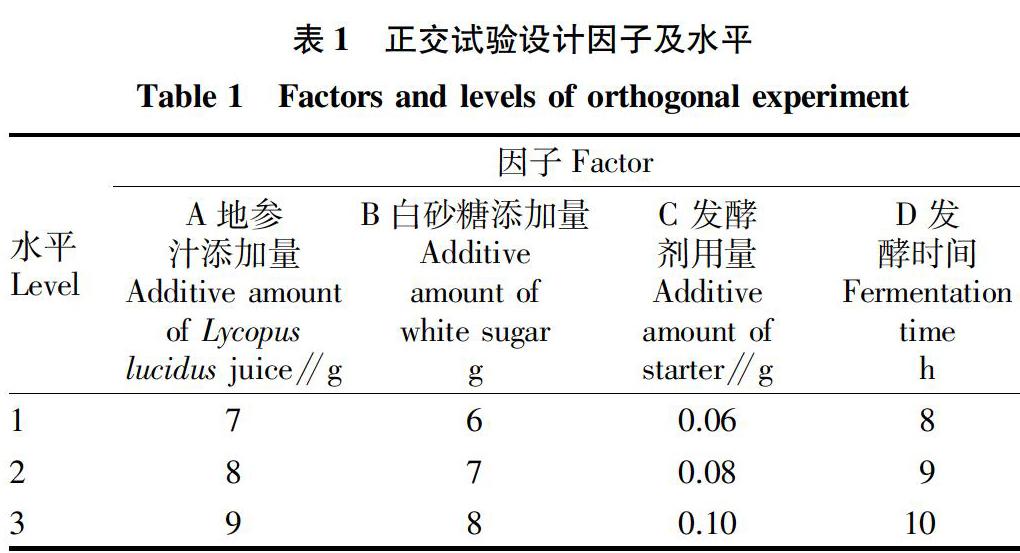
地参酸奶发酵工艺及抗氧化功效
2019-08-27姚佳伟刘彩琴汪瑜沁章锴男王嘉晟
姚佳伟 刘彩琴 汪瑜沁 章锴男 王嘉晟
摘要 为提高地参酸奶的抗氧化活性,通过单因素和正交试验考察了地参汁浓度及添加量、白砂糖添加量、发酵剂用量和发酵时间对地参酸奶抗氧化活性的影响。结果表明:抗氧化活性最好的酸奶最佳制作工艺为100 g牛奶中添加1∶25的地参汁9 g、白砂糖7 g、发酵剂0.10 g,发酵时间9 h,此时酸奶对羟基自由基清除率达67.89%,对DPPH清除率达44.80%,对超氧阴离子自由基清除率达44.89%,抗脂质活性87.43%,酸奶的感官性状良好。该产品拓展了地参的深加工通道,同时为地参酸奶研发提供了理论基础。
关键词 地参;酸奶;抗氧化活性
中图分类号 TS252.4文献标识码 A
文章编号 0517-6611(2019)14-0176-05
doi:10.3969/j.issn.0517-6611.2019.14.052
开放科学(资源服务)标识码(OSID):
Abstract In order to improve oxidation activity of Lycopus lucidus yogurt, singal factor and orthogonal experimental design were adopted to examine L. lucidus juice consistence and content, white sugar amount, inoculation amount and fermentation time. The results showed that the optimum conditions were 1∶25 L. lucidus juice 9 g, white sugar 7 g, inoculation amount 0.10 g to 100 g milk, and fermentation time 9 h. At this condition, the scavenging rate on hydroxyl radical, DPPH radical, superoxide anion radical and antilipid activity were 67.89%, 44.80%,44.89%,87.43%, respectively. Lycopus lucidus yogurt had good sensory properties. This research expanded the deep processing channel of L. lucidus and provided a theoretical basis for the development of L. lucidus yoghurt.
Key words Lycopus lucidus;Yogurt;Antioxidative activity
作者简介 姚佳伟(1997—),男,浙江临安人,从事食品质量与安全研究。*通信作者,副教授,博士,从事食品科学研究。
收稿日期 2019-02-26
氧化是生命必需的过程,氧化过程会产生活性氧。适量的活性氧自由基对于生理平衡是必要的,但是过量的自由基在体内会产生危害,如羟基自由基、超氧阴离子自由基等自由基能攻击生物膜磷脂中的多聚不饱和脂肪酸,触发脂质过氧化反应而产生各种中间产物,最终造成蛋白质、核酸、脑磷脂等发生交联并丧失活性[1],继而引发一些疾病如癌症、动脉粥样硬化、肝硬化、心血管疾病、糖尿病等[2-3]。近年研究表明,多种乳酸菌都具有抗氧化活性,并且经体内试验证实一些乳酸菌能够清除体内的自由基[4],或者改善低密度脂蛋白的组成[5]。但是乳酸菌不会直接进入血液而起到抗氧化的作用,乳酸菌抗氧化活性机制至今尚不清楚,乳酸菌中抗氧化物质的化学结构、性质、在肠道中的吸收以及体内所起的抗氧化机制还需进一步研究,但是国外正将具有抗氧化活性的乳酸菌应用于功能食品的开发和生产[6]。
目前市面上的酸奶品种较为单一,所以开发口感良好、营养丰富的发酵酸奶势在必行。无论从添加量、甜度,还是从经济因素方面考虑,白砂糖都是比较适合的酸奶甜味剂。但白砂糖含热量过高,且对高血糖、高血脂存在潜在危害。与白砂糖相比,一些功能性低聚糖能活化肠内双歧杆菌并促进其生长繁殖,不会引起牙齿龋变,有利于保持口腔卫生且使用量较少,价格相对较便宜,同时对高血糖、高血脂具有较好预防和缓解作用;而有些多糖的添加可以增强酸奶的营养和保健功能。
地参(Lycopus lucidus)为唇形科地笋属多年生草本植物,地上部分晒干后为常用中药泽兰,具有降血脂、通九窍、利关节、养气血等功能;地下部分为植物的核心部分,鲜作为蔬菜食用,晒干后可入药,功能与冬虫夏草相当,但是价格相对低廉[7]。其成分之一地参多糖是一类溶于水的生物大分子,具有抗氧化、抗肿瘤、抗衰老、降低血脂、提高免疫力等生物活性[8-10]。
基于市场需求和国民的身体健康,笔者将地参制成地参汁,按适宜比例加入纯牛奶、白砂糖和菌剂,通过产品抗氧化活性检测,优化酸奶生产工艺,以获得具有抗氧化活性的地参复配凝固型酸奶,以期为今后开发功能性地参酸奶奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料。
地参,购自浙江省宁波市;纯牛奶、白砂糖,购自超市;开菲尔酸奶发酵剂(北京川秀科技有限公司)。
1.1.2 试剂。
DPPH、邻苯三酚(Sigma公司);Tris-盐酸(Biosharp生物科技);亚油酸(上海阿拉丁生化科技股份有限公司);硫酸亚铁(南京化学试剂有限公司);双氧水(上海凌峰化学试剂有限公司);无水乙醇(安徽安特食品股份有限公司);水杨酸(天津市科密欧化学试剂有限公司);吐温-20(上海展云化工有限公司);磷酸二氢钾(国药集团化学试剂有限公司);磷酸氢二钠(湖州湖試化学试剂有限公司);氯化亚铁(南京化学试剂股份有限公司);硫氰酸铵(上海凌峰化学试剂有限公司);氢氧化钠(成都市科龙化工试剂厂)。以上试剂均为分析纯。
1.2 仪器与设备
ST-08B型高速万能粉碎机(永康市帅通工具有限公司);PL303电子分析天平(梅特勒-托利多仪器(上海)有限公司);DZF6050型真空干燥箱(上海精宏实验设备有限公司);台式高速冷冻离心机(Biofuge Primo R);UVmini-1240型紫外-可见分光光度计(岛津(香港)有限公司);气候箱(宁波江南仪器厂);冰箱(青岛海尔股份有限公司);HH-4型数显恒温水浴锅(金坛市江南仪器厂);酸度计(梅特勒-托利多仪器有限公司)。
1.3 方法
1.3.1 地参汁制作方法。
干地参洗干净并烘干,粉碎并过100目筛;称取适量地参粉加入水中,水开后煎熬30 min,后自然冷却;以5 000 r/min离心10 min,收集上清液并定容到100 mL的容量瓶中,即為地参汁,4 ℃冰箱保藏,备用。
1.3.2 地参酸奶制备。
地参汁、纯牛奶和白砂糖按一定比例配比并100 ℃杀菌10 min,后将菌种按一定比例接种于地参汁牛奶中,置于43 ℃气候箱中发酵至酸奶凝固,然后置于4 ℃的冰箱中进行后熟12 h。
1.3.3 测定方法。
后熟后的酸奶经5 000 r/min离心10 min,取上清液适量进行DPPH自由基清除率、超氧阴离子自由基清除率、羟基自由基清除率、抗脂质活性的测定。
1.3.3.1 DPPH自由基清除率测定方法。参考韩永佳[11] 的方法略改,将1 g的酸奶样品加入到9 mL 95%乙醇中,涡旋使其混合均匀,取2 mL 95%乙醇稀释的样品加入到0.5 mmol/L的DPPH溶液中或者95%乙醇(空白)中,混合均匀在室温反应30 min。反应结束后,在室温下13 000 r/min离心5 min,上清液在517 nm处测定吸光度。
DPPH自由基清除率=A空白对照-A样A空白对照×100%
1.3.3.2 超氧阴离子自由基清除率测定方法。按陈龙等[12]的方法略改,向pH 8.2、5.6 mL 50 mmol/L Tris-HCl 缓冲液中分别加入0.2 mL上清液,于25 ℃保温10 min,然后加入0.2 mL、25 ℃预温的60 mmol/L 邻苯三酚,静置反应 4 min 后,加 10 mol/L 盐酸两滴终止反应,在320 nm 处测其吸光度,空白试验以等量蒸馏水代替样品溶液,测定其吸光度 A空白对照。用5.6 mL Tris-HCl 缓冲液、0.2 mL 10 mmol/L HCl 及0.2 mL 样品溶液调零点,以扣除试样本身颜色的影响。
超氧阴离子自由基清除率=A空白对照-A样A空白对照×100%
1.3.3.3 羟基自由基清除率测定方法。采用水杨酸法,按周达等[13]的方法略改,在具塞试管中依次加入9.0 mmol/L FeSO4溶液2 mL、6 mmol/L水杨酸乙醇溶液2 mL、2 mL上清液和1 mmol/L H2O2 2 mL,摇匀,于37 ℃水浴中反应15 min,在510 nm下测定吸光度值A样。并按相同方法,测定不加样液的溶液的吸光度A对照,不加 H2O2的溶液的吸光度A无H2O2 样液本底,均以蒸馏水为参比。
1.5 最优条件评价方法
采用模糊综合评价法[15],即根据极值标准化公式Zij=(Xij-Xijmin)/(Xijmax-Xijmin)将原始抗氧化、抗脂质活性指标值无量纲化置闭区间[0,1]上,其中Xij为第i个试验组第j个检测指标值,Xijmax、Xijmin分别为第i个试验组第j个检测指标的最大值和最小值。综合评价值Zi=Zij(i=1,2,…,6;j=1,2,…,4),利用该评判法则对抗氧化活性进行综合评价,从中选择最优条件。
1.6 数据处理
所有试验数据均为3个重复的平均值,数据经Excel分析和处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 地参汁浓度对酸奶抗氧化活性的影响。
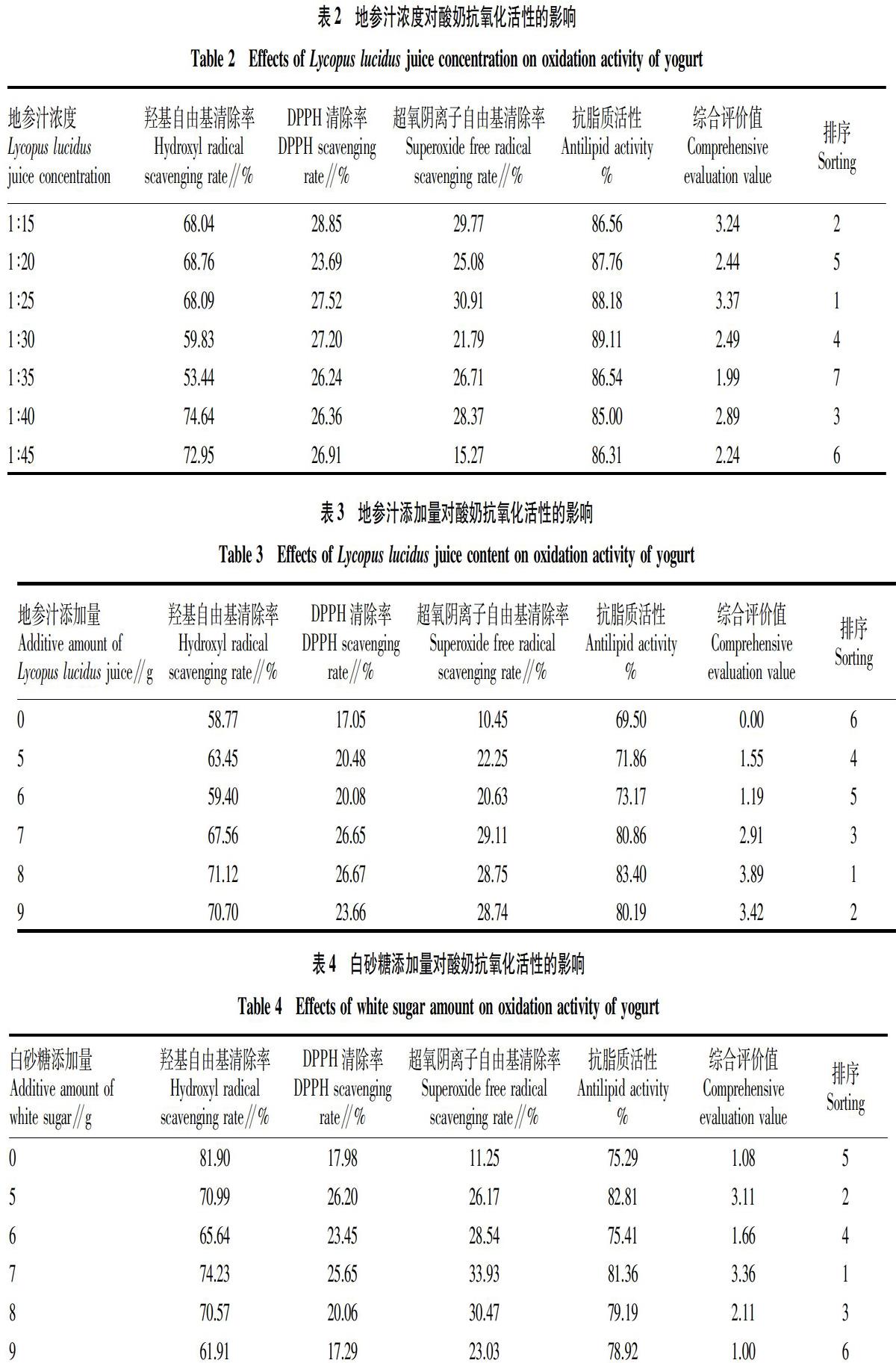
由表2可知,以不同浓度地参汁做成的酸奶均有一定的抗氧化活性,对羟基自由基的清除率为53.44%~74.64%,并以1∶40的浓度组清除率最高;对DPPH的清除率为23.69%~28.85%,并以1∶15的浓度组清除率最高;对超氧阴离子自由基的清除率为15.27%~30.91%,并以1∶25的浓度组清除率最高;抗脂质活性为85.00%~89.11%,并以1∶30的浓度组最高;以综合评价值来看,浓度为1∶25的地参汁评价最高,故以下试验地参汁浓度为1∶25。
2.1.2 地参汁添加量对酸奶抗氧化活性的影响。
由表3可知,添加地参汁组对羟基自由基的清除率为59.40%~71.12%,而没添加组的清除率为58.77%,并以8 g的添加量清除率最高;添加地参汁组对DPPH的清除率为20.08%~26.67%,而没添加组的清除率为17.05%,并以8 g的添加量清除率最高;添加地参汁组对超氧阴离子自由基的清除率为20.63%~29.11%,而没添加组的清除率为10.45%,并以7 g的添加量清除率最高;添加地参汁组抗脂质活性为71.86%~83.40%,而没添加组的抗脂质活性为69.50%,并以8 g的添加量清除率最高;以综合评价值来看,地参汁添加量为8 g评价值最高,而非添加组综合评价最低,说明地参汁可以提高酸奶的抗氧化活性,以下试验地参汁添加量为8 g。
2.1.3 白砂糖添加量对酸奶抗氧化活性的影响。
由表4可知,白砂糖添加组对羟基自由基的清除率为61.91%~74.23%,而没添加组的清除率为81.90%,并以没添加组清除率最高;添加组对DPPH的清除率为17.29%~26.20%,而没添加组的清除率为17.98%,并以5 g的添加量清除率最高;添加组对超氧阴离子自由基的清除率为23.03%~33.93%,而没添加组的清除率为11.25%,并以7 g的添加量清除率最高;添加组抗脂质活性为75.41%~82.81%,而没添加组的抗脂质活性为75.29%,并以5 g的添加量清除率最高;以综合评价值来看,白砂糖添加量为7 g时评价最高,故以下试验白砂糖添加量为7 g。
2.1.4 发酵剂用量对酸奶抗氧化活性的影响。
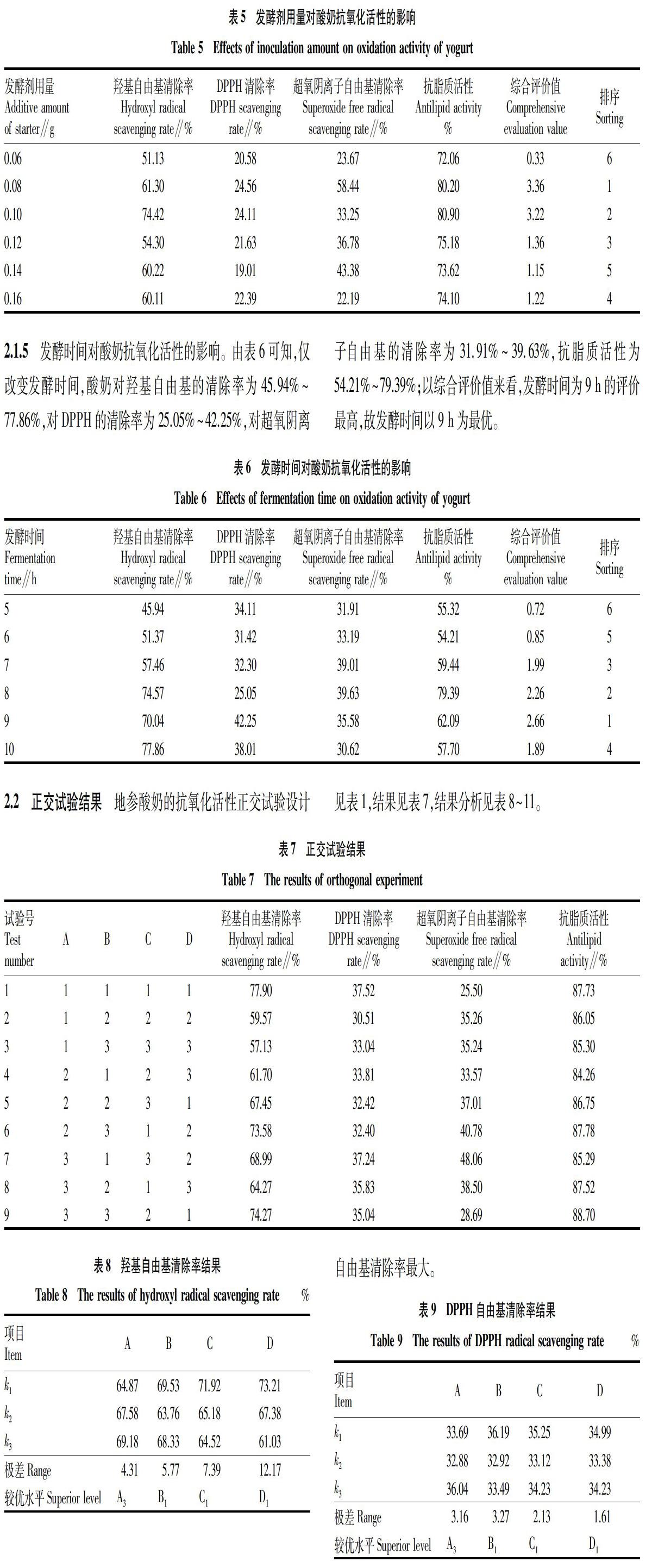
由表5可知,发酵剂用量不同,酸奶对羟基自由基的清除率为51.13%~74.42%,并以0.10 g的添加量清除率最高;对DPPH的清除率为19.01%~24.56%,并以0.08 g的添加量清除率最高;对超氧阴离子自由基的清除率为22.19%~58.44%,并以0.08 g的添加量清除率最高;抗脂质活性为72.06%~80.90%,并以0.10 g的添加量清除率最高;以综合评价值来看,发酵剂用量为0.08 g时评价最高,故以下试验发酵剂用量为0.08 g。
2.1.5 发酵时间对酸奶抗氧化活性的影响。
由表6可知,仅改变发酵时间,酸奶对羟基自由基的清除率为45.94%~77.86%,对DPPH的清除率为25.05%~42.25%,对超氧阴离子自由基的清除率为31.91%~39.63%,抗脂质活性为54.21%~79.39%;以综合评价值来看,发酵时间为9 h的评价最高,故发酵时间以9 h为最优。
2.2 正交试验结果
地参酸奶的抗氧化活性正交试验设计见表1,结果见表7,结果分析见表8~11。
3 结论
目前,植物源的天然抗氧化剂有维生素C、生育酚、类胡萝卜素、类黄酮和多糖。维生素C常存在于植物组织中,具有水溶性,对超氧阴离子自由基、H2O2、羟基自由基和单线态氧有较好的清除能力[1];生育酚常存在于植物油中,具有油溶性,主要抑制脂质过氧化[16];类黄酮常以糖苷的形式存在于植物组织中,具有水溶性,能清除超氧阴离子自由基[17-18]、脂质过氧化自由基[19]和羟基自由基[20];多糖主要抑制脂质过氧化,清除羟基自由基、超氧阴离子自由基和单线态氧[21];与其他天然抗氧化剂相比,类胡萝卜素的抗氧化能力较弱,它主要猝灭单线态氧[22]。抗氧化活性评价方法中,DPPH清除率常用来评价酚类、儿茶酚和苯胺的抗氧化活性[23]。
从试验结果来看,地参汁酸奶对羟基自由基和抗脂质活性较高,而对DPPH的清除率和超氧阴离子自由基的清除率较低,这可能与地参汁水提工艺有关,该工艺对水溶性的维生素C、类黄酮和多糖有较好的提取效果,具体哪类物质含量高还有待进一步的试验研究。
从抗氧化角度来看,地参汁酸奶较佳的加工工艺为100 g 的牛奶中添加浓度为1∶25的地参汁9 g、白砂糖7 g、发酵剂0.10 g,发酵时间9 h,此时酸奶对羟基自由基清除率67.89%,对DPPH清除率44.80%,对超氧阴离子自由基清除率44.89%,抗脂质活性87.43%,酸奶的感官性状良好,酸度(°T)≥70.0,符合发酵乳的标准。
参考文献
[1] GLIN I.Antioxidant activity of food constituents:An overview[J].Arch Toxicol,2012,86(3):345-391.
[2] SRBU C,CASONI D.Comprehensive evaluation of biogenic amines and related drugs antiradical activity using reactive 2,2diphenyl1picrylhydrazyl(DPPH)radical[J].Cent Eur J Chem,2013,11(5):679-688.
[3] 李建喜,杨志强,王学智.活性氧自由基在动物机体内的生物学作用[J].动物医学进展,2006,27(10):33-36.
[4] MADHU A N,AMRUTHA N,PRAPULLA S G.Characterization and antioxidant property of probiotic and synbiotic yogurts[J].Probiotics & Antimicro Prot,2012,4(2):90-97.
[5] 王俊国,孟和毕力格,包秋华,等.植物乳杆菌LIP-1 对高脂血症大鼠血脂的调节作用[J].中国食品学报,2013,13(2):6-12.
[6] DU TOIT M,ENGELBRECHT L,LERM E,et al.Lactobacillus:The next generation of malolactic fermentation starter cultures—An overview[J].Food Bioprocess Technol,2011,4(6):876-906.
[7] 國家中医药管理局《中华本草》编委会.中华本草[M]上海:上海科学技术出版社,1999:558-559.
[8] 林春榕,左绍远,熊伟,等.地参多糖对 D-半乳糖所致衰老小鼠的抗氧化作用研究[J].安徽农业科学,2012,40(18):9646-9647.
[9] 熊伟,焦扬,罗永会,等.地参多糖对实验肿瘤细胞体内外增殖的影响[J].生物加工过程,2012,10(4):64-69.
[10] 熊伟,陈贵元,谭德勇,等.野生地参多糖对四氧嘧啶致糖尿病小鼠血糖和血脂的影响[J].生物加工过程,2011,9(6):45-48.
[11] 韩永佳.功能型酸奶的理化特性、抗氧化活性及微观结构的研究[D].合肥:合肥工业大学,2016.
[12] 陈龙,李文峰,令博,等.金耳、银耳、木耳多酚提取及其抗氧化活性[J].食品科学,2011,32(20):52-56.
[13] 周达,罗成,鲁晓翔.玫瑰花总黄酮微波辅助提取及其抗氧化研究[J].食品工业科技,2010,31(4):269-272,276.
[14] 骞宇,赵欣,李银聪,等.青藏高原自然发酵牦牛酸奶中乳酸菌的抗氧化能力的研究[J].食品工业科技,2014,35(3):119-122.
[15] 王宏雨,谢宝贵,邓优锦,等.45种食用菌液体发酵产物的抗氧化活性[J].福建农林大学学报(自然科学版),2010,39(1):84-89.
[16] DIPLOCK A T,CHARLEUX J L,CROZIERWILLI G,et al.Functional food science and defence against reactive oxidative species[J].Brit J Nut,1998,80(S1):77-112.
[17] ROBAK J,GRYGLEWSKI R J.Flavonoids are scavengers of superoxide anions[J].Biochem Pharmacol,1988,37(5):837-841.
[18] HU J P,CALOMME M,LASURE A,et al.Structureactivity relationship of flavonoids with superoxide scavenging activity[J].Biol Trace Element Res,1995,47(1/2/3):327-331.
[19] TAKAHAMA U.Inhibition of lipoxygenasedependent lipid peroxidation by quercetin:Mechanism of antioxidative function[J].Phytochemistry,1985,24(7):1443-1446.
[20] HUSAIN S R,CILLARD J,CILLARD P,et al.Hydroxyl radicalscavenging activity of flavonoids[J].Phytochemistry,1987,26(9):2489-2491.
[21] 俞慧紅,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-175.
[22] PRIOR R L,WU X,SCHAICH K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].J Agric Food Chem,2005,53(10):4290-4302.
[23] ROGINSKY V,LISSI E A.Review of methods to determine chainbreaking antioxidant activity in food[J].Food Chem,2005,92(2):235-254.
